26. lokakuuta 2020, by NCI Staff
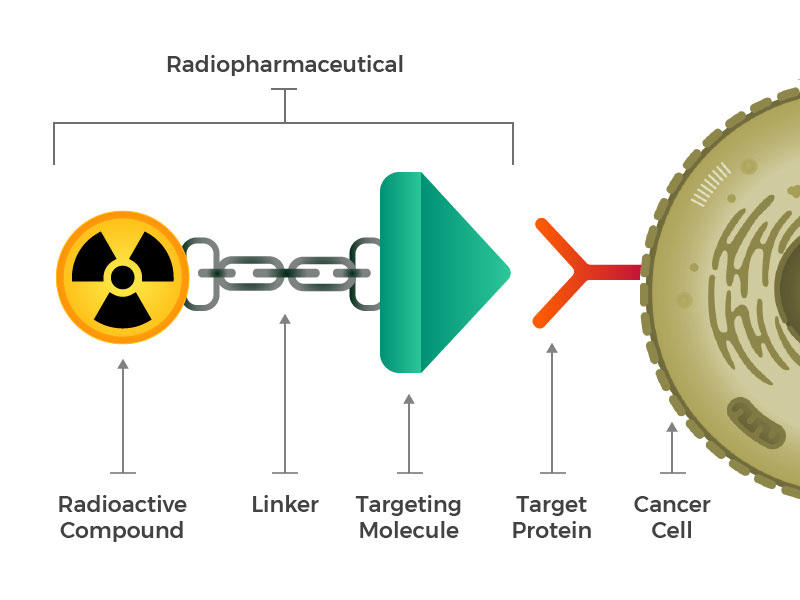
radiofarmaseuttiset aineet koostuvat radioaktiivisesta molekyylistä, kohdemolekyylistä ja näitä kahta yhdistävästä linkittäjästä.
kahden viime vuosikymmenen aikana monien syöpätyyppien hoito on muuttunut huomattavasti. Täsmähoidot sammuttavat syöpäsoluista tiettyjä proteiineja, jotka auttavat niitä kasvamaan, jakautumaan ja leviämään. Immunotherapies edistää tai tukahduttaa kehon immuunijärjestelmää auttaa taistelemaan syöpää. Mutta pitkään käytetyt hoidot — leikkaus, kemoterapia ja sädehoito — ovat edelleen useimpien syöpien hoidon selkäranka.
sädehoitoa käytettiin syövän hoitoon ensimmäisen kerran yli 100 vuotta sitten. Noin puolet kaikista syöpäpotilaista saa sitä edelleen jossain vaiheessa hoitonsa aikana. Ja viime aikoihin asti, useimmat sädehoitoa annettiin paljon kuin se oli 100 vuotta sitten, antamalla säteitä säteilyä kehon ulkopuolelta tappaa kasvaimia kehossa.
vaikka ulkoinen säteily on tehokasta, se voi aiheuttaa myös sivullisia vahinkoja. Jopa nykyaikaisilla sädehoitolaitteilla ”täytyy olla normaalia kudosta päästäkseen kasvaimeen”, sanoi Charles Kunos, MD, Ph. D., NCI: n Cancer Therapy Evaluation Program (CTEP). Seurauksena haittavaikutuksia sädehoidon riippuu alueen kehon käsitelty, mutta voi sisältää maku, ihomuutokset, hiustenlähtö, ripuli, ja seksuaalisia ongelmia.
nyt tutkijat kehittävät uuden luokan lääkkeitä, joita kutsutaan radiofarmaseuttisiksi lääkkeiksi, jotka antavat sädehoitoa suoraan ja nimenomaan syöpäsoluihin. Uusien radiofarmaseuttisten lääkkeiden tutkimus ja kliiniset tutkimukset ovat lisääntyneet räjähdysmäisesti viime vuosina.
nämä tutkimukset ovat osoittaneet, että sädehoidon kohdentaminen solutasolla voi vähentää sekä lyhyt – että pitkäaikaisten hoidon haittavaikutusten riskiä ja samalla mahdollistaa pienienkin syöpäsoluesiintymien tappamisen koko kehossa.
”luulen, että he aikovat muuttaa säteilyn onkologian seuraavien 10-15 vuoden aikana”, tohtori Kunos sanoi.
luonnollisen affiniteetin luominen
säteilyn antaminen suoraan soluihin ei sinänsä ole uusi lähestymistapa. Radioaktiivista jodia on 1940-luvulta lähtien käytetty joidenkin kilpirauhassyöpätyyppien hoitoon. Alkuaineesta voidaan valmistaa radioaktiivinen versio laboratoriossa. Nieltynä (pillerinä tai nesteenä) se kertyy kilpirauhasleikkauksen jälkeen jäljelle jääneisiin syöpäsoluihin ja tappaa ne.
samanlaista luonnollista affiniteettia käytettiin myöhemmin hyväksi luustoon levinneen syövän hoitoon tarkoitettujen lääkkeiden kehittämisessä, kuten radium 223-dikloridi (Xofigo), joka hyväksyttiin vuonna 2013 metastaattisen eturauhassyövän hoitoon. Kun syöpäsolut kasvavat luussa, ne saavat valtaamansa luukudoksen hajoamaan. Sitten keho yrittää korjata tämän vaurion korvaamalla tuon luun-prosessia kutsutaan luun vaihtumiseksi.
radioaktiivinen alkuaine radium ”näyttää kalsiummolekyyliltä, joten se kiinnittyy kehon alueisiin, joilla luun vaihtuvuus on suurinta”, kuten alueisiin, joilla syöpä kasvaa, Tri Kunos selitti. Radium pystyy sitten tappamaan lähellä olevia syöpäsoluja.
nämä radioaktiiviset yhdisteet kulkeutuvat kaikki syöpäsoluihin ilman apua. Tutkijat pohtivat, olisiko mahdollista kehittää uusia radioaktiivisia molekyylejä, jotka kohdistuisivat nimenomaan muihin syöpiin.
he visioivat suunniteltuja radiofarmaseuttisia valmisteita, jotka koostuvat kolmesta päärakennusosasta: radioaktiivisesta molekyylistä, kohdentavasta molekyylistä (joka tunnistaa ja kiinnittyy nimenomaan syöpäsoluihin) ja linkkeristä, joka yhdistää nämä kaksi. Tällaisia yhdisteitä voitaisiin injektoida, infusoida, hengittää tai niellä ja sitten päästä verenkiertoon.
ajatus syöpään tähtäävän molekyylin yhdistämisestä syöpäsoluja tappavaan molekyyliin ei myöskään ole Uusi. Esimerkiksi syövän hoitoon on hyväksytty useita vasta–aine-lääkekonjugaateiksi kutsuttuja lääkkeitä, joissa tiettyihin syöpäsoluihin sitoutuva vasta-aine on yhteydessä myrkylliseen lääkkeeseen.
mutta yritykset luoda tällaisia lääkkeitä ovat saavuttaneet heikon menestyksen, tohtori Kunos selitti, koska ei riitä, että myrkkyjä tuodaan lähelle syöpäsolua. Myrkyt on otettava sisälle ja pysyttävä solujen sisällä niin kauan, että ne aiheuttavat vahinkoa. Monet syöpäsolut ovat tai kehittää mekanismeja yksinkertaisesti pumppaa myrkkyjä takaisin ulos ennen kuin se voi tapahtua.
radiofarmaseuttiset lääkkeet toimivat myös parhaiten, kun lääkkeet pääsevät solujen sisälle. Mutta se ei ole välttämätöntä, jotta ne olisivat tehokkaita. Kun radiofarmaseuttinen aine on kiinnittynyt syöpäsoluun, radioaktiivinen yhdiste hajoaa luonnostaan. Hajoamisesta vapautuu energiaa, joka vaurioittaa lähisolujen DNA: ta. Kun solun DNA vaurioituu peruuttamattomasti, solu kuolee. Syöpäsolut ovat erityisen herkkiä säteilyn aiheuttamille DNA-vaurioille.
riippuen käytetystä radioaktiivisesta yhdisteestä syntyvä energia voi tunkeutua soluun sitoutuneena radiofarmaseuttiseen soluun sekä noin 10-30 solua ympäröivään soluun. Tämä lisää niiden syöpäsolujen määrää, jotka voidaan tappaa yhdellä radiofarmaseuttisella molekyylillä.
2010-luvun puoliväliin mennessä Food and Drug Administration (FDA) oli hyväksynyt kaksi radiofarmaseuttista lääkettä, jotka kohdistavat molekyylejä tiettyihin B-soluihin joidenkin non-Hodgkin-lymfooman, erään verisyöpätyypin, hoitoon. Mutta näitä lääkkeitä ei koskaan laajalti hyväksytty. Vain harvoja lymfoomapotilaita hoitavia lääkäreitä koulutettiin antamaan tällaisia radioaktiivisia yhdisteitä. Ja radiofarmaseuttiset lääkkeet kilpailivat uudempien, ei-radioaktiivisten lääkkeiden kanssa.
alan pelinvaihtaja tuli vuonna 2018, sanoi NCI: n Säteilytutkimusohjelman tohtori Jacek Capala, kun FDA hyväksyi Lutetium Lu 177-dotataatin (Lutathera) tiettyjen ruuansulatuskanavaan vaikuttavien syöpäisten neuroendokriinisten kasvainten (verkkojen) hoitoon.
”tämä osoitti, että kiinteitä kasvaimia voidaan kohdistaa myös tällä tavalla”, hän sanoi tyhjästä rakennetulla radiofarmaseuttisella laitteella. Tällöin kohteina ovat tietyt hormonireseptorit, joita on runsaasti verkkosolujen pinnalla.
Lutetium Lu 177-dotataatti hidasti nettokasvua paremmin kuin mikään aikaisempi testattu lääke, selitti Aman Chauhan Kentuckyn yliopistosta, joka johtaa useita uusia lääkkeen kliinisiä tutkimuksia. ”Tämä oli valtava askel eteenpäin meidän kentällemme”, hän sanoi.
Adapting Drugs from Imaging Compounds
tutkijat suunnittelevat ja testaavat nyt radiofarmaseuttisia lääkkeitä erilaisiin syöpiin, kuten melanoomaan, keuhkosyöpään, paksusuolisyöpään ja leukemiaan, sanoi Tri Capala. Mitä tahansa kasvainta, jonka solujen pinnalla on kohdentuva molekyyli ja hyvä verenkierto—joka riittää lääkkeiden antamiseen—voitaisiin mahdollisesti hoitaa radiofarmaseuttisilla lääkkeillä, lisäsi Tri Chauhan.
monet näistä uudemmista lääkkeistä ovat uudelleen suunniteltuja versioita olemassa olevista ydinkuvantamisessa käytettävistä yhdisteistä. Ydinkuvantamiskokeissa, kuten positroniemissiotomografiassa (PET), käytetään joskus heikosti radioaktiivisia yhdisteitä, jotka ovat sidoksissa syöpäsolujen pinnalla oleviin tiettyihin kohteisiin sitoutuviin molekyyleihin. Erikoiskamerat voivat sitten paljastaa pieniäkin syöpäsolukertymiä, mikä auttaa mittaamaan syövän leviämistä elimistössä.
tutkijat ovat nyt ottaneet nämä kohdemolekyylit uudelleen käyttöön kuljettaakseen niiden sijaan voimakkaampia radioaktiivisia yhdisteitä eli isotooppeja—sellaisia, jotka voisivat tappaa syöpäsoluja sen sijaan, että ne vain auttaisivat visualisoimaan niitä.
eturauhassyöpä on ollut varhainen testialusta tähän uusintakäyttöön. Psma-nimistä proteiinia on runsaasti—ja lähes yksinomaan-eturauhassoluissa. Fuusioimalla PSMA: han sitoutuvan molekyylin PET-kuvantamisessa käytettävään radioaktiiviseen yhdisteeseen tutkijat ovat kyenneet havainnoimaan pieniä eturauhassyöpäkerrostumia, jotka ovat liian pieniä, jotta ne voitaisiin havaita tavanomaisella kuvantamisella.
useita psma: han kohdistuvia radiofarmaseuttisia hoitoja testataan nyt kliinisissä tutkimuksissa.
useimmat eturauhassyövät ovat hyvin herkkiä säteilylle, ja ulkoista säteilyä käytetään yleisesti taudin hoitoon, selitti Frank Lin, MD, NCI: n Cancer Research-keskuksesta, joka johtaa kliinistä tutkimusta yhdestä PSMA: han kohdistuvasta radiofarmaseuttisesta tutkimuksesta NIH: n kliinisessä keskuksessa.
useimmat miehet, jotka saavat sädehoitoa, eivät koe syövän uusiutumista. Mutta jos niin käy, se leviää joskus koko kehoon, ja monissa elimissä on paljon pieniä syöpäsolukertymiä, hän selitti.
”kun kasvain on levinnyt tuolla tavalla, ei voi oikeastaan enää tehdä ulkoista sädesäteilyä, koska ulkoinen säteily voi keskittyä ja hoitaa vain pientä osaa kehosta kerrallaan”, Lin sanoi.
Psma: han kohdistuva radiofarmaseuttinen lääke on parempi tapa antaa säteilyä näissä tapauksissa, koska se voidaan infusoida suoraan verenkiertoon ja kiertää laajalti kiinnittyen eturauhassyöpäsoluihin, jotka ovat levinneet koko kehoon, hän selitti.
ja kuvantamisen ja hoitomolekyylien suuri etu, jotka käyttävät samaa kohdetta, on se, että kuvantaminen voi sitten antaa lääkäreille esikatselun siitä, onko hoito todennäköisesti toimiva, lisäsi tohtori Lin.
esimerkiksi Dr. Linin tutkimuksessa miehille on tehtävä Pet-kuvaus yhdisteen kuvantamisversiolla ennen hoitoa. Jos kuvantamisyhdiste löytää tiensä syöpäsoluihin ja se havaitaan PET-kuvauksessa, tutkijat voivat olettaa, että vastaava radiofarmaseuttinen hoito osuu kohteeseensa.
”tämä diagnostiikan toisiaan täydentävä kehittäminen yhdessä lääkehoitojen kanssa tekee tästä alasta niin paljon jännittävämmän”, sanoi Tri Chauhan. ”Näin voimme tietää, että toimitamme hoidon suoraan kasvainsoluihin.”
siirtyminen Yhdistelmähoitoihin
vaikka radiofarmaseuttiset lääkkeet ovat osoittautuneet lupaaviksi varhaisissa tutkimuksissa, ne ovat myös, kuten muidenkin syöpälääkkeiden tapauksessa, epätodennäköisiä poistamaan kasvainta itsestään.
esimerkiksi lutetium Lu 177-dotataatti yli kaksinkertaisti niiden ihmisten määrän, joiden neuroendokriiniset kasvaimet kutistuivat hoidon jälkeen, mutta määrä oli silti vaatimaton: noin 17%, 7%: sta ylöspäin ilman lääkettä, selitti Tri Chauhan.
”parantamisen varaa on vielä huomattavasti”, hän sanoi.
radiofarmaseuttisten lääkkeiden käyttö yhdessä muiden hoitojen kanssa voi olla yksi tapa edistää tätä paranemista. Jotkut tutkijat testaavat nykyään radioaktiivisia lääkkeitä yhdistettynä säteilylle herkistäviin lääkkeisiin—lääkkeisiin, jotka tekevät syöpäsoluista entistä alttiimpia säteilylle. Esimerkiksi Tri Chauhan johtaa kliinistä tutkimusta lutetium Lu 177-dotataatista yhdistettynä säteilyherkistäjään nimeltä triapiini, joka estää soluja tuottamasta yhdisteitä, joita tarvitaan DNA: n korjaamiseen säteilyn aiheuttamien vaurioiden jälkeen.
toisessa tutkimuksessa tohtori Lin testaa lutetium Lu 177-dotataattia PARP-estäjäksi kutsutulla lääkkeellä. Nämä lääkkeet, jotka on jo hyväksytty hoitamaan tietyntyyppisiä rinta -, munasarja-ja muita syöpiä, estävät DNA: n korjausprosessin. ”Säteily siis aiheuttaisi DNA-vaurion, ja PARP-inhibiittori estäisi syöpäsoluja parantamasta DNA: taan säteilyn jälkeen”, hän selitti.
muut tutkijat yhdistävät radiofarmaseuttisia lääkkeitä immunoterapioihin pyrkiäkseen lisäämään näiden lääkkeiden tehoa. ”Viimeaikaiset tutkimukset ovat osoittaneet, että radiofarmaseuttiset lääkkeet voivat saada kasvaimet reagoimaan paremmin immunoterapiaan”, sanoi Tri kapala.
monet kasvaimet ovat” kylmiä ” kasvaimia, hän selitti, että immuunisolut eivät tunnista niitä tai eivät toimi kunnolla kasvainten ympärillä olevassa mikroympäristössä, hän selitti.
mutta kun säteily tappaa syöpäsoluja, näiden solujen proteiinit ja DNA voivat vuotaa verenkiertoon immuunisolujen nähtäväksi, jolloin immuunisolut voivat tunnistaa ja tappaa muita syöpäsoluja koko kehossa. Sädehoito voi myös tehdä kasvaimen mikroympäristöstä vieraanvaraisemman immuunisoluille, lisäsi tohtori Capala.
yhdessä nämä vaikutukset voivat muuttaa kylmän kasvaimen ”kuumaksi” kasvaimeksi: sellaiseksi, jossa on runsaasti immuunisoluja ja joka saattaa reagoida immunoterapialääkkeisiin. Joissakin tutkimuksissa on kokeiltu ulkoisen säteilyn käyttöä tällaisen vasteen aikaansaamiseksi.
” mutta on olemassa tietoja, jotka viittaavat siihen, että toimii paremmin, jos jokainen kasvain, jokainen etäpesäke, altistetaan säteilylle. Joten radiofarmaseuttisella hoidolla on siinä etu, että kun se on kehossa, se saavuttaa kaikki etäpesäkkeet”, tohtori kapala selitti.
voi olla jopa järkevää yhdistää radiofarmaseuttiset lääkkeet ulkoiseen säteilyyn, kunhan huolellisella hoitosuunnittelulla voidaan varmistaa turvallinen kokonaissäteilyannos, lisäsi tohtori Capala. ”Ulkoinen sädehoito on erittäin hyvä kohdistamaan suuria kasvaimia, ja sitten voit yhdistää sen radiofarmaseuttinen hoito kohdistaa etäpesäkkeitä,” hän sanoi.
haasteet ja varoitukset
radiofarmaseuttisten lääkkeiden ala on vielä alkutekijöissään. Yksi haaste, joka lähestymistavan on voitettava, ennen kuin sitä voidaan käyttää laajemmin, on pula lääkäreistä, jotka on koulutettu antamaan tällaisia lääkkeitä.
”isotooppilääketieteen lääkärien määrä Yhdysvalloissa on pieni”, sanoi tohtori Lin, jolla on koulutusta sekä isotooppilääketieteessä että syöpälääketieteessä. ”Ja luulen, että me vain kouluttaa ehkä 70 tai 80 uutta ihmistä vuodessa.”
tähän mennessä tämä työvoimapula on estänyt radiofarmaseuttisia lääkkeitä käyttämästä todellista potentiaaliaan henkilökohtaisena hoitona, selitti Tri Capala. Tämä potentiaali kuvastaa sitä, että toisin kuin muiden syöpälääkkeiden kanssa, lääkärit voivat käyttää kuvantamista mittaamaan tarkasti, kuinka paljon radioaktiivista lääkettä on saavuttanut kasvaimen, lähes reaaliajassa, ja säätää annosta sen mukaisesti.
mutta tämäntyyppinen hoidon suunnittelu edellyttää monitieteistä asiantuntemusta, jota ei ole laajalti saatavilla ja joka on jättänyt ihmiset käyttävät radiofarmaseuttisia lääkkeitä enemmän kuin ”radioaktiivinen kemoterapia”, jossa yksi koko sopii kaikille annos, hän lisäsi. ”Tämä tarkoittaa sitä, että monet potilaat eivät saa optimaalista hoitoa”, sanoi tohtori Capala.
tarvitaan myös pitkäaikaisia turvallisuustutkimuksia, lisäsi tohtori Chauhan. Ulkoisella sädehoidolla hoidetuilla henkilöillä voi esiintyä joitain haittavaikutuksia, joita kutsutaan myöhäisiksi vaikutuksiksi—kuten toisen syövän kehittyminen—kuukausia tai vuosia hoidon jälkeen. Vaikka tähänastiset tutkimukset eivät ole osoittaneet radiofarmaseuttisen hoidon myöhäisvaikutusten suurta määrää, ”nämä ovat hyvin uusia aineita, ja meidän on edelleen oltava varovaisia ja seurattava niitä”, hän sanoi.
silottava yhteistyö
koska nämä lääkkeet ovat suhteellisen uusia, vaikka tutkimukset ovat käynnissä, ”olemme vasta raapaisemassa radiofarmaseuttisten lääkkeiden kehittämisen pintaa”, Tri Chauhan sanoi.
vuonna 2019 NCI käynnisti radiofarmaseuttisen Kehitysaloitteen (Radiofarmaseutical Development Initiative, RDI) nopeuttaakseen lupaavia uusia lääkkeitä kliinisiin testeihin.
yksi asia, jonka NCI toivoo saavuttavansa TKI: n avulla, on se, että se välittäisi lisää kokeita, joissa käytetään eri lääkeyhtiöiden valmistamia lääkeyhdistelmiä, jotka eivät ehkä muuten tekisi yhteistyötä, selitti aloitetta johtava tohtori Kunos. Huoli immateriaalioikeuksista ja luottamuspula voivat pysäyttää tällaiset hankkeet ennen kuin ne alkavat, tohtori Kunos selitti.
”tämäntyyppistä yhteistyötä ei välttämättä tapahtuisi, ellei NCI olisi rehellinen välittäjä keskellä”, hän sanoi. Juuri nyt vain noin 2% NCI: n tukemista varhaisen vaiheen tutkimuksista testaa radiofarmaseuttisia lääkkeitä, mutta TKI: n myötä tämä saattaa kasvaa eksponentiaalisesti lähivuosina, hän lisäsi.
”emme aio poistaa koneita tai muita tekniikoita, joita käytämme sädehoidossa”, tohtori Kunos sanoi. ”Mutta kohdistetun luonteensa vuoksi uskomme, että radiofarmaseuttiset lääkkeet tulevat muuttamaan sitä, miten käytämme säteilyä.”