- Vsmc: n plastisuus fysiologiassa ja taudissa
- VSMCs vaikuttaa adventitia-immuunivasteeseen Hyperlipideemisillä hiirillä
- vanheneminen vai aikaistuminen vai molemmat?
- vasta muodostuneet Adventiittirakenteet osallistuvat atlon toimintaan edistämällä lymfosyyttien kiertoa
- Atlon muodostuminen on erittäin Territoriaalista, mikä viittaa siihen, että signaalit välittyvät Plakeista Adventiaan lymfaattisen kudoksen organisoijan kaltaisen Vsmcs: n kautta
- VSMCs myötävaikuttaa suoraan adventitia-immuniteettiin ateroskleroosissa
- johtopäätös
- Tekijäosuudet
- Rahoitus
- Eturistiriitalausunto
Vsmc: n plastisuus fysiologiassa ja taudissa
verisuonten sileälihassolut (Vsmcs) ovat keskisuurten ja suurten valtimoiden pääkomponentteja. Vaikka aterogeneesin mekanismit jäävät suurelta osin määrittelemättä, tutkimukset ovat osoittaneet, että taudin etenemiseen liittyy immuunisolujen välinen ylikuuluminen sekä ECs: n että VSMCs: n kanssa. Jotkin näistä yhteisvaikutuksista edistävät plakin kasvua, kun taas toiset heikentävät ateroskleroottisten plakkien kokoa, solukoostumusta ja stabiilisuutta (1, 2) (Kuva 1, Taulukko 1). Vsmc: t osoittavat huomattavaa plastisuutta vastatessaan verisuonivaurioihin, tulehduksiin ja lipoproteiinien kertymiseen taudin etenemisen aikana uudelleenohjelmoimalla geeniekspressiota ja siirtymällä proliferatiiviseen, provaimentavaan ja aktivoituneeseen fenotyyppiin eli fenotyypin vaihtamiseen (5). Kuvassa 1 kuvataan kriittisiä molekyylikytkimiä, joiden on ehdotettu olevan tärkeitä taudin etenemisen säätelijöitä (3, 6, 8, 11). Ateroskleroosin aloittamisen aikana intimaan värvätyt veriperäiset monosyytit kerryttävät lipidejä, jotka antavat niille vaahtoavan ulkonäön. Nämä vaahto solut edistävät rasva putki muodostumista, joka muodostaa varhaisin ja mahdollisesti palautuva vaihe ateroskleroottisten plakkien. Rasva raitoja vähitellen kehittyä ateromas / muistolaatat lopulta johtaa laajennettu muistolaatat, jotka sisältävät VSMCs, T-solut ja myelooisten solujen (Kuva 1) (33). Mielenkiintoista on, että ateroskleroottisen plakin koostumus eikä sen koko määrää sen stabiiliuden, sillä kuitumaisen korkin paksuus ja nekroottisen ytimen koko ovat stabiilin vs. epävakaan plakin mahdollisia tunnusmerkkejä (4, 9). Intima-kerroksen vsmc-yhdisteitä pidetään perinteisesti hyödyllisinä aterogeneesin aikana, koska ne tuottavat solunulkoisia matriisikomponentteja, mikä edistää vahvempien kuitumaisten korkkien muodostumista, mikä suojaa plakin repeämiltä (4, 9). On yhä ilmeisempää, että Vsmc: t käyvät läpi lukuisia rakenteellisia ja toiminnallisia fenotyyppisiä muutoksia ja saattavat jopa kokonaan menettää alkuperäiset ominaispiirteensä hankkiakseen muiden solutyyppien, kuten makrofagien, ominaisuuksia. Tiedot osoittavat, että VSMCs voi hankkia dikotomisia fenotyyppejä, joilla on Janus-pään tyyppinen luonne, eli pro – vs. Anti-aterogeenisia ominaisuuksia, riippuen kudosympäristöstä ja riskitekijöiden vaikutuksesta (3). VSMCs vapauttaa sytokiineja stimuloimaan viereisiä ECs: iä adheesiomolekyylien ilmaisemiseksi ja sytokiinien vapauttamiseksi ja/tai monosyyttien/makrofagien kemotaksian tehostamiseksi plakkiin (3, 34, 35) (Taulukko 1). Nämä tiedot osoittavat, että VSMCs: n kertyminen kuitumaiseen korkkiin tai intimaan on hyödyllistä, kun taas niiden häviäminen tai siirtyminen tulehdukselliseen fenotyyppiin on haitallista ja että vsmcs: n proliferaation/migraation ja kuoleman/vanhenemisen välinen tasapaino määrittää ateroprogression ja plakin stabiilisuuden (3). Useita VSMC: n biologian muita näkökohtia terveyden ja sairauden alalla käsiteltiin äskettäin erinomaisissa arvioissa (https://academic.oup.com/cardiovascres/issue/114/4), eikä niitä käsitellä tässä. Siksi kiinnitämme alla huomiota adventitian rooliin ja VSMCs: n mahdolliseen vaikutukseen ATLO: n muodostumisessa.

Kuva 1. Vsmcs: n fenotyypit ateroskleroosin etenemisen aikana paljastavat poikkeuksellisen plastisuuden. Ateroskleroottisten plakkien ECs ja VSMCs osoittavat aktivoituneita fenotyyppejä ( ➊ ) (3, 4). Jotkut VSMCs peräisin tiedotusvälineissä rekrytoinnin jälkeen intima; muut Vsmc: t voivat olla luuytimestä johdettuja tai ne voivat olla peräisin verenkierrossa olevista myelooisista soluista (➋) (3). Vsmcs: n murto-osa proliferoituu ( ➌ ) (3, 5). VSMCs erittää solunulkoisia matriisikomponentteja; pluripotenttisella transkriptiotekijällä eli Klf4: llä voi olla merkittävä rooli prosessissa, jota kutsutaan fenotyyppikytkennäksi (➍) (6, 7). Yrittäessään suojata ateroskleroottista plakkia tappavalta repeämältä Oct4 voi ohjata prosessia, jota on kutsuttu uudelleenmigraatioksi, jolloin muodostuu kuitumainen korkki (➎) (4, 8-10). Vanheneminen ja apoptoosi käynnistävät uusien tulehdussytokiinien muodostumisen ja muodostavat nekroottisen ytimen, joka käynnistää noidankehän, jolla on tappavia kliinisiä seurauksia taudin myöhäisvaiheissa (➏) (3, 4, 11).
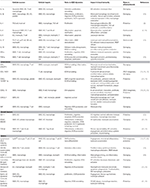
Taulukko 1. Tärkeimmät vsmc-välitteisen ateroskleroosin aiheuttajat.
VSMCs vaikuttaa adventitia-immuunivasteeseen Hyperlipideemisillä hiirillä
viimeisten kahden vuosikymmenen aikana on käynyt yhä ilmeisemmäksi, että adventia on erittäin monimutkainen ja immunologisesti aktiivinen kudos, jossa on niinkin erilaisia soluja kuin stroomasolut, hermot, imusuonet, vasa vasora ja kotimaiset leukosyytit/progenitorisolut, joilla kaikilla on kyky vaikuttaa taudin etenemiseen (36, 37). Havaitsimme, että APOE−/− hiirten adventitia käy läpi suuria rakenneuudistustapahtumia ateroskleroosin kaikissa vaiheissa: Sekä synnynnäiset että Adaptiiviset immuunisolut kerääntyvät vierekkäisten ateroskleroottisten plakkien viereen (kuva 2). Lisäksi tutkimuksemme kokeellisilla hiirillä vahvistivat ihmisen sairaissa valtimoissa: Me ja muut havaitsimme atlo-kaltaisia rakenteita ateroskleroottisten aortan aneurysmien (38, 39) ja viime aikoina Akhavanpoor et al. huomattavalla prosentilla iskeemistä sydänsairautta sairastavista potilaista havaittiin hyvin kehittynyt ATLOs adventiassa (40). Hiiren ateroskleroosi, imusuoni -, high endoteelial venule (HEV) -, ja verisuonten neogeneesi ovat merkittäviä piirteitä tämän rakenneuudistusprosessin (16, 41).
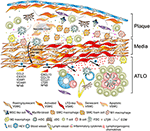
kuva 2. Verisuonten sileät lihassolut (vsmc) osallistuvat adventitia-immuniteettiin plakin muodostumisen aikana. Ateroskleroottisten plakkien ja adventiittien väliin sijoittuvat vsmc: t omaksuvat lymfaattisen kudoksen organisoijan kaltaisen fenotyypin plakkien (➊) kautta tapahtuvan aktivoitumisen jälkeen ja sen jälkeen transdifferentiaatin LTo: n kaltaisiksi soluiksi (➋). Proliferatiivisen ja sytokiinia ilmentävän fenotyyppinsä avulla ne vaikuttavat adventian rakennemuutokseen ja muotoiluun, mukaan lukien angiogeneesi, HEV: n muodostuminen ja imusuonen neogeneesi (➌). Fenotyyppikytkentä johtaa myös lymforganogeenisten kemokiinien eli CXCL13: n ja CCL21: n ilmentymiseen ja eritykseen, mikä edistää kaavion alaosassa ( ➍ ) kaavamaisesti kuvattua ATLO-muodostumista.
vanheneminen vai aikaistuminen vai molemmat?
vanhenemisen havaittiin olevan merkittävä tekijä adventistien rakennemuutoksessa ja kuvanveistossa. Täysin kehittynyt ATLOs-muoto ateroskleroosin kehittyneissä vaiheissa, mutta niiden varhaisvaiheet eli T / B-solujen aggregaatit syntyvät ateroskleroottisten plakkien muodostumisen rinnalla.(16, 27, 41, 42). Itse asiassa nämä varhaiset ATLOs muodostavat iässä ~30 viikkoa ja saavuttavat kehittyneempiä vaiheita noin 52 viikkoa huippuunsa 78 viikkoa (16, 41). Samanlaisia iästä riippuvia TLOs: n kehitysvaiheita on havaittu muissakin kroonisissa varauksettomissa sairauksissa (1, 42). Nämä tiedot osoittavat, että ATLON kehitys on iästä riippuvaista ja ikääntyminen liittyy positiivisesti adventiaaliseen veistämiseen (kuva 2). Kuitenkin suhde ikääntymisen ja kroonisuus on vaikea tutkia hiiren ateroskleroosi kuten ateroskleroottinen plakin kehitys alkaa aortan kaari, sitten kulkee kylvetty aortta päästä vatsa-aortan myöhemmin taudin vaiheissa siten kestää pitkiä aikoja. Lisätyötä tarvitaan sen tärkeän kysymyksen selventämiseksi, edistääkö immuunisolu-ja / tai VSMC-vanheneminen ATLON muodostumista ja mitkä solutyypit, ts., VSMCs, ECs, ja / tai immuunisolut ovat mukana. Tutkimukset muissa TLO: n muodostumisen muodoissa, kuten keuhkoissa ja ruoansulatuskanavassa, osoittavat, että ATLOs: n muodostumiseen vaikuttaa ratkaisevasti pysyvien tulehduskudosreaktioiden kroonisuus eikä immuunijärjestelmän bona fide-vanhenemistapahtumat.
vasta muodostuneet Adventiittirakenteet osallistuvat atlon toimintaan edistämällä lymfosyyttien kiertoa
edenneisiin ATLO-vaiheisiin kuuluvat T/B-solujen aggregaatit, aktivoituneiden B-solutuppien itukeskukset, imusuonet, t-solualueiden HEVs ja solunulkoiset mesh-verkostot (16). Nämä suuret muutokset muistuttavat rakenteita, jotka muistuttavat sekundaarisissa lymfoidisissa elimissä esiintyviä rakenteita, joissa ne edistävät antigeeniin kohdistuvien immuunivasteiden perustekijöitä, mukaan lukien aiemmin hoitamattomien lymfosyyttien takaisinkierrätys kognitiivisten antigeenien/autoantigeenien löytämiseksi ja B-solujen affiniteettikypsymisen järjestäminen potentiaalisia autoantigeenejä kohti. Käyttämällä adoptiivisia lymfosyyttien siirtotutkimuksia havaitsimme, että ATLOs parantaa huomattavasti lymfosyyttien rekrytointia valtimoseinämään sekä edistämällä maahanmuuttoa että samanaikaista antigeenin ja kokemattomien lymfosyyttien emigraatiota (27). Rekrytoinnin jälkeen T-solut aktivoituvat, alkavat lisääntyä ja osa CD4 T-auttajasoluista muuttuu indusoiduiksi t-säätelijäsoluiksi. Nämä tiedot osoittavat, että immuunijärjestelmä adventitia on erittäin herkkä kohti taustalla tulehduskudoksen reaktio valtimon seinämän. Lisäksi B-solut, jotka muodostavat sukusolujen keskuksia aktivoiduissa B-solutupissa, näyttävät käyvän läpi sukusolujen keskusreaktion follikulaaristen dendriittisolujen läsnä ollessa, joissa jotkut muunnetaan muistiksi B-soluiksi, kun taas toiset lähtevät sukusolujen keskuksista plasmasoluiksi (45). Kun nämä tiedot otetaan yhteen, ne osoittavat, että ATLOs pikemminkin kuin sekundaariset lymfoidiset elimet (kuten aiemmin luultiin) järjestävät ateroskleroosin immuniteetin.
Atlon muodostuminen on erittäin Territoriaalista, mikä viittaa siihen, että signaalit välittyvät Plakeista Adventiaan lymfaattisen kudoksen organisoijan kaltaisen Vsmcs: n kautta
toinen adventitian rakennemuutoksen aspekti aterogeneesin aikana on se, että ATLON muodostuminen on erittäin territoriaalista ja rajoittuu suurelta osin adventitian segmentteihin, jotka sijaitsevat ateroskleroottisten plakkien vieressä vatsa-aortassa hiirillä (16, 45). Atloja esiintyy vain satunnaisesti innominaattivaltimon adventiiassa tai aortan kaaressa, jossa ateroskleroosia esiintyy eniten. Immuunisolut rinta-aortan segmenteissä koostuvat pääasiassa T-solujen aggregaateista verrattuna vatsa-aortan Atlosiin (16, 41). Vatsa-aortan ATLOs-muodostumisen tarkka aluemekanismi on vielä tuntematon. TLOs näyttää olevan piirre monissa kroonisissa vaikeasti korjattavissa tulehdussairauksissa ja ne ovat merkittäviä autoimmuunisairauksien tunnusmerkkejä (42). Tlos: n sellulaarisuus ja rakenteet ateroskleroosissa ovat samanlaisia kuin TLOs: ssä monissa muissa kroonisissa sairauksissa, mukaan lukien syöpään liittyvä TLO: n muodostuminen (46, 47). TLO: n biologian ala on dramaattisesti laajentunut viime vuosina, mikä nostaa esiin tärkeän mahdollisuuden, että uusi terapeuttinen kohde voidaan tunnistaa ymmärtämällä TLO: n tehtävä kussakin TLO: hon liittyvässä sairaudessa. TLOs: n eri tyypit paljastavat kuitenkin joitakin taudille ominaisia piirteitä, jotka voivat lopulta ratkaista, ovatko niihin liittyvät immuunivasteet haitallisia vai suojaavia. Tällaiset taudille ominaiset ominaisuudet johtuvat mahdollisesti yhdestä useista mekanismeista, mukaan lukien elinerityisyys ja kudosvaurioiden luonne (1, 42). Lymfoidisten elinten kehitys on monimutkainen prosessi, johon liittyy hematopoieettisia lymfaattisen kudoksen indusoijasoluja (LTi), ei-hematopoieettisia strooman lymfaattisen kudoksen järjestäjäsoluja (LTo) ja LTßR-signalointia. In-vitro-tutkimuksemme hiiren aortan VSMCs: llä osoittivat, että sopivan stimulaation jälkeen ne voivat toimia LTo: n kaltaisina soluina (20), jotka on alun perin tunnistettu alkionkehityksen aikana sekundaaristen imukudosten, kuten imusolmukkeiden ja pernan, muodostumisen aikana (48, 49) (KS.jäljempänä). On tärkeää huomata, että ATLOs-operaatioissa VSMCs näyttää olevan tärkeitä osallistujia, kun taas muissa TLOs-operaatioissa on mukana muita LTo: n kaltaisia mesenkymaalisoluja (50). Yhteinen nimittäjä kaikkien muotojen TLOs, kuitenkin, näyttää olevan–toisin kuin toissijainen lymfoidi elimet-krooninen tulehduksellinen kudoksen reaktio, joka ajaa immuunijärjestelmää muodostamaan näitä lymfoidisia rakenteita lähellä tai joissakin tapauksissa sisällä sairaan kudoksen (42, 43).
VSMCs myötävaikuttaa suoraan adventitia-immuniteettiin ateroskleroosissa
ottaen huomioon ateroskleroottisten plakkien vieressä olevien Atlojen erittäin territorialisoituneen luonteen, ajattelimme, että VSMCs voi osallistua ATLON muodostumiseen ja samalla se voi omaksua toiminnallisen roolin ateroskleroosin etenemisessä. VSMCs ilmaisee LTßR: n konstitutiivisesti (16), kun taas sen ligandi LTa1ß2 ilmaistaan erilaisilla lti-soluiksi kutsutuilla immuunisoluilla (51). Vsmcs: n oletetaan aktivoituvan LTßR-LT-signalointireitin kautta lti-solujen osallistuessa sekundaariseen lymfaattisen kudoksen neogeneesiin. LTi-solun alkuperää ei ole vielä selvästi määritetty, vaikka aktivoidut makrofagit ja muut intima-plakin immuunisolut ovat ehdokkaita tälle aktiivisuudelle LTO-neogeneesissä. Soluliukoisten ja liukoisten välittäjäaineiden vaikutuksesta VSMCs: llä näyttää olevan tietyntyyppinen fenotyyppi, joka vaihtuu LTo: n kaltaiseen fenotyyppiin lymforganogeenisten kemokiinien parakriinierityksen eli CXCL13: n ja CCL21: n kautta, jolloin immuunisolut, esim.makrofagit/dendriittisolut, T-solut ja B-solut, hakeutuvat paikalliseen adventiittimiljööseen, mikä johtaa ATLO: n muodostumiseen adventitiassa (27, 41, 45) (Taulukko 1). Ltßr: n maailmanlaajuinen tai vsmc-spesifinen puutos iäkkäillä hyperlipideemisillä ApoE−/− hiirillä osoitti lisääntynyttä ateroskleroottista plakin muodostumista, mikä viittaa siihen, että VSMC LTßR kykenee heikentämään ateroskleroosin kehittymistä joissakin kokeellisissa olosuhteissa (27). Muut tutkimukset kuitenkin osoittivat, että nuorilla maailmanlaajuisilla APOE−/− LTbR−/−hiirillä, joita pidettiin runsasrasvaisella ruokavaliolla (HFD), aortan plakkitaakka oli pienempi kuin niiden normaaliruokavaliolla ruokituilla APOE-/−− hiirillä (52). Nämä näennäiset ristiriitaiset tiedot osoittavat, että LTßR: n roolit nuorilla hiirillä ja liiallisen hyperlipidemian olosuhteissa voivat olla erilaiset näissä kahdessa mallissa. Vaihtoehtoisesti runsasrasvainen ruokavalio, joka johtaa dramaattisiin ja mahdollisesti huumaaviin plasman lipidipitoisuuksiin, voi olla vastuussa näistä eroista. Koska emme säännöllisesti käytä runsaasti rasvaa ruokavaliota ApoE – / – hiirillä, nämä eroavaisuudet ovat edelleen ratkaisemattomia kysymyksiä, vaikka on osoitettu, että immuunijärjestelmä voi hukkua äärimmäiset plasman lipidien tasot . Nämä tiedot edellyttävät lisätutkimuksia, joissa tutkitaan molekulaarista perustaa ltßr: n näennäiselle kahtiajakolle ateroskleroosin etenemisessä nuorilla vs. ikääntyneillä hiirillä ja/tai varhaisella vs. pitkälle edenneellä ateroskleroosilla. Lisäksi luuytimestä johdetut makrofagit voivat toimia LTßR-itsenäisinä LTi-soluina ja laukaista CCL19: n, CCL20: n ja CXCL16: n ilmentymisen vsmcs: llä (53) (Taulukko 1). Siten VSMCs voi osallistua Tlos: n muodostumiseen ateroskleroosissa lisäämällä lymforganogeenisten kemokiinien säätelyä adventitiassa olevien immuunisoluaggregaattien edistämiseksi. Kuten edellä mainittiin, ATLOs ovat yleisiä ihmisillä rasittaa iskeeminen sepelvaltimotauti (40) ja ihmisen ateroskleroottinen aortan aneurysmat (38, 39). Yhdessä atlos: n esiintyminen kokeellisissa hiirissä ja ihmisen ateroskleroosissa herättää tärkeitä kysymyksiä ateroskleroosin luonteesta autoimmuunisairautena: on mahdollista, että aterogeneesin aikana syntyy autoimmuunisoluja T-soluja ja autoimmuunisoluja, jotka on suunnattu vielä tunnistamattomia autantigeenejä vastaan. Tällaisten autoimmuuni-lymfosyyttien eristäminen, mukaan lukien niiden T-solureseptorien ja/tai B-solureseptorien sekvensointi, mahdollistaisi suurten hypoteesien testaamisen ateroskleroosissa. Ateroskleroositutkimuksessa tapahtuisi suuri muutos ja yksittäisten autoimmuunilymfosyyttikloonien testaaminen toiminnallisissa in vitro-ja In vivo-järjestelmissä olisi mahdollista.
johtopäätös
ateroskleroosi on valtimoiden tulehdussairaus. Vsmc: t kommunikoivat ateroskleroottisten plakkien ECs-ja immuunisolujen sekä adventitiassa olevien solujen kanssa. Tämä kyky sallii vsmcs: n vaikuttaa ateroskleroosin immuniteettiin merkittävillä tavoilla, mukaan lukien ATLOs: n muodostuminen. Lisätyötä tarvitaan vsmcs: n roolin määrittelemiseksi ateroskleroosin eri vaiheissa, niiden roolin määrittämiseksi nuorissa vs. ikääntyvissä valtimoissa ja niiden dikotomisten roolien selventämiseksi taudin etenemisessä. Näiden prosessien parempi ymmärtäminen voi avata mahdollisuuden kehittää terapeuttisia strategioita taudin kliinisesti tärkeissä myöhäisvaiheissa tapahtuvia tulevia toimenpiteitä varten.
Tekijäosuudet
kaikki kirjoittajat osallistuivat toimitetun käsikirjoituksen suunnitteluun, kirjoittamiseen ja muokkaamiseen ja hyväksyivät sen julkaistavaksi.
Rahoitus
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Verisuonten sileiden lihassolujen apoptoosi indusoi ateroskleroosin plakkiherkkyyden piirteitä. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstract / CrossRef Full Text | Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Vaskulaarisen sileän lihassolun erilaistumisen molekyylisäätely kehityksessä ja taudissa. Physiol Rev. (2004) 84: 767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. Klf4-riippuvaisella sileälihassolujen fenotyyppisellä modulaatiolla on keskeinen rooli ateroskleroottisessa plakkipatogeneesissä. Nat Med. (2015) 21:628–37. doi: 10,1038/nm.3866
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gomez D, Owens GK. Sileän lihassolun fenotyyppinen vaihto ateroskleroosissa. Cardiovasc Res. (2012) 95: 156-64. doi: 10.1093 / cvr/cvs115
PubMed Abstract / CrossRef Full Text | Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. Pluripotenssitekijä OCT4: n aktivaatio sileissä lihassoluissa on aterosuojaava. Nat Med. (2016) 22:657–65. doi: 10,1038/nm.4109
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Ateroskleroottisten plakkien stabilointi. Position paper of the European Society of Cardiology (ESC) Working Group on atherosclerosis and vascular biology. Thromb Hemost. (2011) 106:1–19. doi: 10. 1160 / TH10-12-0784
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett Mr, et al. Verisuonten sileän lihassolukuolema, autofagia ja vanheneminen ateroskleroosissa. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093 / cvr/cvy007
PubMed Abstract / CrossRef Full Text | Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, doch AO, Katus HA, et al. Interleukiini-17A: n Kahdet Kasvot ateroskleroosissa. Kurrin Huumekohteet. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Insuliinin kaltainen kasvutekijä – 1 ja TNF-alfa säätelevät autofagiaa C-jun N-terminaalisen kinaasi-ja Akt-reittien kautta ihmisen ateroskleroottisissa verisuonten sileissä soluissa. Immunolisolubioli. (2006) 84:448–54. doi: 10.1111 / j.1440-1711.2006. 01454.x
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer m, et al. Lymfotoksiini beeta-reseptorin signalointi edistää tertiääristä lymfoidista organogeneesiä ikääntyneiden APOE – / – hiirten aortan adventiassa. Käyt.Viim. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Full Text | Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre t, et al. Parannettu ilmentyminen homeostaattisen chemokines CCL19 ja ccl21 kliinisissä ja kokeellisissa ateroskleroosi: mahdollinen patogeeninen rooli plakin epävakautta. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.Mönkijä.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161/Mönkijä.109.191395
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Smedbakken LM, Halvorsen B,Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Lisääntynyt homeostaattisen kemokiini CXCL13 ihmisen ateroskleroosi-potentiaalinen rooli plakin stabilointi. Ateroskleroosi. (2012) 224:266–73. doi: 10.1016/j.ateroskleroosi.2012.06.071
CrossRef Full Text | Google Scholar
22. Higashi Y, Suhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Insuliinin kaltainen kasvutekijä – 1-reseptorin vajaus makrofageissa kiihdyttää ateroskleroosia ja indusoi epästabiilia plakkifenotyyppiä apolipoproteiini E-puutoksesta kärsivillä hiirillä. Verenkierto. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alexander, Owens GK. Epigeneettinen kontrolli sileän lihassolun erilaistumiseen ja fenotyyppiseen vaihtumiseen verisuonten kehityksessä ja sairauksissa. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-fysioli-012110-142315
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
24. He C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. PDGFRbeta-signalointi säätelee paikallista tulehdusta ja synergisoi hyperkolesterolemian kanssa ateroskleroosin edistämiseksi. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstract / CrossRef Full Text | Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta m, et al. Kohdistaminen Interleukin-1beta suojaa aortan aneurysmat aiheuttama häiriintynyt muuttamassa kasvutekijä beeta signalointi. Immuniteetti. (2017) 47:959-73 e9. doi: 10.1016 / J.immuni.2017.10.016
CrossRef Full Text | Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Valtimon tertiääriset imukudoselimet säätelevät aortan immuniteettia ja suojaavat ateroskleroosia vastaan verisuonten sileän lihassolun lymfotoksiinin beetareseptorien kautta. Immuniteetti. (2015) 42:1100–15. doi: 10.1016 / J.immuni.2015.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. Nlrp3 tulehduksellinen ilmaisu ja aktivointi ihmisen ateroskleroosissa. J Am Heart Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Full Text | Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Protective aptitude of annexin A1 in arterial neointima formation in ateroskleroosin-altis hiiret-lyhyt raportti. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161/Mönkijä.116.308744
CrossRef Full Text | Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. Neuroimmuuniohjaus cue netrin-1 edistää ateroskleroosia estämällä makrofagien maastamuuttoa plakeista. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Full Text | Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Cellular senescence ja senescent eritys fenotyyppi: terapeuttiset mahdollisuudet. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstract / CrossRef Full Text | Google Scholar
37. Majesky MW, Horita H, Ostriker a, Lu S, Regan JN, Bagchi A, et al. Erilaistuneet sileät lihassolut tuottavat adventiassa asuvien verisuonten progenitorisolujen alapopulaation, jota säätelee Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, doch AO, Katus HA, et al. Adventitiaalinen tertiäärisen imunesteelimen luokitus ihmisen ateroskleroosissa. Cardiovasc Patol. (2018) 32:8–14. doi: 10.1016 / J.Karpaatit.2017.08.002
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. Lamina adventitia on tärkein immuunisolujen kertymiskohta tavallisilla sapuskalla ruokituilla Apolipoproteiinin E-puutoksesta kärsivillä hiirillä. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.Mönkijä.0000187470.31662.fe
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Valtimon tertiääriset imukudoselimet edistävät synnynnäisiä ja adaptiivisia immuunivasteita kehittyneessä hiiren ateroskleroosissa. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Buettner M, Lochner M. toissijaisten ja tertiääristen imukudoselinten kehitys ja toiminta ohutsuolessa ja paksusuolessa. Etuimmunoli. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Valtimon tertiääriset imukudoselimet säätelevät monikerroksista aluetason ateroskleroosi B-soluvastetta ikääntyneillä APOE–/– hiirillä. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161/Mönkijä.115.306983
CrossRef Full Text | Google Scholar
48. van de Pavert SA, Mebius RE. Uusia oivalluksia lymfakudosten kehityksestä. Nat Rev. Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Full Text / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal n, Buckley CD, Luther SA. Stroomal fibroblasts in tertiary lymphoid structures: a novel target in chronic inflammation. Etuimmunoli. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstract | CrossRef Full Text | Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller s, Favre s, Littman DR, et al. Lymfaattisen elimen eheyden palauttaminen imukudosta indusoivien solujen ja T-soluvyöhykkeen strooman vuorovaikutuksen avulla. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstract | CrossRef Full Text | Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann s, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar