Kuva 4: silmän rakenne.Kuva on otettu elokuvasta Chirstie (ref. 4) ja on tekijänoikeusrajoitettu annetun lähteen mukaan (toisin sanoen se ei ole tekijöiden Oma teos).
silmän rakenne: silmän sisällä oleva alue (KS.kuva 4), joka havaitsee valon ja värin, on verkkokalvo. Havaitsemissolun kaksi tyyppiä, sauvat ja tappisolut, käsittelevät linssin läpi tulevaa informaatiota ja lähettävät sen näköhermoa pitkin aivoihin. Sauvasolut (joita on noin 100 miljoonaa) havaitsevat silmäänsulkevan vaaleuden ja niiden herkkyys riippuu rodopsiinin määrästä, jokaon itse syntynyt soluissa. Rodopsiini kuitenkin tuhoutuu valolle altistuessaan, ja siksi sauvasolut toimivat vain heikossa valossa, koska suuri valaistus vähentää tämän valoherkän pigmentin herkkyyttä. Kartiosolut(joita on noin 3 miljoonaa) ovat myös herkkiä valotasolle, mutta ne säilyttävät toimintansa korkeaan valaistukseen asti käyttämällä pigmenttijodopsiinia.Värin havaitseminen on verkkokalvossa esiintyvien kolmen kartio-solutyypin tehtävä: niiden välissä ne peittävät näkyvän spektrin. Tämä johtuu siitä, että jokainen tyyppi on herkkä eri aallonpituusalueille, joilla maksimit vastaavat punaista (pitkä), vihreää (keskikokoinen) tai sinistä (lyhyt).
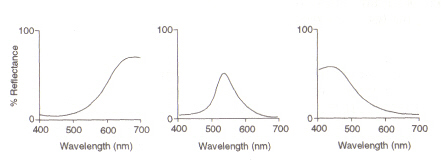
kuva 5: maksimit (fromleft) punainen, vihreä ja sininen kartio soluja, vastaavasti. Kuva on otettu elokuvasta Chirstie (ref. 4) ja tekijänoikeus on rajoitettu annetun lähteen mukaan (eli kyseessä ei ole tekijän oma teos).
rodopsiinin mekanismi Rodsellien sisällä: valkuaisrodopsiini sisältää protonoidinal-Schiffin emäskompleksin, joka luonnollisesti sijaitsee seitsemän Trans-membraani-a-helikaalireseptorin muodostamassa kalvojen välisessä taskussa. Arod-solun uloimmassa segmentissä on monia rodopsiinin litteitä levyjä, jotka valontunnistuksen yhteydessä käyvät läpi valo-isomeerisen muutoksen Rodopsiinista (11-cis) all-trans-verkkokalvoksi. Valoisomerisaatiokaskadin jälkeen, joka tapahtuu 5 lyhytkestoisen välilevyn kautta (vuokaavio 1), transkalvot diffundoituvat pois ja muuttuvat Takaisin 11-sisretinaaliksi ennen kiertoon paluuta. Tämä prosessi tapahtuu pelkistämällä all-trans retinolia, jota seuraa hapettuminen/isomeroituminen pimeässä. Fotoeksitedrhodopsiini (4: s viidestä välituotteesta) käynnistää entsymaattisen kaskadiprosessin, joka johtaa GMP: n hydrolyysiin. Tämä puolestaan sulkee sauvasolukalvon kationispesifiset kanavat, jotka ovat luonnostaan avoimia Na+ – virralle pimeässä, ja hyperpolarisaation vaikutuksesta sisempi synaattinen elin lähettää hermosignaalin muille verkkokalvossa oleville neuroneille. Lopulta valon aiheuttama kalsiumpitoisuuden lasku auttaa innostuneita hermosoluja palautumaan passiiviseen, ”pimeään” tilaan, ja kierto alkaa uudelleen valon havaittuaan. Käpysolujen fotoreseptoreita on myös seitsemän a-helikaliseptoria, joiden kromoforina on 11-CIS-retinaali. Detektioalue vaihtelee vihreästä punaiseen, kun kolme ei-polaarista hydroksyyliä sisältävää jäämää, jotka ovat lähellä tretinaalia, korvataan peräkkäin polaarisilla jäämillä.

vasen kuva 6: 11-cis-verkkokalvon sijainti Rhodopsiinissa. Kuva on otettu elokuvasta Stryer (ref. 6) ja tekijänoikeus on rajoitettu annetun lähteen mukaan (eli kyseessä ei ole tekijän oma teos).
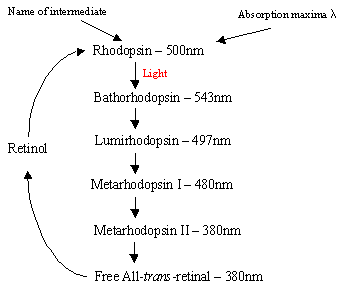
Oikea-Vuokaavio1: Rhodopsiinin syklin 5 välituotetta.
mistä Rhodopsiini tulee?
ihmiset eivät voi valmistaa elintarvikkeisiin sisältyvää B-karoteenia, vaan he käyttävät sitä synteesissään:
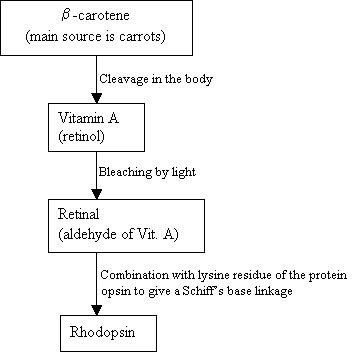 |
vuokaavio 2: Rhodopsiinin synteesi uusi kuva =kuva 7: B-karoteenin (ylä -), Vitaminan (keskellä) ja 11-cis-verkkokalvon (alaosassa) rakenteet. |
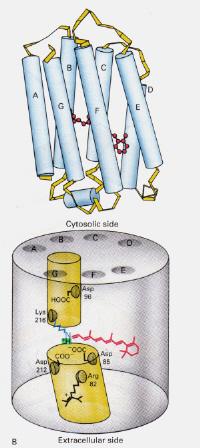
miten halobakteereista löytyvän bakteerihodopsiinin mekanismi eroaa ihmissilmän rodopsiinisoluista löytyvästä Rodopsiinista?: Tällä kertaa protonoitu verkkokalvon-Schiffin basecomplex luonnollisesti estää kanavan läpi kalvon muuten muodostuu kaksi adjacent kammiot. Protonoitu trans-kompleksi luovuttaa protonin Asp-85: lle, mikä mahdollistaa saman protonin poistumisen solunulkoiselle puolelle. Fotoisomerointi 13-cis-rakenteeseen mahdollistaa Schiffin emäksen poimimaan protonin sytosolipuolen ASP-96-jäännöksestä. Kun cis-muoto on uudelleensuuntautunut trans-muotoon, jatkuu isomeroitumisen ja protonipumpun sykli.