Kalmoduliini
tämä on Videoesitys kalsiumin signalointiproteiiniin, kalmoduliiniin, epäorgaanisen kemistin näkökulmasta!
Kalmoduliini eli CaM on polypeptidi, jota esiintyy kaikkialla kaikissa eukaryoottisoluissa. Tämä proteiini tunnetaan kalmoduliini, koska se on kalsium-moduloitu proteiini, joka on tärkeä rooli prosessissa kalsiumsignaalin transduktio. Kalsiumsignaalin transduktio on prosessi, jonka kautta kalsiumionien ja lukuisten proteiinien väliset vuorovaikutukset välittävät solujen välistä viestintää. kalmoduliinin toiminta on siis välttämätöntä kaikissa eukaryoottisissa soluissa, ja joitakin tehtäviä, joita se auttaa suorittamaan, ovat hermosignalointi, luurankolihasten liike ja muisti. Aistimalla kalsiumioneja ympäristössä kalmoduliini aktivoi ja toimii sen jälkeen välituotteena aloittaen tärkeiden proteiinien kuten kinaasien sitoutumisen, auttaen solujamme perustoiminnassa ja hienostuneessa toiminnassa (”Kalmoduliini”).
alla oleva video osoittaa rakennemuutoksen, joka tapahtuu CaM: n sisällä kalsiumsidonnan aikana (PDB-koodit 3CLN ja 1cfd).
itse proteiini on 148 aminohapon pituinen, ja siinä on kaksi pallomaista aluetta, joissa kummassakin on 2 EF-käsiaihetta, jotka ovat kalsiumvälitteisten polypeptidien tyypillisiä paikkoja. Aktivoituessaan kalmoduliini sisältää 4 Ca2 + – Ionia, jotka muuttavat voimakkaasti proteiinin muotoa. Kun kalmoduliini sitoutuu kalsiumioneihin, proteiini avautuu apo-muodostaan halomuotoonsa paljastaen alfa-heliksin, joka tunnetaan linkkeri-tai keskihihnaseutuna. Joustavuutensa ansiosta keskeinen lieka-alue on sen proteiinin sijainti, johon kumppaniproteiinit sitoutuvat ja osallistuvat kalsiumin toissijaisena viestinä toimivaan kaskadiin. Rakenteensa ja kalsiumionien toimintatarpeensa perusteella kalmoduliinin on kyettävä valitsemaan sytoplasmassa olevat kalsiumionit, ja EF-käsidomeenien ionien ja ligandien väliset vuorovaikutukset tukevat tätä selektiivisyyden ajatusta (Bertini et. al., 635-638).
tämä kuva on kuvaus siitä, miten EF-käsi-aihe muistuttaa kättä. Vasemmalla olevassa nauhakaaviossa on yksi kalmoduliinin neljästä tunnusomaisesta helix-turn-helix EF – käsimotiivista. (PDB-koodi 3CLN)
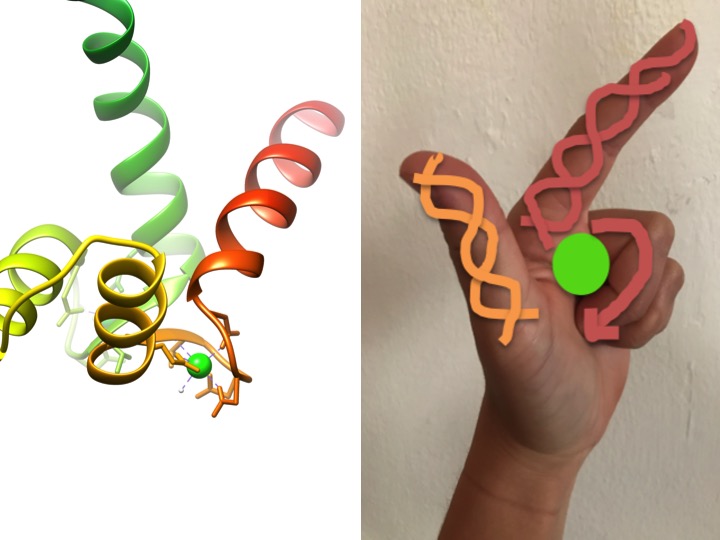
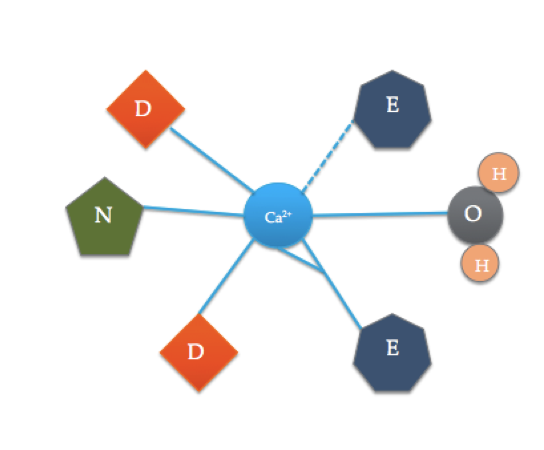
EF-käsikuviot ovat kalsiumin sitoutumiseen osallistuvien proteiinien hyvin säilyneitä rakenteellisia alueita. Näitä alueita kutsutaan ”käsi” – motiiveiksi, koska ne muistuttavat L-kirjaimen muotoista kättä, jossa metalli-ioni sijaitsee nyrkin keskellä, alfa-kierteet osoitetaan ylöspäin osoittavalla etusormella ja sisäänpäin kääntyvällä peukalolla ja kiertyneet sormet edustavat kääntö-tai silmukkaseutua. Tämä näkyy yllä olevassa kuvassa. Tyypillisessä EF-käsimuodossa aminohapot kuten glutamaatit, asparagiinit, asparagiinihapot ja glutamiinihapot sitoutuvat Ca: han, samoin kuin vesi (Bertini et. al. 639). Tyypillinen EF-hand domain liimaus sekvenssi on esitetty alla olevassa kuvassa.
tämä sarjakuva kuvaa koordinoituneita aminohappoja tyypillisessä EF-käsidomeenissa(tarkka aminohappokoostumus vaihtelee!). Dashed linja edustaa koordinaatiota Ca happea selkärangan karbonyyli, kun taas kiinteät linjat osoittavat koordinaatiota sivuketjujen tai veden.
kalmoduliinin sitoutumiskohta poikkeaa jonkin verran tyypillisimmästä EF-käsidomeenista, joka on esitetty yllä. Kalmoduliinin 6 ligandia sisältävät kolmen asparaattihapon (D) sivuketjut, 1 glutamiinihapon (E), joka muodostaa ionin kanssa kaksi koordinaatistoista kovalenttista sidosta, 1 vesimolekyyli liuoksesta ja 1 karbonyylimolekyyli selkärangasta. Kalmoduliinin sitoutumiskohta koostuu Ca2+ – ionista, jota ympäröi 6 ligandia muodostaen samalla 7 sidosta.
voidaan huomata, että kalmoduliinin sisällä oleva EF-motiivi sisältää monia samoja ligandeja, vain eri paikoissa. Tämä konformaatio voi antaa käsityksen siitä, miksi kalmoduliini on selektiivinen kalsiumin suhteen ja miten vain kalsiumionin läsnäolo voi tyydyttää sitoutumiskohdan, joka saa proteiinin aktivoitumaan. Tämä liittyy kalmoduliinin termodynamiikkaan solun sisällä ja siihen, miten se reagoi kalsiumionien läsnäoloon.
ymmärtääkseen kalmoduliinin aktivaatiota yhdistävän termodynamiikan on ensin ymmärrettävä kalsiumin ja magnesiumin kaltaisten ionien konsentraatio eukaryoottisessa solussa, myös ihmisen solussa. Näiden ionien konsentraatiota on säänneltävä tarkasti. Sisällä solussa kalsiumsignalointiin liittyy kalsiumionien pitoisuuden tilapäinen nousu, jonka aistivat proteiinit, kuten kalmoduliini (Bertini et. al., 636). Tämä kalsiumpiikki voi johtua solunsisäisistä g-proteiineista, jotka indusoivat karkean ja sileän retikulumin vapauttamaan kalsiumia, tai kalsiumionit voivat kulkeutua solunulkoisesta tilasta. Kalmoduliinin tapauksessa se reagoi yleensä siihen, että soluun tuodaan kalsiumia ulkopuolelta, mikä tapahtuu esimerkiksi hermosignaloinnin (Bertini et. al. 637). Ennen kalsiumpitoisuuden hetkellistä nousua pitoisuus solun sisällä on yleensä 10-100 nm, kun taas lyhyen ionitulvan aikana pitoisuus kasvaa 1 000-100 000 nm: iin. Konsentraation muutos saa kalmoduliinin aistimaan kalsiumionit, sitomaan ne ja aloittamaan edelleen signaalitransduktion (Bertini et. al., 635).
miten kalmoduliini sitten sitoo lopullisesti kalsiumioneja eikä esimerkiksi magnesiumioneja? Mg2 + – ionit ovat itse asiassa melko samanlaisia kuin kalsiumionit: ne sitoutuisivat sähköstaattisiin vuorovaikutuksiin kovalenttisten sijaan, ja niitä pidetään kovina atomeina. Syy siihen, että kalmoduliini näyttää suosivan kalsiumioneja magnesiumionien sijaan, liittyy kunkin ionin sitoutumisvakioihin. Kalmoduliini voi olla sitoutuneena muihin ioneihin, kuten magnesiumiin, mutta jos kalsiumpitoisuus on suurempi, kalsiumionit kilpailevat välittömästi magnesiumionien kanssa kalsiumsitoutumispaikoista. Tämä johtuu siitä, että CaM: n ja Ca2+: n (Ka) sidosvakio on suurempi kuin CaM: n ja Mg2+: n, kuten kuvassa 7 esitetään. Tämä osoittaa, että sitoutuessaan kalsiumioneihin kalmoduliini tuottaisi enemmän tuotteita. On otettava huomioon kaikki nämä ajatukset pitäen mielessä, että tämä prosessi tapahtuu lukemattomia kertoja sekunnissa, ja tämän proteiinin liikevaihto muuttuu vastaamaan solun alati moduloituvaan kalsiumpitoisuuteen.
miksi kalmoduliini sitoutuu kalsiumioneihin suotuisammin kuin muihin metalleihin? Se voi johtua ionien koosta suhteessa ligandien aiheuttamaan steeriseen esteeseen. Sidospaikalle on ominaista, että 6 ligandia muodostaa 7 koordinaattisidosta. Koska kalsiumionit ovat suurempia kuin magnesiumionit, kuten kuvassa 8 osoitetaan, on mahdollista, että kalsiumia suositaan, koska se lisää ligandien etäisyyttä toisistaan, jolloin ligandien väliset steeriset vuorovaikutukset vähenevät. Myös proteiinin rakenne itsessään voi olla syy kalsiumionien selektiivisyyteen. Yleisesti tiedetään, että kalsiumionien vaihtelevaan solukonsentraatioon perustuvan termodynamiikan vuoksi kalmoduliini aistii ionien lisääntymisen, sitoo ne ja auttaa suorittamaan tehtävänsä.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + MG2+
koska Kcam-Ca > Kcam-mg
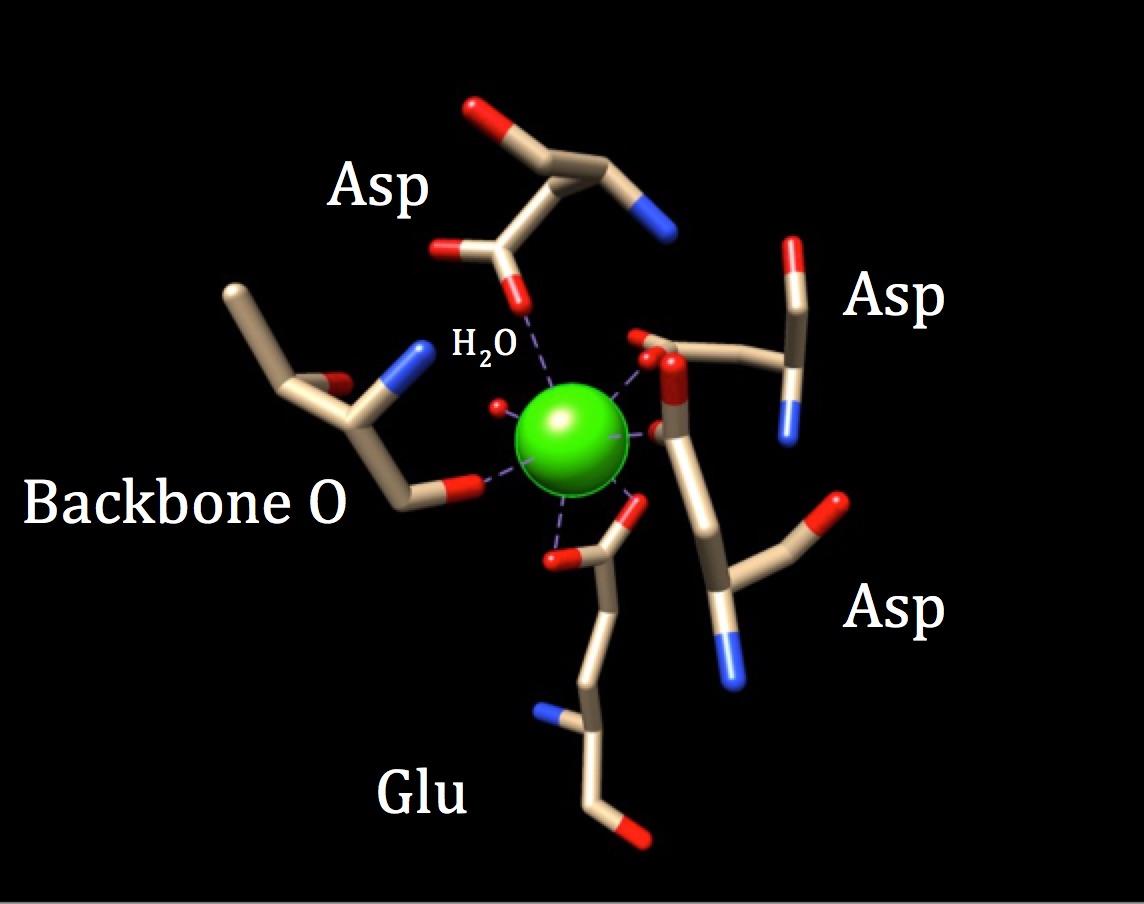
Kalmoduliinin sitoutumiskohdan kemiaa pohdittaessa tulisi tutkia Koordinaatiogeometriaa. Koska kalsiumioni vuorovaikuttaa seitsemän luovuttajaatomin kanssa, systeemiä kutsutaan heptadenttijärjestelmäksi. Koska kalmoduliinia ympäröi kuusi ligandia, oletetaan oktaedrinen koordinaatiogeometria. Mutta koska yksi ligandeista vuorovaikuttaa bidentaattisella tavalla ionin kanssa—eli sillä on kaksi koordinoitua kovalenttista sidosta, jotka tulevat eri atomeista yhdessä aminohapossa—koordinaatiokompleksi saa vääristyneen oktaedrimuodon. Erityinen koordinointi esitetään seuraavassa kuviossa.
kalmoduliinin kalsiumsitoutumiskohdan koordinaatiogeometria. Keskellä olevaa kalsiummetalli-Ionia ympäröi kolme asparagiinia (Asp), yksi runkohappi, yksi gluatmiinihappo (Glu) ja yksi vesimolekyyli. (PDB-koodi 3CLN)
voimme myös viitata kelaattivaikutuksen teoriaan ymmärtääksemme paremmin kalmoduliinin kykyä sitoutua metalleihin ioneihin, joilla on suuri affiniteetti. Kelaattori on atomi, joka pystyy sitoutumaan useampaan kuin yhteen luovuttajaatomiin. Polydentaattisidos liittyy kelaattiefektiin, jonka mukaan ligandin sitoutuessa moniin luovuttajaryhmiin (poly) koordinaatit kovalenttiset sidokset ovat paljon vahvempia tai tiukemmin kiinni. Tätä teoriaa tukee termodynamiikka, erityisesti se, että polydentaattisidos lisää systeemin entropiaa, jolloin systeemi on termodynaamisesti suotuisampi (enemmän epäjärjestystä). Tämän teorian soveltaminen kalmoduliiniin auttaa selittämään paitsi polydendaattisidoksen merkityksen itse paikoissa, myös sen, että proteiinin on sitouduttava 4 eri kalsiumioniin aktivoidakseen sen toiminnan. Vaatimalla oleellisesti neljän Ca2+ – ionin sitomista sivustoissa järjestelmä kannustaa entropian lisääntymiseen tuomalla lisää substraatteja / reaktantteja muodostaen suuremman määrän tuotteita. Tämä johtuu siitä, että kunkin sidospaikan ligandivuorovaikutuksissa on enemmän sidoksia. Kaiken kaikkiaan kalsiumionin sitoutumista polypeptidin kohtiin tukee kelaattivaikutusteoria ja valottaa kalmoduliinin tehokkuutta kalsiumin sitomisessa.
EF-käsimotiiveilla on tietty rakenne, joka perustuu siihen, että kalsium on keskusmetalli. Tämä pätee myös kalmoduliinia sitoviin kohtiin. Ca2 + -ioni sitoutuu eräiden aminohappojen rakenteissa samanlaisiin atomeihin kova/pehmeä happo-Emästeoriaksi kutsutun teorian perusteella. Tämä teoria erottaa metallit ja ligandit kahteen luokkaan polarisoituvuuden ja niiden varauksen ja säteen suhteen perusteella. Kovat hapot ja emäkset ovat pienempiä ioneja, joilla on suurempi varauksen ja koon suhde, ja tämä johtaa niiden vuorovaikutukseen sähköstaattisilla tavoilla (eli vetovoimatekijöillä + ja – varausten välillä), kun taas pehmeät hapot ja emäkset ovat kooltaan suurempia ja siten niillä on pienempi varaus ja säde-suhde, mikä johtaa niiden kovalenttisiin sidoksiin. Lause ”like sitoo like” viittaa siihen, että kovat hapot ja emäkset ovat yleensä vuorovaikutuksessa muiden kovien atomien kanssa, ja sama koskee pehmeitä happoja ja emäksiä. Ca2+ on luonnehdittu kovaksi hapoksi, koska vaikka sillä on suuri säde, se vuorovaikuttaa ligandien kanssa enimmäkseen sähköstaattisella tavalla. Kun tarkastellaan kalmoduliinin kalsiumsitoutumiskohtaa, voidaan nähdä, että kalsiumioni sitoutuu 3 asparagiinihapon, glutamiinihapon, veden ja selkärangan karbonyylin happiatomeihin. Tämä sitoutuminen on linjassa ”like sitoo like”: n kanssa, koska vesi ja aminohapot ligandit, glutamiinihappo ja asparagiinihappo, sitoutuvat koviksi emäksiksi luonnehdittujen hapenluovuttajien kautta. Kuvassa 10 tarkastellaan uudelleen kalmoduliinin sitoutumispaikkoja ja esitetään myös sinisellä merkittyjen kalsiumionien kanssa vuorovaikutuksessa olevien aminohappojen negatiiviset sivuhaarat.
sidottujen ligandien luovuttaja-atomeista ja niiden kyvystä luovuttaa elektronipareja koordinaatiokompleksiin spektrokemiallinen sarja selittää, miten atomit vuorovaikuttavat keskusmetallin kanssa. Kalsiumsitoutumispaikan tapauksessa Ca2+ – ionin kanssa vuorovaikuttavat hapet katsotaan kaikki σ-luovuttajiksi ja π-luovuttajiksi, koska luovuttajilla on 2 tai useampi elektronipari. Spektrokemiallisten seireiden luokat, joissa määritellään elektronien saatavuus ja luovuttaminen, vaikuttavat spin-nimitykseen (matala tai korkea), joka ilmaisee, miten D elektronit täyttävät orbitaalinsa, ja Delta (Δ) – kokoon metallin d-orbitaalien välillä, mutta tällä ei ole merkitystä kalsiumin kannalta, koska kalsiumin d-orbitaalit ovat tyhjillään valenssi d-elektronien puuttumisen vuoksi. Tämä tekee D-orbitaalit olennaisesti merkityksetön useimmissa keskusteluissa koskevat proteiinia. Yksi poikkeus liittyy systeemin kalsiumionin horjuvuuden tarkasteluun.
elektronien puuttuminen Ca: n d-orbitaaleista tuottaa nolla ligandikentän stabilointienergiaa ja selittää kalsiumionin suuren horjuvuuden. Epävakaus tarkoittaa nopeutta, jolla ligandit voidaan korvata koordinaatiokomplekseissa, ja kuvaa siten systeemin kinetiikkaa. Atomit ovat labiileja, jos ne vaihtavat ligandeja nopeasti. Koska kalmoduliini toimii kaikissa eukaryoottisoluissa, sen odotetaan sitoutuvan ja vapauttavan kalsiumioneja miljoonia kertoja sekunnissa lähettääkseen ja vastaanottaakseen viestejä ympäröivistä soluista kalsiumionien siirron kautta. Kun tarkastellaan kalmoduliinin kykyä sitoa ja vapauttaa Ca2+ nopeasti,on tärkeää ottaa huomioon valenssi d-elektroniorbitaalien miehitys. Kuten on todettu, kalsiumilla on tyhjiä valenssi d-orbitaaleja. Nämä tyhjät orbitaalit voivat antaa selityksen Ca2+ – ionin horjuvuudelle. Koska kaikki kalsiumionin d-orbitaalit ovat tyhjiä, sillä on ligandikentän stabilointienergia (LFSE)0. Tämä osoittaa, että kalsium on epävakaa lfse: tä tarkasteltaessa, koska stabiileilla molekyyleillä on yleensä negatiivinen arvo LFSE: lle. Epävakaus tässä tapauksessa tarkoittaa halukkuutta reagoida nopeasti ja liikkua ja pois komplekseja, tukee väitettä, että Ca2+ ionit edistävät nopeita reaktioita ja voidaan luonnehtia labiiliksi. Vaikka tämä näyttää olevan ristiriidassa kelaattivaikutusta koskevan keskustelun kanssa, on selvää, että nämä kaksi teoriaa eivät ole ristiriidassa keskenään. Kelaattivaikutuksesta johtuva tiiviisti pidettyjen koordinaatiosidosten stabiilisuus kannustaa kalmoduliinia pysymään stabiilina riittävän pitkään lisäproteiinien sitomiseen. Kun tämä on valmis ja kalsiumin pitoisuus palautuu normaaliksi, se on tehokas kalsiumionien alueen strippaamisessa.
Kalmoduliini, joka perustuu sen rakenteeseen ja sen elintärkeän sidospaikan koostumukseen, on olennainen osa eukaryoottisten solujen lukemattomia prosesseja. Kalsiumionien hyväksymisen ja sitoutumisen kautta signaalinsiirtoon kalmoduliini toimii keskeisenä perus-ja korkean tason toiminnan osana eliöissä, kuten ihmisillä. Soveltamalla bioorgaanista teoriaa ja ymmärtämällä eukaryoottisen solun hienovaraisesti valvotun ympäristön, voidaan oikein ymmärtää kalmoduliinin kyky valita kalsiumioneja ja edistää toimintaa, jossa on yli 100 kumppaniproteiinia.