- plasticidade do VSMCs na fisiologia e doença
- VSMCs Afetar Adventícia Respostas Imunes em Hyperlipidemic Ratos
- envelhecimento, cronicidade ou ambos?
- Atlo Formação é Altamente Territorializado, Indicando que os Sinais são Transmitidos a Partir de Placas para a Adventícia através do Tecido Linfóide Organizador-Como VSMCs
- contribuições dos autores
- financiamento
- Declaração de conflito de interesses
plasticidade do VSMCs na fisiologia e doença
células do músculo liso Vascular (VSMCs) são os principais constituintes das artérias de médio e grande porte. Embora os mecanismos de aterogénese permaneçam em grande parte por definir, estudos demonstraram que a progressão da doença envolve crosstalk entre as células imunes com ECs e VSMCs. Algumas destas interações promovem o crescimento da placa enquanto outras atenuam o tamanho, a composição celular e a estabilidade das placas ateroscleróticas (1, 2) (Figura 1, Tabela 1). Os VSMCs mostram uma plasticidade notável em resposta a lesões vasculares, inflamação e acumulação de lipoproteína durante a progressão da doença através da reprogramação da expressão do gene e uma mudança para um fenótipo proliferativo, pro-migratório e ativado, ou seja, mudança de fenótipo (5). Na Figura 1, descrevemos os interruptores moleculares críticos que foram propostos como importantes reguladores da progressão da doença. (3, 6, 8, 11). Durante a iniciação da aterosclerose, os monócitos derivados do sangue, que foram recrutados para a intima, acumulam lípidos dando – lhes uma aparência espumosa. Estas células de espuma contribuem para a formação de fluxo de gordura que constitui o estágio mais antigo e possivelmente reversível de placas ateroscleróticas. As estrias de gordura desenvolvem-se gradualmente em ateromas/placas, conduzindo finalmente a placas expandidas que contêm VSMCs, células T e células mielóides (Figura 1) (33). Curiosamente, a composição de uma placa aterosclerótica ao invés de seu tamanho determina sua estabilidade como espessura fibrosa da tampa e tamanho do núcleo necrótico são potenciais marcas de uma placa estável contra uma placa instável, respectivamente (4, 9). Os VSMCs na camada intima são tradicionalmente vistos como benéficos durante a aterogênese porque produzem componentes de matriz extracelular, promovendo assim a formação de tampas fibrosas mais fortes, resultando em proteção contra a ruptura da placa (4, 9). É cada vez mais evidente que os VSMCs passam por uma infinidade de transformações fenotípicas estruturais e funcionais e podem até perder completamente as suas características nativas para adquirir características de outros tipos de células, incluindo macrófagos. Os dados indicam que os VSMCs podem adquirir fenótipos dicotómicos com um tipo Janus de cabeça, ou seja, propriedades pró-vs. anti – aterogénicas, dependendo do ambiente tecidular e da acção dos factores de Risco (3). Os VSMCs libertam citoquinas para estimular a ECs adjacente para expressar moléculas de adesão e libertar citoquinas, e/ou aumentar a quimiotaxia dos monócitos / macrófagos para a placa (3, 34, 35) (Tabela 1). Estes dados indicam que a acumulação de VSMCs no tampão fibroso ou na intima são benéficas, enquanto que a sua perda ou transição para um fenótipo inflamatório são prejudiciais, e que o equilíbrio entre proliferação/migração de VSMCs vs. morte/senescência determina a ateroprogressão vs. estabilidade da placa (3). Vários aspectos adicionais da biologia VSMC em Saúde e doenças foram recentemente cobertos por uma série de excelentes revisões (https://academic.oup.com/cardiovascres/issue/114/4) e não serão abrangidos aqui. A seguir, focamos a atenção no papel da adventícia e no potencial impacto do VSMCs na formação ATLO.

Figura 1. Os fenótipos de VSMCs durante a progressão de aterosclerose revelam plasticidade extraordinária. ECs e VSMCs em placas ateroscleróticas mostram fenótipos ativados ( ➊ ) (3, 4). Alguns dos VSMCs originam-se na mídia após o recrutamento para a intima; outros VSMCs podem ser derivados da medula óssea ou podem ser originários de células mielóides na circulação (➋) (3). Uma fração de VSMCs proliferam ( ➌ ) (3, 5). VSMCs secretam componentes de matriz extracelular; o Fator de transcrição pluripotente, ou seja, Klf4, pode desempenhar papéis principais em um processo referido como mudança de fenótipo (➍) (6, 7). Em tentativas de proteger a placa aterosclerótica de ruptura letal, Oct4 pode controlar um processo que tem sido chamado de remigração para formar um chapéu fibroso (➎) (4, 8-10). A senescência e a apoptose desencadeiam a geração de citoquinas inflamatórias adicionais para formar um núcleo necrótico iniciando um ciclo vicioso com consequências clínicas letais durante as fases tardias da doença (➏) (3, 4, 11).
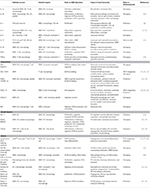
Tabela 1. Principais mediadores inflamatórios envolvidos na imunidade da aterosclerose mediada pelo VSMC.
VSMCs Afetar Adventícia Respostas Imunes em Hyperlipidemic Ratos
Durante as duas últimas décadas, tornou-se cada vez mais evidente que a adventícia é muito mais complexo e imunologicamente ativo tecido de abrigar células tão diferentes como células do estroma, nervos, vasos linfáticos, o vasa vasora, e residente leucócitos/células progenitoras todos os que têm a capacidade de afetar o progresso da doença (36, 37). Observamos que a adventícia de ApoE – / – ratinhos sofre grandes eventos de reestruturação durante todas as fases da aterosclerose: Tanto as células imunitárias inatas como adaptativas acumulam-se adjacentes às placas ateroscleróticas vizinhas (Figura 2). Além disso, nossos estudos em ratos experimentais foram corroborados em artérias doentes humanas: nós e outros observamos estruturas semelhantes ao ATLO na adventícia de pacientes apresentando aneurismas aórticos ateroscleróticos (38, 39) e, mais recentemente, Akhavanpoor et al. ATLOs bem desenvolvidos observados na adventícia de uma percentagem considerável de doentes com doença cardíaca isquémica (40). Na aterosclerose murina, vasos linfáticos -, venule endotelial elevado (HEV) – e neogênese dos vasos sanguíneos são características proeminentes deste processo de reestruturação (16, 41).
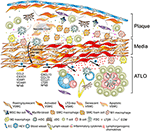
Figura 2. As células do músculo liso Vascular (VSMC) participam na imunidade adventícia durante a formação de placas. Os VSMCs entalados entre placas ateroscleróticas e a adventícia adotam um fenótipo tipo organizador de tecidos linfóides após a ativação através de tacos derivados de placas (➊) e subsequentemente transdiferentiato em células semelhantes a LTo (➋). Através do seu fenótipo proliferativo e expressivo de citoquinas, afectam a reestruturação e a escultura da adventícia, incluindo a angiogénese, a formação de VHE e a neogénese dos vasos linfáticos (➌). A mudança de fenótipo também resulta na expressão e secreção de quimioquinas linfoorganogénicas, isto é, CXCL13 e CCL21, promovendo assim a formação de ATLO representada esquematicamente na parte inferior do grafo (➍).
envelhecimento, cronicidade ou ambos?
mais importante, o envelhecimento foi encontrado para ser um importante determinante da reestruturação adventícia e escultura. Formas ATLOs totalmente desenvolvidas durante estágios avançados de aterosclerose, mas as suas fases iniciais, ou seja, agregados de células T/B, emergem em paralelo com a formação de placas ateroscleróticas (16, 27, 41, 42). Na verdade, estes ATLOs iniciais formam-se com a idade de ~30 semanas e atingem estágios mais avançados em cerca de 52 semanas para atingir o pico em 78 semanas (16, 41). Em outras doenças crônicas não solucionáveis (1, 42) observaram-se estágios de desenvolvimento dependentes da idade semelhantes de TLOs. Estes dados indicam que o desenvolvimento de ATLO é dependente da idade e o envelhecimento está positivamente associado à escultura advential (Figura 2). No entanto, a relação entre o envelhecimento e a cronicidade é difícil de estudar na aterosclerose murina à medida que o desenvolvimento da placa aterosclerótica começa no arco aórtico, em seguida, viaja semear a aorta para chegar à aorta abdominal em estágios posteriores da doença, tomando longos períodos de tempo. Mais trabalho é necessário para esclarecer a questão importante se a senescência de células imunes e/ou VSMC contribui para a formação de ATLO e que tipos de células, i.e., VSMCs, ECs e/ou células imunes estão envolvidos. Estudos em outras formas de formação de TLO, tais como aqueles que ocorrem no pulmão e no trato gastrointestinal indicariam que é a cronicidade de uma reação inflamatória persistente do tecido ao invés de eventos de envelhecimento de boa fé do sistema imunológico que está contribuindo crucialmente para a formação de ATLOs (43, 44).As estruturas adventícias recém-formadas participam da função atlo, promovendo a recirculação linfocitária
as fases ATLO avançadas incluem agregados de células T/B, centros germinais dentro de folículos celulares B activados, vasos linfáticos, VHE nas áreas das células T e redes de distribuição extracelular (16). Estas grandes mudanças assemelham-se a estruturas reminiscentes daqueles encontrados em órgãos linfóides secundários, onde promovem aspectos fundamentais das respostas imunitárias em direção ao antigénio, incluindo a recirculação de linfócitos ingênuos para encontrar os seus antigénios cognitivos/autoantígenos, e organizar a maturação de afinidade das células B para potenciais autoantigenos. Utilizando estudos de transferência de linfócitos adotivos, observamos que os ATLOs aumentam grandemente o recrutamento de linfócitos para a parede arterial, promovendo tanto a imigração quanto a atenuação concomitante da emigração de linfócitos antigénios inexperientes (27). Após o seu recrutamento, as células T tornam-se ativadas, começam a proliferar, e algumas das células auxiliares CD4 T são convertidas em células reguladoras induzidas. Estes dados revelam que o sistema imunológico na adventícia é altamente sensível para a reação do tecido inflamatório subjacente da parede arterial. Além disso, as células B que formam centros germinais em folículos de células B ativadas parecem sofrer uma reação germinal central na presença de células dendríticas foliculares, onde algumas são convertidas em células B de memória, enquanto outras deixam os centros germinais para se tornarem células plasmáticas (45). Quando tomados em conjunto, estes dados indicam que os órgãos linfóides ATLOs em vez de órgãos linfóides secundários (como se pensava anteriormente) organizam imunidade aterosclerose.
Atlo Formação é Altamente Territorializado, Indicando que os Sinais são Transmitidos a Partir de Placas para a Adventícia através do Tecido Linfóide Organizador-Como VSMCs
Outro aspecto da adventícia de reestruturação durante a aterogênese é que ATLO formação é altamente territorializado sendo restrito a adventícia segmentos adjacentes às placas ateroscleróticas na aorta abdominal em ratos (16, 45). ATLOs são encontrados apenas ocasionalmente na adventícia da artéria inominada ou do arco aórtico onde a aterosclerose é mais proeminente. As células imunes nos segmentos torácicos da aorta são compostas principalmente por agregados de células T em comparação com ATLOs na aorta abdominal (16, 41). O mecanismo exato para a territorialidade da formação de ATLOs na aorta abdominal ainda é Desconhecido. Os elos parecem ser uma característica de muitas doenças inflamatórias crônicas não solucionáveis e são marcas proeminentes de doenças auto-imunes (42). A celularidade e as estruturas de TLOs em aterosclerose são semelhantes aos TLOs em muitas outras doenças crônicas, incluindo a formação de TLO associada ao câncer (46, 47). O campo da biologia do lo expandiu-se dramaticamente nos últimos anos, aumentando a importante possibilidade de que o novo alvo terapêutico possa ser identificado através da compreensão da função do TLO em cada uma das doenças associadas ao TLO. No entanto, os vários tipos de elos revelam algumas características específicas da doença, que podem, em última análise, determinar se as respostas imunitárias associadas são prejudiciais ou protectoras. Essas características específicas da doença podem surgir através de um dos vários mecanismos, incluindo a especificidade dos órgãos e a natureza dos danos nos tecidos (1, 42). O desenvolvimento de órgãos linfóides é um processo complexo que envolve células indutoras do tecido linfóide hematopoiético (LTi), células não-hematopoiéticas organizadoras do tecido linfóide estromático (LTo) e sinalização LTßR. Os nossos estudos in-vitro de VSMCs da aorta de ratinho indicaram que, após estimulação apropriada, podem servir como células Tipo LTo (20), originalmente identificadas durante o desenvolvimento embrionário durante a formação de tecidos linfóides secundários, incluindo gânglios linfáticos e baço (48, 49) (ver abaixo). É importante notar que os ATLOs parecem envolver os VSMCs como participantes importantes, enquanto outros TLOs envolvem outras células mesencimais semelhantes aos LTO (50). O denominador comum de todas as formas de TLOs, no entanto, parece ser–ao contrário de órgãos linfóides secundários–uma inflamatória crônica do tecido reação que impulsiona o sistema imunológico para formar estas estruturas linfóides perto ou, em alguns casos, dentro do tecido doente (42, 43).Os VSMCs contribuem diretamente para a imunidade adventícia na aterosclerose, tendo em conta a natureza altamente territorializada dos ATLOs adjacentes a placas ateroscleróticas, argumentamos que os VSMCs podem estar envolvidos na formação de ATLO e, da mesma forma, podem adotar um papel funcional na progressão da aterosclerose. VSMCs expressam fortemente o LTßR constitutivamente (16), enquanto seu ligante LTa1ß2 é expresso em várias células imunes denominadas células LTi (51). Pensa-se que os VSMCs são activados através da via de sinalização LTßR-LT pelas células LTi envolvidas na neogénese secundária dos tecidos linfóides. A origem da célula LTi ainda não foi claramente determinada, embora macrófagos ativados e outras células imunitárias na placa intima sejam candidatos a esta atividade na NEOGÊNESE LTO. Em resposta a celulares e solúveis mediadores VSMCs parecem submeter-se a um distinto tipo de fenótipo mudar para um LTo-como o fenótipo por secreção parácrina do lymphorganogenic quimiocinas, i.é., CXCL13 e CCL21, assim, atraindo células do sistema imunológico, por exemplo, macrófagos/células dendríticas, células T e células B para o local adventícia meio, levando a formação de ATLO na adventícia (27, 41, 45) (Tabela 1). A deficiência Global OU específica do LTßR em ratinhos com ApoE/− alvenaria hiperlipidémica envelhecida demonstrou um aumento da formação de placas ateroscleróticas, indicando que o VSMC LTßR tem a capacidade de atenuar o desenvolvimento da aterosclerose em algumas condições experimentais (27). Outros estudos, no entanto, mostraram que os ratos de ApoE−/− LTbR−/−a nível mundial jovens mantidos sob uma dieta rica em gorduras (DHF) revelaram uma carga de placas aórticas inferior à dos seus homólogos de ApoE-/− alimentados com dieta normal (52). Estes dados aparentemente contraditórios indicam que os papéis do LTßR em ratinhos Jovens e em condições de hiperlipidemia excessiva podem ser diferentes nos dois modelos. Alternativamente, a dieta rica em gorduras, que leva a níveis dramáticos e possivelmente intoxicantes de lípidos plasmáticos, pode ser responsável por estas diferenças. Uma vez que não usamos regularmente uma dieta rica em gorduras em ratos de ApoE, estas discrepâncias continuam a ser questões não resolvidas, embora tenha sido demonstrado que o sistema imunitário pode ser esmagado por níveis extremos de lípidos de plasma . Estes dados requerem estudos adicionais para examinar a base molecular para a dicotomia aparente do LTßR na progressão da aterosclerose em ratinhos jovens vs. idosos e/ou aterosclerose precoce vs. avançada. Além disso, os macrófagos derivados da medula óssea podem funcionar como células LTi independentes do LTßR e desencadear a expressão de CCL19, CCL20 e CXCL16 por VSMCs (53) (Quadro 1). Assim, o VSMCs pode participar na formação de TLOs em aterosclerose por upregulação de quimioquinas linforganogénicas para promover agregados de células imunes na adventícia. Como mencionado acima, os ATLOs são comuns em seres humanos sobrecarregados por doença coronária isquémica (40) e em aneurismas aórticos ateroscleróticos humanos (38, 39). Quando tomados em conjunto, a ocorrência de Emlos experimental em ratos e em humanos aterosclerose levantam questões importantes sobre a natureza da aterosclerose como uma doença auto-imune: é concebível que, durante a aterogênese auto-imune de células T auto-imunes e células B dirigida contra ainda não identificado autoantigens são gerados. O isolamento desses linfócitos auto-imunes, incluindo a sequenciação dos seus receptores das células T e/ou das células B, permitiria testar hipóteses principais em aterosclerose. Com efeito, a investigação sobre aterosclerose sofreria uma grande mudança e tornar-se-ia possível testar os clones linfocitários auto-imunes individuais em sistemas funcionais in vitro e in vivo.A aterosclerose é uma doença inflamatória das artérias. Os VSMCs comunicam com as células ECs e imunes nas placas ateroscleróticas e células residentes na adventícia. Esta capacidade permite que VSMCs para afetar a imunidade aterosclerose de formas principais, incluindo a formação de ATLOs. Mais trabalho é necessário para delinear o papel dos VSMCs durante diferentes estágios de aterosclerose, determinar o seu papel em artérias jovens vs. envelhecimento, e elucidar ainda mais seus papéis dicotômicos na progressão da doença. Uma melhor compreensão destes processos pode abrir o caminho para desenvolver estratégias terapêuticas para a intervenção futura em fases tardias clinicamente importantes da doença.
contribuições dos autores
todos os autores contribuíram para o desenho, escrita e edição do manuscrito submetido, e aprovaram-no para publicação.
financiamento
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. A apoptose das células musculares lisas vasculares induz características de vulnerabilidade da placa na aterosclerose. Nat Med. (2006) 12:1075–80. doi: 10.1038/nm1459
PubMed Abstract / CrossRef Full Text | Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Regulação Molecular da diferenciação das células vasculares do músculo liso no desenvolvimento e doença. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. A modulação fenotípica dependente do KLF4 das células do músculo liso tem um papel fundamental na patogênese aterosclerótica da placa. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstract / CrossRef Full Text | Google Scholar
7. Gomez D, Owens GK. Alteração fenotípica das células musculares lisas na aterosclerose. Cardiovasc Res. (2012) 95:156-64. Doi: 10.1093/cvr/cvs115
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. A activação do factor de pluripotência OCT4 nas células do músculo liso é ateroprotectora. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstract / CrossRef Full Text | Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk e, Garcia-Garcia HM, Herrmann J, et al. Estabilização das placas ateroscleróticas. Position paper of the European Society of Cardiology (ESC) Working Group on aterosclerosis and vascular biology. Thromb Hemost. (2011) 106:1–19. doi: 10. 1160 / TH10-12-0784
PubMed Abstract | CrossRef texto completo | Google Scholar
11. Grootaert MOJ, Moulis M, Roth l, Martinet W, Vindis C, Bennett MR, et al. Morte Vascular das células musculares lisas, autofagia e senescência em aterosclerose. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093 / cvr / cvy007
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Dosch AO, Katus HA, et al. As duas Faces da interleucina-17A em aterosclerose. Alvos De Droga. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstract | CrossRef texto completo | Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. O factor de crescimento tipo insulina-1 e o TNF-alfa regulam a autofagia através das vias cinase n-terminal C-jun e Akt nas células lisas vasculares ateroscleróticas humanas. Biol De Células Imunol. (2006) 84:448–54. doi: 10.1111 / J. 1440-1711. 2006. 01454.x
PubMed Abstract / CrossRef Full Text | Google Scholar
16. Grabner R, Lotzer K, Dopping s, Hildner M, Radke D, Beer M, et al. A sinalização do receptor beta da linfotoxina promove a organogénese linfóide terciária na adventícia da aorta de ratinhos−/− ApoE idosos. J Val. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Full Text | Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Potenciated expression of the homeostatic chemokines CCL19 and ccl21 in clinical and experimental aterosclerosis: possible pathogenic role in plaque desestabilization. Arterioscler Thromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.QUADRICICLO.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Níveis aumentados da quimiocina cxcl13 homeostática na aterosclerose humana–papel potencial na estabilização da placa. Aterosclerose. (2012) 224:266–73. doi: 10.1016 / j. aterosclerose.2012.06.071
CrossRef Full Text | Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk s, Tang R, Snarski P, et al. A deficiência em receptores do factor de crescimento tipo insulina-1 nos macrófagos acelera a aterosclerose e induz um fenótipo instável em placas em ratinhos com deficiência em apolipoproteína E. Circulacao. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Alexander MR, Owens GK. Controlo epigenético da diferenciação das células do músculo liso e mudança fenotípica no desenvolvimento vascular e na doença. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstract | CrossRef texto completo | Google Scholar
24. He c, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. A sinalização PDGFRbeta regula a inflamação local e sinergiza com hipercolesterolemia para promover a aterosclerose. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Atingir a interleucina-1beta protege dos aneurismas aórticos induzidos por alterações na sinalização do Factor de crescimento beta. Imunidade. (2017) 47:959-73 E9. doi: 10.1016 / j. immuni.2017.10.016
CrossRef Full Text | Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Os órgãos linfóides terciários da artéria controlam a imunidade da aorta e protegem contra a aterosclerose através dos receptores beta da linfotoxina das células do músculo liso vascular. Imunidade. (2015) 42:1100–15. doi: 10.1016 / j. immuni.2015.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad a, Ranheim T, et al. NLRP3 expressão e activação de inflamasomas na aterosclerose humana. Sou O Coração Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Full Text | Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Aptidão protectora do anexo na formação de neointima arterial em ratinhos propensos à aterosclerose-breve relatório. Arterioscler Thromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Full Text | Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. A orientação neuro-imune neotrin – 1 promove a aterosclerose inibindo a emigração de macrófagos de placas. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Texto Completo | Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland Jl. Senescência celular e fenótipo secretário senescente: oportunidades terapêuticas. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstract / CrossRef Full Text | Google Scholar
37. Majesky MW, Horita H, Ostriker a, Lu s, Regan JN, Bagchi A, et al. Células do músculo liso diferenciadas geram uma subpopulação de células progenitoras vasculares residentes na adventícia regulada pelo Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Dosch AO, Katus HA, et al. Classificação adventícia terciária de órgãos linfóides na aterosclerose humana. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. A lâmina adventícia é o principal local de acumulação de células imunitárias em ratinhos apolipoproteínas padrão alimentados com chow. Arterioscler Thromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.QUADRICICLO.0000187470.31662.fe
PubMed Abstract / CrossRef Full Text | Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Os órgãos linfóides terciários arteriais contribuem para as respostas imunitárias inatas e adaptativas na aterosclerose avançada do rato. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Buettner m, Lochner M. Development and function of secondary and tertiary lymphoid organs in the small intestine and the colon. Imunol Frontal. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Os órgãos linfóides terciários das artérias controlam a aterosclerose territorializada multilateralizada respostas das células B em ratos idosos. Arterioscler Thromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Full Text | Google Scholar
48. van de Pavert SA, Mebius RE. Novos conhecimentos sobre o desenvolvimento de tecidos linfóides. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Full Text | Google Scholar
50. Barone F, Gardner DH, Nayar S, Stenthal N, Buckley CD, Luther SA. Fibroblastos estromais em estruturas linfóides terciárias: um novo alvo em inflamação crónica. Imunol Frontal. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstract | CrossRef Full Text | Google Scholar
51. Scandella e, Bolinger B, Lattmann e, Miller S, Favre S, Littman DR, et al. Restauração da integridade dos órgãos linfóides através da interacção das células indutoras do tecido linfóide com o estroma da zona das células T. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstract / CrossRef Full Text | Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar