Elettroliti ionici
Acqua e altre molecole polari sono attratti da ioni, come mostrato in Figura \(\PageIndex{2}\). L’attrazione elettrostatica tra uno ion e una molecola con un dipolo è chiamata attrazione ion-dipolo. Queste attrazioni svolgono un ruolo importante nella dissoluzione dei composti ionici nell’acqua.
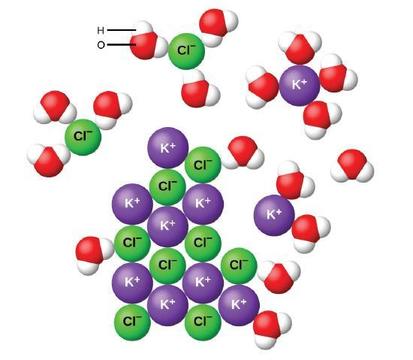
Quando i composti ionici si dissolvono in acqua, gli ioni nel solido si separano e si disperdono uniformemente in tutta la soluzione perché le molecole d’acqua circondano e solvano gli ioni, riducendo le forti forze elettrostatiche tra di loro. Questo processo rappresenta un cambiamento fisico noto come dissociazione. Nella maggior parte delle condizioni, i composti ionici si dissociano quasi completamente quando disciolti, e quindi sono classificati come elettroliti forti.
Consideriamo cosa succede a livello microscopico quando aggiungiamo KCl solido all’acqua. Le forze Ion-dipolo attraggono l’estremità positiva (idrogeno) delle molecole d’acqua polari agli ioni negativi di cloruro sulla superficie del solido e attraggono le estremità negative (ossigeno) agli ioni positivi di potassio. Le molecole d’acqua penetrano tra i singoli ioni K+ e Cl e li circondano, riducendo le forti forze interioniche che legano gli ioni insieme e lasciandoli spostare in soluzione come ioni solvati, come mostra la figura. La riduzione dell’attrazione elettrostatica permette il moto indipendente di ogni ion idrato in una soluzione diluita, con conseguente aumento del disordine del sistema mentre gli ioni cambiano dalle loro posizioni fisse e ordinate nel cristallo agli stati mobili e molto più disordinati in soluzione. Questo aumento del disturbo è responsabile della dissoluzione di molti composti ionici, tra cui KCl, che si dissolvono con l’assorbimento del calore.
In altri casi, le attrazioni elettrostatiche tra gli ioni in un cristallo sono così grandi, o ione-dipolo, forze attrattive tra gli ioni e le molecole di acqua sono così debole, che l’aumento del disordine non può compensare l’energia necessaria per separare gli ioni, e il cristallo è insolubile. Tale è il caso di composti come il carbonato di calcio (calcare), il fosfato di calcio (il componente inorganico dell’osso) e l’ossido di ferro (ruggine).