Le reazioni in soluzione che non sono catalizzate sono lente poiché lo sviluppo e la separazione della carica avvengono nello stato di transizione. Quando i legami sono fatti o rotti, i mediatori caricati sono formati spesso che sono più alti nell’energia che i reagenti. Poiché l’intermedio è più alto in energia rispetto ai reagenti, lo stato di transizione sarebbe ancora più alto in energia, e quindi più simile all’intermedio carico. Tutto ciò che può stabilizzare le cariche sull’intermedio e quindi le cariche in via di sviluppo negli stati di transizione abbasserà l’energia dello stato di transizione e catalizzerà la reazione. In questa sezione studieremo il meccanismo alla base della catalisi da parte di piccole molecole di reazioni chimiche. Presumibilmente, il catalizzatore macromolecolare biologico (come gli enzimi proteici) utilizzerà meccanismi simili nei loro effetti catalitici (che saranno discussi nella prossima sezione).
I catalizzatori, compresi gli enzimi, possono impiegare almeno 5 modi diversi per stabilizzare gli stati di transizione.
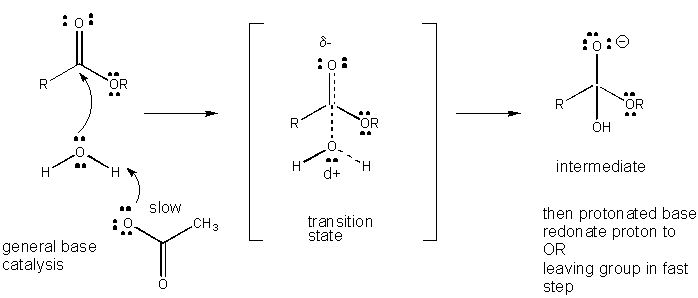
Lo sviluppo di carica nel TS può essere diminuito dalla donazione di un protone da acidi generali (come l’acido acetico o un anello indolo protonato) ad un atomo come un carbonile O che sviluppa una carica negativa parziale nel TS quando è attaccato da un nucleofilo. La donazione di protoni diminuisce il negativo in via di sviluppo nel TS. In alternativa, un nucleofilo come l’acqua che sviluppa una carica positiva parziale nel TS mentre inizia a formare un legame con un C elettrofilo in un carbonile può essere stabilizzato dalla presenza di una base generale (come l’acetato o l’anello indolo deprotonato). Astrazione del protone diminuisce paesi in via di carica positiva
Figura: CARICA di SVILUPPO IN STATO di TRANSIZIONE PER IDROLISI dell’ESTERE
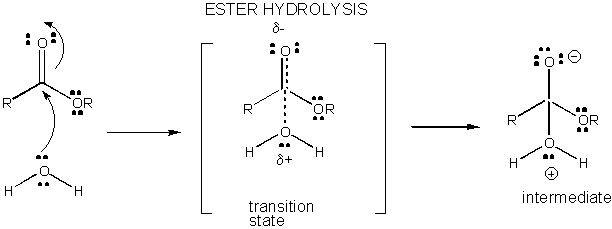
Figura: è un MECCANISMO DI CATALISI ACIDA GENERALE
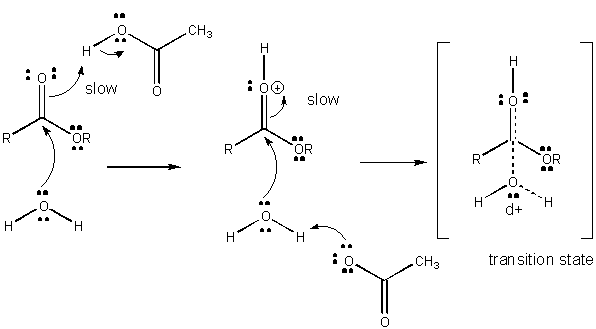
Figura: è un MECCANISMO DI BASE GENERALE CATALISI
Collaboratori e Attribuzioni
- Prof. Enrico Jakubowski (Collegio di San Benedetto/St. John’s University)