Reazioni di apertura dell’anello di epossido-SN1 vs. SN2, regioselettività e stereoselettività
Le reazioni di apertura dell’anello non enzimatico degli epossidi forniscono una bella panoramica di molti dei concetti che abbiamo già visto in questo capitolo. Le reazioni di apertura dell’anello possono procedere con meccanismi SN2 o SN1, a seconda della natura dell’epossido e delle condizioni di reazione. Se l’epossido è asimmetrico, la struttura del prodotto varierà in base a quale meccanismo domina. Quando un epossido asimmetrico subisce solvolisi in metanolo basico, l’apertura dell’anello avviene mediante un meccanismo SN2 e il carbonio meno sostituito è il sito di attacco nucleofilo, portando a ciò che ci riferiremo come prodotto B:

Al contrario, quando la solvolisi si verifica in metanolo acido, la reazione avviene con un meccanismo con carattere SN1 sostanziale e il carbonio più sostituito è il sito di attacco. Di conseguenza, predomina il prodotto A.

Questi sono entrambi buoni esempi di reazioni regioselettive. In una reazione regioselettiva, due (o più) diversi isomeri costituzionali sono possibili come prodotti, ma uno è formato preferenzialmente (o talvolta esclusivamente).
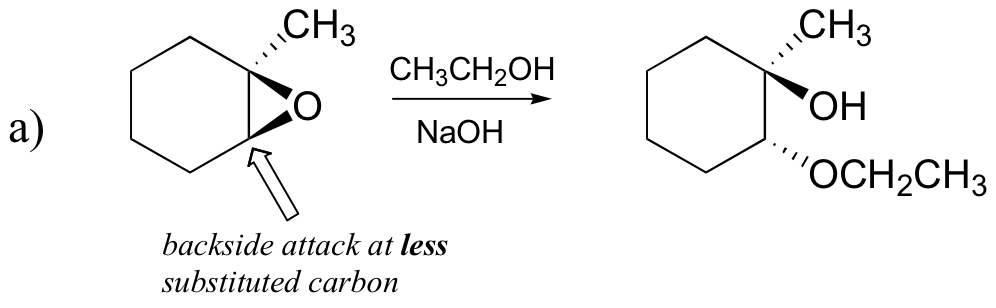
Esaminiamo prima il caso SN2 di base. Il gruppo di partenza è un anione alcossido, perché non c’è acido disponibile per protonare l’ossigeno prima dell’apertura dell’anello. Un alcossido è un gruppo di partenza povero, e quindi è improbabile che l’anello si apra senza una “spinta” dal nucleofilo.

Il nucleofilo stesso è potente: uno dep metossido deprotonato e caricato negativamente. Quando una reazione di sostituzione nucleofila coinvolge un gruppo di partenza povero e un potente nucleofilo, è molto probabile che proceda con un meccanismo SN2.
Che dire dell’elettrofilo? Ci sono due carboni elettrofili nell’epossido, ma il miglior bersaglio per il nucleofilo in una reazione SN2 è il carbonio che è meno ostacolato. Questo spiega il risultato regiochimico osservato. Come in altre reazioni SN2, attacco nucleofilo avviene dal retro, con conseguente inversione al carbonio elettrofilo.
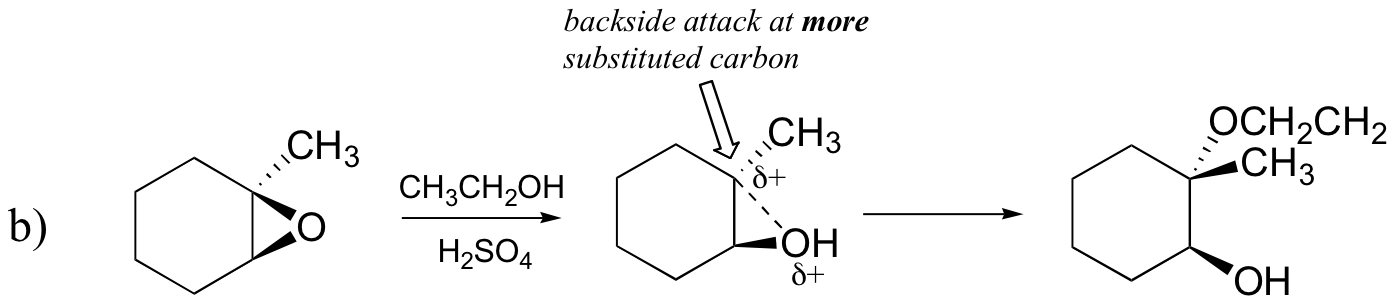
Probabilmente il modo migliore per descrivere la reazione di apertura dell’anello epossido catalizzato dall’acido è come un ibrido, o croce, tra un meccanismo SN2 e SN1. Innanzitutto, l’ossigeno viene protonato, creando un buon gruppo di partenza (passaggio 1 sotto) . Quindi il legame carbonio-ossigeno inizia a rompersi (passaggio 2) e la carica positiva inizia a accumularsi sul carbonio più sostituito (ricorda la discussione della sezione 8.4 B sulla stabilità della carbocation).

A differenza di una reazione SN1, il nucleofilo attacca il carbonio elettrofilo (fase 3) prima che un intermedio di carbocation completo abbia la possibilità di formarsi.

L’attacco avviene preferenzialmente dal retro (come in una reazione SN2) perché il legame carbonio-ossigeno è ancora in una certa misura in atto e i blocchi di ossigeno attaccano dal lato anteriore. Si noti, tuttavia, come l’esito regiochimico sia diverso dalla reazione catalizzata dalla base: nel processo acido-catalizzato, il nucleofilo attacca il carbonio più sostituito perché è questo carbonio che detiene un maggior grado di carica positiva.
Esercizio 8.17:
Prevedere il maggiore prodotto(s) di apertura dell’anello di reazione che si verifica quando l’epossido mostrato di seguito viene trattato con:
a) etanolo e una piccola quantità di idrossido di sodio
b) etanolo e una piccola quantità di acido solforico

Suggerimento: assicurati di considerare sia la regiochimica che la stereochimica!
Khan academy video

l’apertura dell’Anello in condizioni acide: