Inferiore del seno petroso di campionamento (IPSS) è una procedura invasiva che di ormone adrenocorticotropo (ACTH) i livelli sono acquisiti dalle vene che drenano la ghiandola pituitaria; questi livelli sono poi confrontati con i livelli di ACTH nel sangue periferico per determinare se un tumore ipofisario (in contrasto con l’origine ectopica di ACTH) è responsabile per ACTH-dipendente la sindrome di Cushing. IPSS può anche essere utilizzato per stabilire su quale lato della ghiandola pituitaria si trova il tumore.
La malattia di Cushing deriva da un’eccessiva produzione di cortisolo a causa di elevati livelli di ACTH prodotti da un tumore pituitario. Al contrario, la sindrome di Cushing comprende tutte le condizioni di ipercortisolismo dovute a cause dipendenti dall’ACTH (ad esempio, malattia di Cushing o secrezione ectopica di ACTH da parte di un tumore nonpituitario) o cause indipendenti dall’ACTH (ad esempio, eccessiva secrezione autonoma di cortisolo da un tumore adrenocorticale iperfunzionante).
Altre e più rare condizioni che possono portare alla sindrome di Cushing includono la secrezione ectopica dell’ormone di rilascio della corticotropina (CRH), iperplasia surrenalica nodulare pigmentata bilaterale primaria, iperplasia surrenalica macronodulare, azioni ectopiche di peptidi inibitori gastrici e altre sindromi, come la sindrome di McCune-Albright e la sindrome di Carney. Gli stati pseudo-Cushing con presentazioni cliniche simili possono essere trovati nella depressione e nella dipendenza da alcol. Le caratteristiche di Cushingoid possono anche essere trovate nell’obesità.
Differenziare l’ACTH-dipendente dalla malattia di Cushing indipendente dall’ACTH è spesso semplice, ma può essere difficile differenziare la malattia di Cushing dall’ipercortisolismo causato dalla secrezione ectopica di ACTH (cioè da una fonte nonpituitaria) a causa della secrezione ciclica e intermittente da parte dei tumori che secernono l’ACTH e delle diverse sensibilità e specificità dei vari test biochimici. Secondo Prabhu et al (2002), il valore dell’imaging trasversale nella sindrome di Cushing dipendente dall’ACTH è anche limitato perché piccoli incidentalomi ipofisari non funzionanti sono presenti fino al 10% delle scansioni MRI eseguite in giovani sani.
La scarsa sensibilità dell’imaging per i microadenomi dell’ipofisi è un altro problema. Gli adenomi ipofisari secernenti ACTH sono difficili da identificare su MRI standard da 1,5 T o 3T e con imaging a contrasto dinamico. Nella maggior parte dei casi, la risonanza magnetica ponderata T1 potenziata con contrasto a fetta sottile di routine è in grado di fornire dettagli anatomici e aiutare a identificare il modello di drenaggio IPS. In alcuni casi, quando il modello di drenaggio non può essere identificato, anche la risoluzione spaziale non aiuta a ritrarre l’anatomia complessa. In tale situazione, l’IPSS da solo aiuta a differenziare la malattia di Cushing dalla sindrome di Cushing a causa di tumori ectopici che secernono ACTH ed è quindi ancora il gold standard per la diagnosi di adenomi ipofisari che secernono ACTH. È ben noto che l’IPSS può diagnosticare con precisione la malattia di Cushing ed è anche noto che la risonanza magnetica fornisce una maggiore precisione nella localizzazione del sito dell’adenoma. Kakade et al. hanno suggerito che in caso di risultati pituitari MRI equivoci, IPSS precedenti possono evitare inutili interventi chirurgici transsfenoidali. Uno studio riporta che la risonanza magnetica 7T può aiutare a rilevare la malattia di Cushing negativa da 1,5 T e 3 T e può prevenire l’IPSS in futuro.
Storia del campionamento del seno petrosale
L’IPSS è stato introdotto nel 1977 da Corrigan et al, che hanno riportato l’uso di cateterizzazione selettiva unilaterale e campionamento venoso per localizzare la secrezione di ACTH in un paziente con un quadro clinico e di laboratorio perplesso compatibile con la secrezione ectopica di ACTH o la sindrome di Cushing Successivamente, è stato stabilito che i livelli di ACTH nel drenaggio venoso ipofisario possono essere asimmetrici, a causa della posizione dell’adenoma corticotropo o delle variazioni asimmetriche nell’anatomia venosa.
Il drenaggio venoso ipofisario è solitamente ipsilaterale, quindi il drenaggio venoso sul lato controlaterale rispetto all’adenoma non ha spesso un’alta concentrazione di ACTH. Doppman et al (1984) hanno suggerito il campionamento simultaneo da entrambi i seni petrosali inferiori (IPSs) per evitare risultati falsi negativi in presenza di un adenoma corticotropo ipofisario. Questa procedura è stata definita campionamento bilaterale del seno petroso inferiore (BIPSS).
Molti adenomi corticotropici sono suscettibili alla stimolazione mediante CRH somministrato esogenicamente, come descritto per la prima volta nel 1991 da Oldfield et al per aumentare la sensibilità del BIPSS. Due diverse forme di CRH sono state utilizzate nei vari studi riportati: CRH ovino (oCh) e CRH umano (hCRH). Nieman et al (1989) hanno riferito che le risposte periferiche di ACTH e cortisolo all’oCh erano significativamente più alte rispetto al CRH umano.
Futuro e controversie
Alcuni centri hanno riportato una maggiore precisione e localizzazione intrasellare con campionamento bilaterale del seno cavernoso, ma vi è un aumentato rischio di paralisi del nervo cranico, quindi questa tecnica non ha ancora guadagnato popolarità.
Il campionamento venoso giugulare interno (IJVS) è stato anche tentato come alternativa tecnicamente più semplice al BIPSS. Radvany et al. IJVS confrontato con IPSS in 30 pazienti consecutivi con sindrome di Cushing ACTH-dipendente MRI-negativo. I loro risultati indicano che IJVS non è così utile come IPSS nella diagnosi dell’ipofisi come fonte di ACTH eccessivo. Sebbene IJVS abbia specificità simile a quella del BIPSS, ha una sensibilità inferiore (83% contro 94%), secondo Ilias et al.
Utilizzando campioni prelevati da IPSS, Oklu et al hanno identificato 3 piccoli biomarcatori potenziali composti della malattia di Cushing (piridossato, acido desossicolico e trimetil adipato). Questi possono chiarire la biologia del tumore e suggerire, in futuro, possibili sonde diagnostiche di imaging molecolare e obiettivi terapeutici in pazienti con malattia ricorrente dopo l’intervento chirurgico.
Anatomia pertinente
Una descrizione dettagliata dell’anatomia IPS è stata fornita da Miller e Doppman (1991) (vedi immagine sotto).
 Anatomia del seno petroso inferiore
Anatomia del seno petroso inferiore Nella maggior parte degli individui, l’IPS si restringe per diventare una singola vena, svuotandosi nella vena giugulare interna ipsilaterale (IJV). In circa il 25% degli individui, il drenaggio IPS forma un plesso di canali che si svuotano nell’IJV. Nello 0,6%-7% degli individui, non vi è alcuna connessione tra l’IJV e l’IPS, rendendo impossibile il campionamento standard.
In circa il 60% degli individui, il drenaggio venoso ipofisario è simmetrico, con la maggior parte degli effluenti venosi da ciascun lato dell’ipofisi che drenano verso l’ipsilaterale IPS. Di conseguenza, nella maggior parte delle persone, il BIPSS può essere uno strumento efficace per lateralizzare gli adenomi corticotropici e per evitare risultati falsi negativi.
Doppman et al (1999) ha attribuito il 0.prevalenza dell ‘ 8% di risultati falsi negativi a ipoplastici o anomali IPS. Shiu et al (1968) descrissero per la prima volta un sistema di classificazione per le varianti anatomiche IPS. Bonelli et al (2000) hanno descritto una modifica del sistema di classificazione di Shiu et al, come segue:
-
Tipo I (vedi immagine sotto): Un IPS anastomosing con l’IJV; la vena condilare anteriore è assente o si unisce all’IPS ad un’origine definita; il breve segmento della vena del punto di questo anastomosi al IJV è definito inferiore condilare confluenza
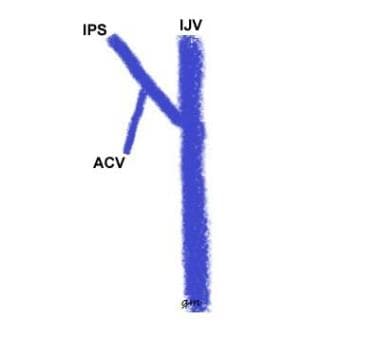 IPS di tipo variant 1
IPS di tipo variant 1 -
Tipo II (vedi immagine sotto): Un’origine comune di IPS e anteriore condilare vena con il IJV
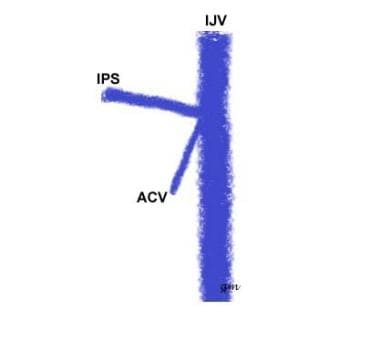 IPS di tipo variant 2
IPS di tipo variant 2 -
Tipo III (vedi immagine sotto): Un IPS composto da diversi piccoli canali che comunicano con l’IJV
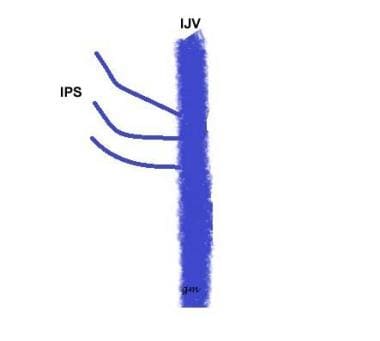 IPS variant type 3
IPS variant type 3 -
Tipo IV (vedi immagine sotto): Un IPS che comunica con la vena condilare anteriore e non l’IJV
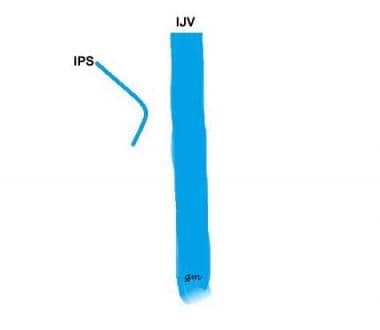 IPS variante tipo 4
IPS variante tipo 4
 IPS di tipo variant 1
IPS di tipo variant 1  IPS di tipo variant 2
IPS di tipo variant 2  IPS variant type 3
IPS variant type 3  IPS variante tipo 4
IPS variante tipo 4