Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) Un tosilato primario viene riscaldato a 150o per causare lo spostamento di SN2 dall’ossigeno del dimetilsolfossido (DMSO) in presenza di NaHCO3. Il meccanismo accettato al momento era un’eliminazione E2 come mostrato. Il dimetil solfuro (DMS) è il prodotto di riduzione della reazione. Questo lavoro ha formato il tosilato dallo ioduro alchilico con tosilato d’argento. Presumibilmente il tosilato può essere preparato dall’alcol che è una via più diretta. Lo svantaggio della procedura è la temperatura elevata anche se il tempo di contatto è solo di pochi minuti. Il problema essenziale è trovare un metodo per generare il sale sulfenato.

Barton Modifica: (1964) Barton e colleghi sono stati in grado di generare sali di solfenato trattando alchil cloroformiati con DMSO con perdita di CO2. L’aggiunta di trietilammina genera il prodotto di ossidazione. Questa procedura ha migliorato le dure condizioni della procedura di Kornblum. Inoltre, il cloroformiato è facilmente disponibile per trattamento dell’alcol da ossidare con eccesso di fosgene.

Ossidazione di Moffatt-Pfitzner: (1963) Questa variante di un’ossidazione a base di dimetilsolfossido è stata sviluppata a Syntex. L’attivatore viene preparato mediante protonazione di dicicloesil carbodiimmide (1, DCC), che viene attaccato dal dimetilsolfossido. L’intermedio 2 viene nuovamente protonato per facilitare l’aggiunta dell’ossigeno alcolico sull’atomo di zolfo. La dicicloesil urea stabile 4 si forma insieme al sale solfenato 3. Questa specie subisce il collasso del composto carbonilico sotto l’influenza dell’anione diidrogenofosfato. Sebbene l’acido fosforico sia un catalizzatore acido efficace per questa reazione, l’acido solforico, il cloruro di idrogeno e l’acido trifluoroacetico non lo sono. Tuttavia, il trifluoroacetato di piridinio è un catalizzatore efficace. È fondamentale che la base coniugata dell’acido sia sufficiente per effettuare l’ultimo passo della reazione.

Meccanismo di Torrsell: (1966) Il chimico svedese Torrsell ha dimostrato che il meccanismo di queste ossidazioni basate su DMSO non procede attraverso un’eliminazione β intermolecolare. L’eliminazione è un processo intramolecolare. Il sale di sulfenato 5 è stato preparato con la procedura di Moffatt-Pfitzner (vedi sopra). Se si applicasse il meccanismo di Kornblum, il dimetil solfuro ottenuto sarebbe privo di deuterio (Esperimento 1). Tuttavia, è stato ottenuto dimetil solfuro-d1 (7). Questo risultato è coerente con una base che deprotona il gruppo metilico attaccato allo zolfo formando ylid 6. L’ylid si decompone per deprotonazione intramolecolare per produrre i prodotti osservati.
Esperimento 1:

Per corroborare questo meccanismo il deuterio è stato incorporato in DMSO come DMSO-d6. Di conseguenza, la reazione ha prodotto dimetil solfuro-d5(12) e aldeide non volatilizzata 11 (esperimento 2).
Esperimento 2:

Ossidazione di Parikh-Doering: (1967) Questa ossidazione utilizza il complesso triossido di zolfo piridina (13) come attivatore del dimetilsolfossido. Il solfato è il gruppo di partenza nello spostamento dall’alcool (primario o secondario) in intermedio 14. Il sulfenato 15 viene decomposto dal meccanismo intramolecolare (vide supra) per produrre un’aldeide o un chetone.

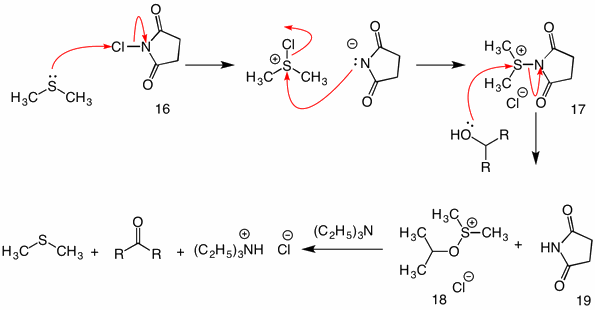
Ossidazione di Corey-Kim: (1972) In questa procedura il dimetil solfuro viene attivato (ossidato) con N-clorosuccinimmide (16) per fornire il reagente 17. Nella reazione di questa specie con un alcol, il gruppo succinimidile funziona come un gruppo di partenza. Il solito sulfenato intermedio 18 collassa dal meccanismo intramolecolare dopo l’aggiunta di trietilammina.
Ossidazione di Swern: (1976) Questa ossidazione precoce di Swern impiega anidride trifluoroacetica (20) a-50oC per attivare il dimetilsolfossido. L’aggiunta dell’alcool all’intermedio 21 produce il solfenato desiderato 22. Il chetone o l’aldeide è prodotto nel solito modo con trietilammina.

Ossidazione di Swern: (1978) Questa successiva procedura di Swern è un metodo conveniente per la produzione di reagente 24 senza utilizzare dimetil solfuro e cloro. Il dimetilsolfossido, che è allo stesso livello di ossidazione del sale 24, reagisce con il cloruro di ossalile (23) per liberare il monossido di carbonio, l’anidride carbonica e il reagente 24. L’aggiunta dell’alcool primario o secondario seguita dalla deprotonazione del sulfenato 25 con trietilammina porta rispettivamente all’aldeide o al chetone desiderati.
