- Protocolli
- Produzione di ibridomi
- rappresentazione Schematica di una cella a fusione
- Attrezzature necessarie
- Mezzo e altri reagenti (per maggiori dettagli, vedere l’appendice A)
- Prima di iniziare (vedere l’Appendice A per ulteriori dettagli)
- Scongelamento e la crescita delle cellule del mieloma
- Il processo di fusione
- Tre giorni prima – Preparare le cellule del mieloma per la fusione
- Un giorno prima – preparare il mezzo
- il Giorno della fusione
- Giorno dopo la fusione
- Appendice I
Protocolli
Produzione di ibridomi
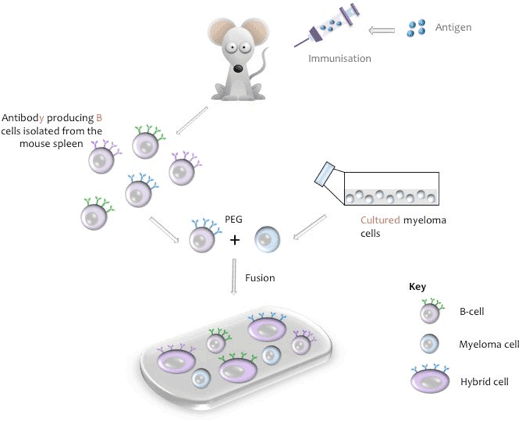
Un ibridoma è una linea cellulare derivante da una cellula ibrida che è in grado di secernere un anticorpo monoclonale specifico per un epitopo del vostro antigene permanentemente in coltura. La cellula ibrida è prodotta attraverso la fusione di anticorpi specifici che producono cellule B da un animale immunizzato (di solito un topo, un ratto o un coniglio) e che ha una durata di vita finita, con una cellula da una linea cellulare di mieloma “immortale” (ad esempio topo NS-1 o NS-0).
Produzione di una cellula ibrida del topo
Durante il processo di fusione, le cellule B sono isolate dalla milza del topo, mescolate con la linea cellulare del mieloma del topo e la fusione è indotta con polietilenglicole (PEG, vedi Appendice I). (La linea di mieloma pertinente viene utilizzata quando vengono utilizzate cellule B di altre specie animali). Gli ibridomi risultanti vengono quindi coltivati in terreno di coltura tissutale contenente ipoxatina, aminopterina, timidina (HAT), un passo che uccide tutte le cellule di mieloma non condensate che potrebbero superare le altre cellule di ibridoma più deboli. Le cellule B non condensate hanno poteri limitati di divisione e moriranno naturalmente in coltura. Dieci giorni dopo il processo di fusione, il surnatante di coltura viene raccolto e testato per la presenza dell’anticorpo desiderato.
rappresentazione Schematica di una cella a fusione
Attrezzature necessarie
- Un ambiente sterile, in cui preparare e gestire le cellule (a flusso laminare o di classe II gabinetto)
- Un incubatore a 37 ° C con 5% di CO2 e umidità del 95%
- Un microscopio invertito
- A 37 ° C in bagno-maria, che possono essere messi in armadio
- Una centrifuga con rotore oscillante
- Sterile strumenti di dissezione -idealmente due set, ognuno composto da due paia di forbici e pinze (uno curvo e uno smussato chiuso).
- Boccette per coltura di Corning da 75 ml-Rif. 15430641
- 24 piastre pozzo Falco-Rif. 353047
- Pipette sterili
- Riempitore per pipette
- Pipette pasteur sterili
- Timer A
Mezzo e altri reagenti (per maggiori dettagli, vedere l’appendice A)
- RPMI 1640 bicarbonato tamponato, con L-Glutammina (Lonza Ref. BE12-702F)
- RPMI 1640 Hepes tamponato, senza L-glutammina
- Buona qualità (testato in lotti) Siero bovino fetale (Genycell Ref. GCS0101-500)
- Penicillina / streptomicina (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- HAT (Ipoxatina, aminopterina, timidina) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Prima di iniziare (vedere l’Appendice A per ulteriori dettagli)
- Fare 500ml di Un
- Fare 500ml di media Un+
- Fare 100ml di medio B
- Fare 100ml di medio C
- Fare 500ml di medio D
Scongelamento e la crescita delle cellule del mieloma
Scongelare la linea cellulare di mieloma e crescere in media A. Utilizzare il seguente metodo per scongelare e coltivare la linea cellulare del mieloma.
- Rimuovere il flaconcino congelato di cellule di mieloma dalla memoria LN2.
- Posizionare le celle in un bagno d’acqua a 37ºC.
- Tenere il coperchio della fiala di congelamento sopra la superficie dell’acqua per ridurre le possibilità di contaminazione.
- Quando le cellule sono quasi scongelate (rimane solo un piccolo pezzo di ghiaccio) passare alla cappa di coltura tissutale.
- Pulire la parte esterna del flaconcino con etanolo al 70% e rimuovere la parte superiore.
- Rimuovere con cautela la sospensione cellulare utilizzando una pipetta Pasteur sterile.
- Trasferire il contenuto in una provetta da centrifuga contenente 10 ml di mezzo A (vedere appendice A)
- Far ruotare delicatamente la sospensione cellulare a 300 g per 5 min.
- Rimuovere il surnatante e risospendere le cellule in 10 ml di mezzo fresco A e mettere in un piccolo pallone (25cm2).
- Prelevare 1 ml di sospensione dal matraccio originale e aggiungerne un secondo con 9 ml di media A. Ciò garantisce che se la concentrazione nel primo matraccio è troppo alta, sia disponibile una seconda concentrazione (inferiore) di cellule.
- Inserire i flaconi nell’incubatore di CO2. Ricordarsi di lasciare i coperchi del pallone leggermente aperti per consentire lo scambio gassoso.
Il processo di fusione
Tre giorni prima – Preparare le cellule del mieloma per la fusione
Le cellule del mieloma devono essere in fase di crescita esponenziale quando le si utilizza e questo ha bisogno di esperienza. Tuttavia, se si impostano due flaconi da 75 cm2 delle cellule di mieloma, uno a una diluizione di 1: 40 e uno a 1:60 (vedi sotto), 3 giorni prima della fusione uno dei flaconi dovrebbe essere ideale il giorno della fusione. (Inizialmente la creazione di ulteriori flaconi a diluizioni sopra e sotto quelle fornite qui dovrebbe fornire l’esperienza necessaria per giudicare il tasso di crescita delle cellule del mieloma per le successive fusioni).
Un giorno prima – preparare il mezzo
La seguente necessità di essere fatto e pre-riscaldato a 37ºC (si può mettere in incubatrice durante la notte).
- Due x 200ml di media Un+ due 75cm2 fiaschi
- 100 ml di medio B
- 100 ml di medio C
- 1x4ml PEG 1500 trasferiti a una lamina avvolto (PEG è sensibile alla luce) sterile universale
- Un mini bagnomaria, fatto da una 200ml becher contenente circa 100 ml di acqua distillata e attraversato con il nastro abbastanza ampia in modo che ci sia un’apertura di tenere un 50 ml Falcon tubo verticale
il Giorno della fusione
- Uccidere il mouse (istituzionali, di linee guida), estratto di milza e mettere in un contenitore sterile contenente 5 ml di medium C.
- Tutti i passaggi successivi devono essere eseguiti in una cappa a flusso laminare.
- Metti la milza e il mezzo in una capsula di petri.
- Spostare la milza con una pinza sterile per lavarla. Rimuovere eventuali aderenze e trasferire la milza in una seconda capsula di petri
- Tagliare la milza in due. Tenere una metà con una pinza smussata e usando un altro paio di pinze curve, stuzzicare delicatamente le cellule dalla capsula della milza, facendo attenzione a rimuovere quante più cellule possibili. Ripetere utilizzando la seconda metà della milza
- Rimuovere i residui della capsula della milza e, usando una pipetta Pasteur sterile, mescolare bene le cellule ma molto delicatamente.
- Trasferire la sospensione cellulare in un tubo da 15 ml e utilizzare altri 5 ml di C medio per sciacquare la capsula di petri e aggiungere alle cellule della milza nel tubo.
- Contare le cellule del mieloma e della milza.
- È necessario un rapporto di 1 cellula di mieloma ogni 10 cellule di milza
- Aggiungere le cellule di mieloma in un tubo conico da 50 ml.
- Centrifugare sia le cellule della milza (tubo da 15 ml) che le cellule del mieloma in (tubo da 50 ml) per 300 g per 10 minuti.
- Versare con molta attenzione il surnatante di entrambi i tubi e risospendere delicatamente i pellet ciascuno in 10 ml di media B. L’assenza di FBS fino al completamento del processo di fusione è estremamente importante in quanto le cellule non si fondono se è presente FBS)
- Unire le cellule della milza risospese e i pellet di mieloma in una provetta da centrifuga da 50 ml.
- Centrifugare per 5 minuti a 300g.
- Versare con molta attenzione quanto più surnatante possibile.
- Risospendere il pellet toccando delicatamente il tubo sul banco. Non flick il pellet o pipetta come questo distribuirà le cellule intorno al tubo riducendo i numeri di cellule che sono disponibili per la fusione.
- Posizionare il tubo nel bagno d’acqua fatto in casa.
- Aggiungere 1,2 ml di PIOLO goccia a goccia per un minuto, mescolando delicatamente ogni poche gocce.
- Aggiungere 1 ml di medium B, goccia a goccia per un minuto, mescolando delicatamente ogni poche gocce.
- Aggiungere altri 2 ml di medium B, goccia a goccia per due minuti, mescolando delicatamente ogni poche gocce.
- Aggiungere altri 4 ml di medium B, goccia a goccia per quattro minuti, mescolando delicatamente ogni poche gocce.
- Alla fine del tempo, aggiungere 8 ml di medium C.
- Centrifugare il tubo delle cellule per 5 minuti 300g.
- Decantare molto attentamente il surnatante e risospendere il pellet cellulare per 1 minuto con 10 ml di medium A+. Per fare questo, aggiungere alcuni ml del mezzo per iniziare a rompere il pellet. Aspirare questi gruppi di cellule molto delicatamente e spostare su e giù nella pipetta. Espellere queste cellule e ripetere il processo. Essere molto delicato, non forzare il pellet a parte, si possono avere piccoli ciuffi di cellule al termine. Le cellule sono estremamente fragili in questa fase.
- Mettere il 10mls di resuspended fusion mix in 190 ml di mezzo caldo A +
- Il volume finale è di 200 ml
- Mettere 1 ml di questa sospensione in ogni pozzetto di 8×24 well (2 ml) piastre. (192 pozzetti totali)
- Lasciare le piastre nell’incubatore durante la notte (circa 24 ore).
Giorno dopo la fusione
- Aggiungi 8ml di CAPPELLO in 200ml di medium A+.
- Mettere 1 ml di questo mezzo selettivo in ciascun pozzetto delle 8 piastre.
- Lasciare le piastre nell’incubatrice. Le colonie appariranno tra 7 e 10 giorni

Appendice I
Terreno di coltura A:
Terreno RPMI 1640 con L-glutammina (bicarbonato tamponato) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillina (100U/ml)/streptomicina (100 mg / l) (Gibco Ref. 15070-063)
Terreno di coltura A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)