L’ipersensibilità dentinale è una delle lamentele più comuni dei pazienti ascoltate nello studio dentistico.1 Che colpisce fino al 57% dei pazienti, sembra picco tra i 20 ei 40.2 La prevalenza di ipersensibilità è leggermente superiore tra le donne,3 con canini e premolari di entrambi gli archi più comunemente coinvolti.4 Il dolore è spesso cronico e segnato da episodi acuti.5
Secondo Holland et al, 6 l’ipersensibilità dentinale è definita come un ” dolore breve e acuto derivante dalla dentina esposta in risposta a stimoli, che di solito sono termici, evaporativi, tattili e osmotici o chimici che di solito non possono essere attribuiti a nessun’altra forma, difetto dentale o patologia.”Di solito, il dolore è localizzato e di breve durata. Questo differisce dal dolore polposo, che è protratto, opaco, dolorante, scarsamente localizzato e dura più a lungo dello stimolo applicato.
Il disagio causato da ipersensibilità può variare da lieve a grave. I pazienti che presentano una grave ipersensibilità possono trovare difficile mangiare e bere, specialmente quando consumano sostanze calde o fredde. Il dolore sperimentato da individui con sensibilità è altamente soggettivo, tuttavia, e l’intensità è di natura episodica. Sfortunatamente, i pazienti sono raramente in grado di isolare il dente pertinente.7 Al fine di isolare le cause della sensibilità, i medici in genere si basano sull’esposizione del dente sospetto a un’esplosione d’aria o a un liquido caldo o freddo per suscitare una risposta. L’uso di una diga di gomma per isolare il dente può essere utile in questo processo.
TEORIA IDRODINAMICA
La teoria idrodinamica è la causa più comunemente concordata di ipersensibilità dentinale. Kramer8 e Brännström9 hanno confermato e ampliato questa teoria che stabilisce una relazione tra pressione applicata, esplosioni d’aria e stimoli chimici agli spostamenti del fluido dentina che si verificano in risposta a questi stimoli.7 Nella ricerca originale, Brännström ha macinato attraverso lo smalto nella dentina midcoronale dei premolari nei bambini i cui denti sarebbero stati estratti per scopi ortodontici. I tubuli dentina trasversali dei bambini sono stati esposti alla saliva per una settimana, il che ha comportato una maggiore sensibilità. Inizialmente, uno strato di striscio copriva questi denti, ma, alla fine della settimana, era scomparso, rendendo così la dentina sempre più iperconduttiva.9 La permeabilità della dentina varia e può diminuire rapidamente.10
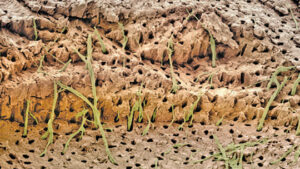
Le prove a sostegno della teoria idrodinamica si basano su studi in vivo su soggetti umani e animali. La distribuzione dei nervi nei tubuli dentinali varia, con circa il 40% che si verificano sulle corna della polpa e una percentuale minore situata nella dentina cervicale. Sembra che i tubuli dentinali aperti siano necessari affinché la dentina esposta diventi sensibile (Figura 1, pagina 18); infatti, la sensibilità di un paziente aumenterà in proporzione al numero di tubuli grandi e aperti presenti. I tubuli aperti dimostrano un’elevata conduttanza idraulica; viceversa, il flusso del fluido diminuisce se i tubuli sono bloccati. Ciò fornisce un mezzo per varie opzioni di trattamento. Magloire et al11 affermano che gli stimoli esterni provocano il movimento del liquido dentinale e che gli odontoblasti e/o la reazione del complesso nervoso possono essere un sistema meccanosensoriale distintivo, fornendo un nuovo ruolo agli odontoblasti come cellule del sensore. Il trasferimento di informazioni tra odontoblasti e assoni può essere il risultato di mediatori nello spazio tra odontoblasti e assoni, come evidenziato dai recettori nociocettivi-trasduttori e dalle fibre afferenti del trigemino, e dall’espressione di effettori reputati dagli odontoblasti (Figura 2).11
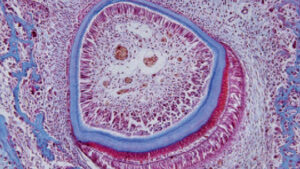
che stabiliscono la dentina (sottile strato blu), che costituisce la maggior parte del dente. Lo smalto (strato blu più spesso) è formato da ameloblasti, uno strato di cellule allungate attorno all’esterno dello smalto.
POSSIBILI CAUSE
La malattia parodontale, la recessione gengivale, i denti incrinati, l’erosione, l’abrasione, l’abfraction e la frattura del dente possono causare ipersensibilità. Tutte queste condizioni provocano la dentina esposta, che crea un ambiente in cui gli stimoli causano il movimento del fluido tubulare dentinale che attiva le fibre nervose, causando dolore. La dentina esposta può derivare dalla rimozione del cemento cervicale durante la scalatura e la piallatura delle radici, la finitura e la lucidatura dei restauri o la spazzolatura estrema dei denti, specialmente dopo l’ingestione di alimenti o bevande acide. Il rigurgito da parte dei pazienti con bulimia produce esposizione acida e la successiva spazzolatura può portare alla perdita della struttura del dente.1 Il dolore può essere localizzato o di natura generale e può interessare una varietà di superfici dentali, sia insieme che individualmente.12
Come notato, i pazienti con malattia parodontale sono soggetti a ipersensibilità dentinale.13 Studi mostrano che l’incidenza di ipersensibilità aumenta una settimana dopo l’intervento parodontale e si risolve entro otto settimane.14,15 Pazienti più giovani dimostrano una maggiore sensibilità rispetto agli adulti più anziani, nei quali la sensibilità richiede più tempo per risolversi. Il ridimensionamento e la piallatura delle radici possono anche causare sensibilità per diversi giorni dopo il trattamento.
La recessione gengivale provoca l’esposizione delle superfici radicali e la possibile sensibilità. Osso buccale fornisce la maggior parte del rifornimento di sangue per la gengiva buccale, e qualsiasi perdita di osso buccale si tradurrà in una diminuzione della gengiva.14 L’osso sottile o fenestrato, l’anatomia del dente, la posizione del dente o il movimento ortodontico possono causare recessione. Anche l’eccessiva spazzolatura dei denti con dentifricio può causare recessione.15 I segni e i sintomi dei denti screpolati possono variare a seconda della gravità. I pazienti di solito avvertono dolore acuto con masticazione, ma, dopo la rimozione dello stimolo, il dolore si attenua. Se il dolore si estende alla polpa o al legamento parodontale, persisterà.16
L’erosione è definita come una perdita di smalto attraverso la dissoluzione chimica da parte di acidi che non sono di origine batterica. Esistono tre tipi di erosione: estrinseca (ad esempio, dieta, stile di vita o ambiente), intrinseca (ad esempio, acido gastrico) e idiopatica.17 L’acido unionizzato si diffonde nelle aree interprismatiche dello smalto e scioglie il minerale nell’area sotterranea.18 Nella fase iniziale, la superficie del dente è opaca a causa della demineralizzazione, ma il dente non è ipersensibile perché la dentina con tubuli aperti non è esposta. Il composito può essere utilizzato per sigillare lo smalto per ripristinare il normale contorno e prevenire l’esposizione alla dentina.19 Il ripristino del dente migliorerà l’igiene orale e ridurrà il possibile coinvolgimento della polpa, l’abrasione dello spazzolino da denti/ dentifricio e l’erosione acida.20
Abrasione è la perdita di struttura del dente da forze meccaniche da un elemento estraneo, e può causare sensibilità.21 L’attrito è il contatto dente-dente, che deriva dalla funzione occlusale o dalla parafunzione — come il bruxismo — e può causare la perdita della struttura del dente sulle superfici occlusali e sui bordi incisali.22
Il ruolo dell’abfrazione nell’eziologia dell’ipersensibilità dentinale è controverso. Abfraction può verificarsi quando sproporzionato ciclico, carico dei denti non assiali porta alla flessione cuspide e la concentrazione di sollecitazioni nella regione cervicale sensibile dei denti. Queste lesioni cervicali, causate da stress occlusali, portano all’indebolimento della struttura del dente cervicale e possono causare l’allontanamento dello smalto, del cemento o della dentina dall’aspetto cervicale.23 Lee e Eakle24 prima descritto lesioni che possono derivare da tensioni di trazione. Hanno stabilito che una lesione di abfraction è localizzata spesso a o vicino al fulcro nell’area con la più grande concentrazione di sforzo di trazione; è tipicamente a forma di cuneo e visualizza una dimensione proporzionale al grado e all’incidenza della forza di trazione applicata.
Altri, tuttavia, sostengono che ci sono prove limitate a sostegno dell’abfrazione come causa primaria di quelle che ora vengono definite lesioni cervicali non carie. I processi non carious che provocano la perdita di tessuto duro alla zona cervicale sembrano essere multifattoriale e possono includere abrasione, sfide acide e possibilmente abfraction.23 Mentre le prove disponibili suggeriscono che queste lesioni possono svilupparsi da forze, incluse forze occlusali, che agiscono da sole o in combinazione,23 ulteriori studi sono giustificati per determinare il ruolo esatto dell’abfrazione nelle lesioni non carie e qualsiasi sensibilità correlata.
Oltre a queste fonti, lo sbiancamento dei denti causa spesso ipersensibilità dentinale. L’uso di perossido di idrogeno o perossido di carbamide può infiltrarsi attraverso lo smalto e la dentina nella polpa. La glutatione perossidasi e la catalasi nella polpa non hanno abbastanza tempo per inattivare il perossido di idrogeno, che può causare sensibilità. Va anche notato che tutti i gel sbiancanti sono ipertonici e osmoticamente attingono acqua dalla polpa attraverso la dentina e lo smalto all’agente sbiancante. Questo può potenzialmente stimolare i nervi intradentali.25
OPZIONI DI TRATTAMENTO
I medici possono raccomandare una varietà di trattamenti per uso domestico o in ufficio (vedere la tabella 1 per un diagramma di flusso dell’opzione di trattamento).26 Il meccanismo d’azione è tipicamente desensibilizzazione nervosa, precipitazione proteica, tamponamento dei tubuli dentinali, sigillatura della dentina o ablazione della dentina con un laser. Le terapie più comunemente utilizzate includono agenti antinfiammatori, precipitanti proteici, agenti che occludono i tubuli e sigillanti per tubuli. L’approccio più conservativo dovrebbe essere implementato inizialmente, con trattamenti più aggressivi suggeriti se il sollievo non viene raggiunto.27
TABELLA 1. Strategie per il trattamento dell’ipersensibilità Dentinale26 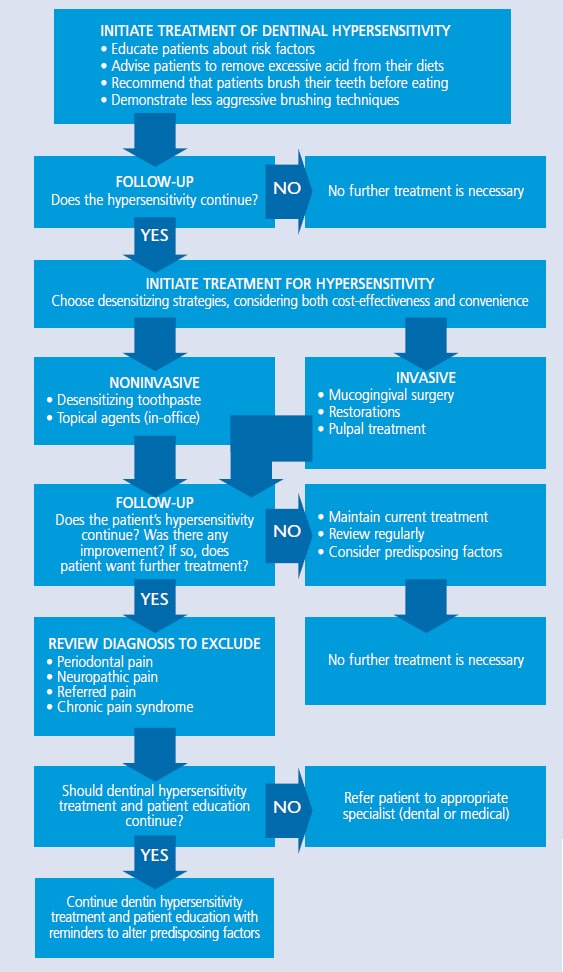 Come prima linea di difesa contro la sensibilità, i medici potrebbero raccomandare un dentifricio con sali di potassio (ad esempio, nitrato di potassio, cloruro di potassio o citrato di potassio), sali di stronzio (ad esempio, cloruro di stronzio o acetato di stronzio) o fluoruro. Gli ioni di potassio si diffondono lungo i tubuli dentinali, che bloccano l’azione nervosa e attenuano il dolore associato all’ipersensibilità. I dentifrici del sale del potassio sono efficaci, ma possono richiedere due settimane di uso coerente affinchè i pazienti avvertano gli effetti.28 In confronto, il metodo di azione trovato nei dentifrici di sale di stronzio o nel fluoro è l’occlusione del tubulo. Il fluoruro in varie forme è una strategia efficace per il sollievo a casa della sensibilità. Fluoruro di sodio, fluoruro stannoso e monofluorofsofato di sodio bloccano tutti i tubuli dentinali, riducendo la sensibilità. Possono essere utili anche i dentifrici al fluoruro di prescrizione e l’applicazione del vassoio.29le tecnologie al fosfato di calcio sono un’altra opzione per il trattamento dell’ipersensibilità. Il fosfato di calcio amorfo rende disponibili ioni di calcio e fosfato nella saliva per accelerare la remineralizzazione e può aiutare a ridurre al minimo la sensibilità indotta dallo sbiancamento. È disponibile in gel e prodotti sbiancanti.29 Inoltre, i prodotti contenenti caseina fosfopeptide – fosfato di calcio amorfo (CPP-ACP) possono essere utilizzati per occludere parzialmente i tubuli dentinali. Sebbene il pretrattamento con un agente desensibilizzante a volte interferisca con il legame riparativo, uno studio di Borges et al30 ha rilevato che la pasta con CPP-ACP non ha influenzato negativamente la forza del legame e, in alcuni casi, l’ha migliorata. Il fosfosilicato di sodio di calcio può anche aiutare nell’infiltrazione e nella remineralizzazione dei tubuli. La silice nel materiale esegue come posizione di nucleazione per la precipitazione di calcio e fosfato.31 Fosfato tricalcico (TCP) è l’aggiunta più recente alla famiglia di tecnologie di fosfato di calcio. Fornendo un lento rilascio di calcio alla superficie del dente, TCP è progettato per aumentare gli effetti rimineralizzanti del fluoro, che possono anche diminuire la sensibilità. È disponibile in una prescrizione di dentifricio e vernice al fluoro.32
Come prima linea di difesa contro la sensibilità, i medici potrebbero raccomandare un dentifricio con sali di potassio (ad esempio, nitrato di potassio, cloruro di potassio o citrato di potassio), sali di stronzio (ad esempio, cloruro di stronzio o acetato di stronzio) o fluoruro. Gli ioni di potassio si diffondono lungo i tubuli dentinali, che bloccano l’azione nervosa e attenuano il dolore associato all’ipersensibilità. I dentifrici del sale del potassio sono efficaci, ma possono richiedere due settimane di uso coerente affinchè i pazienti avvertano gli effetti.28 In confronto, il metodo di azione trovato nei dentifrici di sale di stronzio o nel fluoro è l’occlusione del tubulo. Il fluoruro in varie forme è una strategia efficace per il sollievo a casa della sensibilità. Fluoruro di sodio, fluoruro stannoso e monofluorofsofato di sodio bloccano tutti i tubuli dentinali, riducendo la sensibilità. Possono essere utili anche i dentifrici al fluoruro di prescrizione e l’applicazione del vassoio.29le tecnologie al fosfato di calcio sono un’altra opzione per il trattamento dell’ipersensibilità. Il fosfato di calcio amorfo rende disponibili ioni di calcio e fosfato nella saliva per accelerare la remineralizzazione e può aiutare a ridurre al minimo la sensibilità indotta dallo sbiancamento. È disponibile in gel e prodotti sbiancanti.29 Inoltre, i prodotti contenenti caseina fosfopeptide – fosfato di calcio amorfo (CPP-ACP) possono essere utilizzati per occludere parzialmente i tubuli dentinali. Sebbene il pretrattamento con un agente desensibilizzante a volte interferisca con il legame riparativo, uno studio di Borges et al30 ha rilevato che la pasta con CPP-ACP non ha influenzato negativamente la forza del legame e, in alcuni casi, l’ha migliorata. Il fosfosilicato di sodio di calcio può anche aiutare nell’infiltrazione e nella remineralizzazione dei tubuli. La silice nel materiale esegue come posizione di nucleazione per la precipitazione di calcio e fosfato.31 Fosfato tricalcico (TCP) è l’aggiunta più recente alla famiglia di tecnologie di fosfato di calcio. Fornendo un lento rilascio di calcio alla superficie del dente, TCP è progettato per aumentare gli effetti rimineralizzanti del fluoro, che possono anche diminuire la sensibilità. È disponibile in una prescrizione di dentifricio e vernice al fluoro.32
APPLICAZIONE IN UFFICIO
Semplici terapie in ufficio possono essere utili per affrontare la sensibilità. I medici possono applicare una pasta di profilassi desensibilizzante formulata con 8% di arginina e carbonato di calcio per occludere tubuli con tappi di arginina, calcio, fosfato e carbonato. È stato indicato per sopportare la pressione pulpale normale e le sfide acide, con successo minimizzando il flusso fluido dentinale del tubulo e, così, la sensibilità, 33 senza nuocere alla forza di legame.34
La vernice al fluoro consente il rilascio lento e continuo di fluoro. Le vernici forniscono un veicolo a base di resina naturale per il fluoro. Il fluoruro di calcio si deposita sulla superficie del dente, con conseguente formazione di fluorapatite. L’aggiunta di ossalato di potassio provoca la formazione di ossalato di calcio resistente agli acidi dopo la reazione con il calcio della dentina.35 Extended-contact varnish è una vernice al fluoro fotocurizzata che può essere utilizzata per ridurre l’ipersensibilità dentinale. È costituito da un vetro ionomero modificato in resina che incorpora glicerofosfato con rilascio di fluoro. Favorisce anche la formazione di tag di resina, consentendo l’occlusione istantanea e a lungo termine dei tubuli. Un altro prodotto di vernice combina il 5% di glutaraldeide e il 35% di idrossietilmetacrilato. Agisce come fissativo biologico e crea una coagulazione delle proteine plasmatiche nei tubuli, bloccando le aperture. In grado di ridurre la sensibilità per almeno tre mesi,,sup>36 può infiltrarsi acido-inciso e umido dentina. Queste vernici sono compatibili con adesivi, cementi e materiali di restauro e di costruzione del nucleo.37
La vernice clorexidina forma una barriera meccanica dopo l’essiccazione, che riduce la sensibilità, fornendo un’azione antiplacca e antibatterica.38
Gli ossalati hanno anche dimostrato di diminuire la permeabilità dentinale e bloccare i tubuli.39 L’ossalato reagisce con gli ioni di calcio nella dentina per formare cristalli di ossalato di calcio nei tubuli e sulla superficie. L’effetto si riduce nel tempo, tuttavia, poiché i cristalli vengono rimossi mediante spazzolatura e acidi alimentari. L’incisione migliora l’infiltrazione dei cristalli di ossalato di calcio nei tubuli.39
I medici possono anche utilizzare un desensibilizzatore fotopolimerizzabile che riduce la sensibilità attraverso la reazione del monomero con il calcio nel dente e la formazione di tag di resina, con conseguente occlusione del tubulo. Una luce indurente polimerizza successivamente lo strato di resina. Può essere utilizzato per la sigillatura immediata della dentina dei denti preparati.
OPZIONI DI TRATTAMENTO INVASIVE
Quando le terapie meno invasive non sono efficaci, il legame, l’innesto e il trattamento laser possono fornire sollievo dall’ipersensibilità dentinale. Gli agenti leganti possono essere utilizzati per desensibilizzare e legare contemporaneamente.40 A seconda del prodotto utilizzato, un potenziale svantaggio di questo approccio è la necessità di acido fosforico prima di posizionare l’agente legante, che può richiedere l’uso di anestesia.
Un’alternativa è quella di utilizzare un adesivo autoinciso. Un altro agente legante disponibile blocca i tubuli dentinali e contiene triclosan per ridurre al minimo la formazione di placca.41 Una modalità alternativa di desensibilizzazione consiste nel coprire le superfici delle radici esposte con l’innesto. Questo dovrebbe essere considerato prima di tecniche di incollaggio, tuttavia, perché restauri legati potrebbero precludere un innesto di successo.42 L’uso di Nd:Il laser di YAG fornisce l’assorbimento di energia termica su dentina, che può provocare l’occlusione o il restringimento dei tubuli dentinali.39,43
SOMMARIO
L’ipersensibilità dentinale è causata dalla dentina esposta in cui gli stimoli innescano il movimento del fluido tubulo dentinale che attiva le fibre nervose per causare dolore. La relazione tra precipitazione superficiale e intratubulare e moderazione della sensibilità non è semplice. Non è la quantità di precipitato, ma, piuttosto, la qualità, la densità, la porosità, la profondità di penetrazione e la forza di attaccamento alla dentina che influenzano i risultati.40 In definitiva, l’efficacia del trattamento è determinata dalla durata della diminuzione o dell’eliminazione.
Le decisioni di trattamento devono essere basate sulla gravità e sull’eziologia dell’ipersensibilità dentinale. Alcuni trattamenti in ufficio portare sollievo immediato che può essere seguito con una varietà di rimedi at-home. Una combinazione di tecniche può essere giustificata per fornire sollievo a lungo termine.
CHIAVI DA ASPORTO
-
- La teoria idrodinamica è la causa più comunemente concordata di ipersensibilità dentinale.
- I tubuli dentinali aperti dimostrano un’elevata conduttanza idraulica, contribuendo così alla sensibilità; viceversa, il flusso del fluido diminuisce se i tubuli sono bloccati. Ciò fornisce un mezzo per vari approcci al trattamento.
- La prevalenza di questa condizione è leggermente più alta tra le donne, 3 con canini e premolari di entrambi gli archi più comunemente coinvolti.4
- Tipicamente, il dolore da ipersensibilità è localizzato e di breve durata; questo differisce dal dolore pulpale, che è protratto, opaco, dolorante, scarsamente localizzato e dura più a lungo dello stimolo applicato.
- L’uso di una diga di gomma può essere utile quando si tenta di isolare il dente — o i denti — soggetti a ipersensibilità.
- I medici possono raccomandare una varietà di terapie per uso domestico o in ufficio. I trattamenti più comuni includono agenti antinfiammatori, precipitanti proteici, agenti tubulo-occludenti e sigillanti tubulari.
- Le decisioni di trattamento devono essere basate sulla sensibilità, gravità ed eziologia, e una combinazione di tecniche può essere giustificata per fornire un sollievo efficace.
-
-
- Addy M. Dentina ipersensibilità: Nuove prospettive su un vecchio problema. Int Dent J. 2002;52:367-375.
- Addy M. Eziologia e implicazioni cliniche dell’ipersensibilità alla dentina. Dent Clin Nord Am. 1990;34:503–514.
- Flyn J, Galloway R, Orchardson R. L’incidenza di denti ipersensibili nell’ovest della Scozia. J Dent. 1985;13:230–236.
- Addy M, Mostafa P, Newcombe RG. Ipersensibilità alla dentina: la distribuzione della recessione, della sensibilità e della placca. J Dent. 1987;15:242–248.
- Dababneh RH, Khouri AT, Addy M. Dentina ipersensibilità-un enigma? Una revisione della terminologia, dei meccanismi, dell’eziologia e della gestione. Br Dent J. 1999;187: 606-611.
- Holland GR, Narhi MN, Addy M, Gangarosa L, Orchardson R. Linee guida per la progettazione e la conduzione di studi clinici sull’ipersensibilità alla dentina. J Clin Periodontol. 1997;24:803–813.
- Li Y. Innovazioni per combattere l’ipersensibilità alla dentina: stato attuale dell’arte. Compend Contin Educ Dent. 2012; 33 (Suppl): 10-16.
- Kramer IRH. La relazione tra sensibilità della dentina e movimenti nel contenuto dei tubuli dentinali. Fr Dent J. 1955; 98: 391-392.
- Brännström M. L’elicitazione del dolore nella dentina umana e nella polpa da stimoli chimici. Arch Oral Biol. 1962;7:59–62.
- Pashley DH. Complesso dentina-predentina e sua permeabilità: panoramica fisiologica. J Dent Res. 1985;64(Suppl):613-620.
- Magloire H, Maurin JC, Couble ML, et al. Revisione topica. Dolore dentale e odontoblasti: fatti e ipotesi. Dolore J Orofac. 2010;24:335–349.
- Camilotti V, Zilly J, Nassar CA, Nassar PO. Trattamenti desensibilizzanti per l’ipersensibilità alla dentina: uno studio clinico randomizzato a bocca divisa. Braz Oral Res. 2012;26:263-268.
- Chabanski MB, Gillam DG, Bulman JS, Newman HN. Prevalenza della sensibilità alla dentina cervicale in una popolazione di pazienti riferiti a un reparto di parodontologia specialistica. J Clin Periodontol. 1996;23:989–992.
- Uchida A, Wakano Y, Fukuyama O, Miki T, Iwayama Y, Okada H. Valutazione clinica controllata di un dentifricio al 10% di cloruro di stronzio nel trattamento dell’ipersensibilità della dentina dopo chirurgia parodontale. J Periodontolo. 1980;51:578–581.
- Absi EG, Addy M, Adams D. Ipersensibilità alla dentina-l’effetto dello spazzolino da denti e dei composti dietetici sulla dentina in vitro: uno studio SEM. J Riabilitazione orale. 1992;19:101–110.
- Kahler W. L’enigma del dente incrinato: terminologia, classificazione, diagnosi e gestione. Sono J Dent. 2008;21:275–282.
- Bartlett DW. Il ruolo dell’erosione nell’usura dei denti: eziologia, prevenzione e gestione. Int Dent J. 2005;55 (Suppl): 277-284.
- Zero DT, Lussi A. Erosione — fattori chimici e biologici importanti per il dentista. Int Dent J. 2005; 55:285-290.
- Lambrechts P, Van Meerbeek B, Perdigão J, Gladys S, Braem M, Vanherle G. Terapia riparativa per la lesione erosiva. Eur J Sic orale. 1996;104:229–240.
- Grippo JO. Lesioni cervicali non carie: la decisione di ignorare o ripristinare. J Esthet Dent. 1992;4:55–64.
- Abrahamsen TC. La dentatura usurata-modelli patognomonici di abrasione ed erosione. Int Dent J. 2005; 55 (Suppl):268–276.
- McIntyre F. Ripristino dell’estetica e guida anteriore nei denti anteriori usurati. Un approccio multidisciplinare conservativo. J Am Dent Assoc. 2000;131:1279–1283.
- Michael JA, Townsend GC, Greenwood LF, Kaidonis JA. Abfraction: separare il fatto dalla finzione. Aust Dent J. 2009;54:2-8.
- Lee WC, Eakle WS. Possibile ruolo dello stress da trazione nell’eziologia delle lesioni erosive cervicali dei denti. J Protesi dentaria. 1984;52:374–380.
- Swift EJ Jr. Sensibilità dei denti e sbiancamento. Compend Contin Dent Educ Dent.2005;26 (Suppl): 4-10.
- Comitato consultivo canadese sull’ipersensibilità alla dentina. Raccomandazioni basate sul consenso per la diagnosi e la gestione dell’ipersensibilità alla dentina. J può Dent Assoc. 2003;69:221–226.
- Al-Saud LM, Al-Nahedh HN. Effetto occludente del laser Nd:YAG e diversi agenti desensibilizzanti della dentina sui tubuli dentinali umani in vitro: un’indagine di microscopia elettronica a scansione. Oper Dent. 2012;37:340–355.
- Poulsen S, Errboe M, Hovgaard O, Worthington HW. Dentifricio al nitrato di potassio per ipersensibilità alla dentina. Cochrane Database Syst Rev. 2001; 2: CD001476.
- Orchardson R, Gillam DG. Gestione dell’ipersensibilità alla dentina. J Dent Assoc. 2006;137:990–998.
- Borges BC, Souza-Junior EJ, da Costa Gde F, et al. Effetto del pretrattamento della dentina con una pasta di fosfato di calcio fosfopeptideamorfo della caseina (CPP-ACP) sulla forza di legame della dentina nelle cavità tridimensionali. Acta Odontol Scand. 2013;71:271–277.
- Forsback AP, Areva S, Salonen JI. Mineralizzazione della dentina indotta dal trattamento con vetro bioattivo S53P4 in vitro. Acta Odontol Scand. 2004;62:14–20.
- Karlinsey RL, Mackey AC. Preparazione allo stato solido e applicazione dentale di un fosfato di calcio modificato organicamente. J Mater Sci. 2009;44:346–349.
- Panagakos F, Schiff T, Guignon A. Ipersensibilità alla dentina: trattamento efficace con una pasta desensibilizzante in ufficio contenente l ‘ 8% di arginina e carbonato di calcio. Sono J Dent. 2009; 22(Suppl):3A–7A.
- García-Godoy A, García-Godoy F. Effetto di una pasta desensibilizzante all ‘ 8,0% di arginina e carbonato di calcio in ufficio sulla resistenza al taglio dei compositi allo smalto dentale umano. Sono J Dent. 2010;23:324–326.
- Camilotti V, Zilly J, Busato Dop M, Nassar CA, Nassar PO. Trattamenti desensibilizzanti per l’ipersensibilità alla dentina: uno studio clinico randomizzato a bocca divisa. Braz Oral Res. 2012;26:263-268.
- Sethna GD, Prabhulji MLV, Karthikeyan BV. Confronto di due diverse forme di vernici nel trattamento dell’ipersensibilità alla dentina: uno studio clinico randomizzato soggetto-cieco. Salute orale Prev Dent. 2011;9:143–150.
- Dijkman GE, Jongebloed WL, de Vries J, Ogaard B, Arends J. Chiusura dei tubuli dentinali mediante trattamento con glutaraldeide, uno studio di microscopia elettronica a scansione. Scand J Dent Res. 1994;102:144-150.
- Sköld-Larsson K, Sollenius O, Petersson LG, Twetman S. Effetto delle applicazioni topiche di una nuova formula di vernice clorexidina-timolo su streptococchi mutani e sviluppo della carie nelle fessure occlusali dei molari permanenti. J Clin Dent. 2009;20:223–226.
- Lan WH, Lee BS, Liu HC, Lin CP. Studio morfologico dell’utilizzo del laser Nd:YAG nel trattamento dell’ipersensibilità dentinale. J Endod. 2004;30:131–134.
- Ide M, Morel AD, Wilson RF, Ashley FP. Il ruolo di un agente dentina-bonding nel ridurre la sensibilità della dentina cervicale. J Clin Periodontol. 1998;25:286–290.
- Yu X, Liang B, Jin X, Fu B, Hannig M. Studio comparativo in vivo sull’efficacia desensibilizzante dei desensibilizzanti della dentina e degli adesivi autoincisi a una bottiglia. Oper Dent. 2010;35:279–286.
- Douglas de Oliveira DW, Marques DP, Aguiar-Cantuária IC, Flecha OD, Gonçalves PF. Effetto della copertura del difetto chirurgico sull’ipersensibilità della dentina cervicale e sulla qualità della vita. J Periodontolo. 2013;84:768–775.
- Orhan K, Aksoy U, Can-Karabulut DC, Kalender A. Terapia laser a basso livello di ipersensibilità alla dentina: uno studio clinico a breve termine. Laser Med Sci. 2011;26:591–598.
-