- Plasticità dei VSMC in fisiologia e malattia
- VSMCs Influenzare Avventizia la risposta Immunitaria nei Topi Iperlipidemici
- Invecchiamento o cronicità o entrambi?
- Le strutture avventitiche appena formate partecipano alla funzione atlo promuovendo il ricircolo dei linfociti
- La formazione di Atlo è altamente territorializzata Indicando che i segnali vengono trasmessi dalle placche all’Avventizia attraverso VSMCs di tipo organizzatore del tessuto linfoide
- I VSMC contribuiscono direttamente all’immunità avventizia nell’aterosclerosi
- Conclusione
- Contributi dell’autore
- Finanziamento
- Dichiarazione sul conflitto di interessi
Plasticità dei VSMC in fisiologia e malattia
Le cellule muscolari lisce vascolari (VSMC) sono i principali costituenti delle arterie di medie e grandi dimensioni. Sebbene i meccanismi dell’aterogenesi in gran parte rimangano da definire, gli studi hanno dimostrato che la progressione della malattia coinvolge la diafonia tra le cellule immunitarie con ECS e VSMCs. Alcune di queste interazioni promuovono la crescita della placca mentre altre attenuano le dimensioni, la composizione cellulare e la stabilità delle placche aterosclerotiche (1, 2) (Figura 1, Tabella 1). I VSMC mostrano una notevole plasticità in risposta alla lesione vascolare, all’infiammazione e all’accumulo di lipoproteine durante la progressione della malattia attraverso la riprogrammazione dell’espressione genica e uno spostamento verso un fenotipo proliferativo, pro-migratorio e attivato, cioè la commutazione del fenotipo (5). Nella Figura 1, descriviamo interruttori molecolari critici che sono stati proposti per essere importanti regolatori della progressione della malattia(3, 6, 8, 11). Durante l’inizio dell’aterosclerosi, i monociti derivati dal sangue, che sono stati reclutati nell’intima, accumulano lipidi dando loro un aspetto schiumoso. Queste cellule della schiuma contribuiscono alla formazione della striscia grassa che costituisce la fase più in anticipo e possibilmente reversibile delle placche aterosclerotiche. Le striature grasse si sviluppano gradualmente in ateromi / placche portando infine a placche espanse che contengono VSMCs, cellule T e cellule mieloidi (Figura 1) (33). Curiosamente, la composizione di una placca aterosclerotica piuttosto che la sua dimensione determina la sua stabilità in quanto lo spessore del cappuccio fibroso e la dimensione del nucleo necrotico sono potenziali caratteristiche di una placca stabile rispetto a una placca instabile, rispettivamente (4, 9). I VSMC nello strato intima sono tradizionalmente considerati benefici durante l’aterogenesi perché producono componenti della matrice extracellulare, promuovendo così la formazione di cappucci fibrosi più forti con conseguente protezione contro la rottura della placca (4, 9). È sempre più evidente che i VSMC subiscono una pletora di trasformazioni fenotipiche strutturali e funzionali e possono persino perdere completamente le loro caratteristiche native per acquisire caratteristiche di altri tipi di cellule, inclusi i macrofagi. I dati indicano che i VSMC possono acquisire fenotipi dicotomici con una natura di tipo Janus head, cioè proprietà pro-vs. anti-aterogeniche, a seconda dell’ambiente tissutale e dell’azione dei fattori di rischio (3). I VSMC rilasciano citochine per stimolare gli ECS adiacenti ad esprimere molecole di adesione e rilasciare citochine e/o migliorare la chemiotassi dei monociti / macrofagi nella placca (3, 34, 35) (Tabella 1). Questi dati indicano che l’accumulo di VSMC nel cappuccio fibroso o nell’intima è benefico, mentre la loro perdita o transizione in un fenotipo infiammatorio sono dannosi e che l’equilibrio tra proliferazione/migrazione vs. morte/senescenza determina ateroprogressione vs. stabilità della placca (3). Vari aspetti aggiuntivi della biologia VSMC in salute e malattia sono stati recentemente coperti da una serie di recensioni eccellenti (https://academic.oup.com/cardiovascres/issue/114/4) e non saranno coperti qui. Di seguito, focalizziamo quindi l’attenzione sul ruolo dell’avventizia e sul potenziale impatto dei VSMC nella formazione di ATLO.

Figura 1. I fenotipi di VSMC durante la progressione dell’aterosclerosi rivelano una straordinaria plasticità. ECs e VSMCs nelle placche aterosclerotiche mostrano fenotipi attivati ( ➊ ) (3, 4). Alcuni dei VSMC provengono dai media dopo il reclutamento nell’intima; altri VSMC possono essere derivati dal midollo osseo o possono provenire da cellule mieloidi in circolazione ( ➋ ) (3). Una frazione di VSMC prolifera ( ➌ ) (3, 5). I VSMCS secernono componenti della matrice extracellulare; il fattore di trascrizione pluripotente, cioè Klf4, può svolgere un ruolo importante in un processo denominato commutazione del fenotipo (➍) (6, 7). Nel tentativo di proteggere la placca aterosclerotica dalla rottura letale, Oct4 può controllare un processo che è stato definito remigrazione per formare un cappuccio fibroso (➎) (4, 8-10). La senescenza e l’apoptosi innescano la generazione di ulteriori citochine infiammatorie per formare un nucleo necrotico che avvia un circolo vizioso con conseguenze cliniche letali durante gli ultimi stadi della malattia (➏) (3, 4, 11).
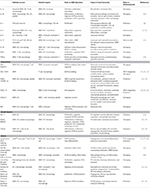
Tabella 1. Mediatori infiammatori chiave coinvolti nell’immunità aterosclerosi mediata da VSMC.
VSMCs Influenzare Avventizia la risposta Immunitaria nei Topi Iperlipidemici
Durante gli ultimi due decenni, è diventato sempre più evidente che l’avventizia è estremamente complesso e immunologicamente attive tessuto che protegge le cellule sono diverse, come le cellule stromali, i nervi, i vasi linfatici, vasa vasora, e residente leucociti/progenitrici di cellule che hanno la capacità di influenzare il progresso della malattia (36, 37). Abbiamo osservato che l’avventizia dei topi ApoE – / – subisce importanti eventi di ristrutturazione durante tutte le fasi dell’aterosclerosi: Sia le cellule immunitarie innate che quelle adattive si accumulano adiacenti alle placche aterosclerotiche vicine (Figura 2). Inoltre, i nostri studi su topi sperimentali sono stati corroborati in arterie malate umane: noi e altri abbiamo osservato strutture ATLO-simili nell’avventizia di pazienti che presentavano aneurismi aortici aterosclerotici (38, 39) e più recentemente, Akhavanpoor et al. osservato ATLOs ben sviluppato nell’avventizia di una considerevole percentuale di pazienti affetti da cardiopatia ischemica (40). Nell’aterosclerosi murina, i vasi linfatici, la venula endoteliale alta (HEV) e la neogenesi dei vasi sanguigni sono caratteristiche importanti di questo processo di ristrutturazione (16, 41).
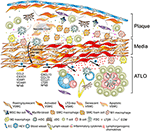
Figura 2. Le cellule muscolari lisce vascolari (VSMC) partecipano all’immunità avventizia durante la formazione della placca. I VSMC inseriti tra le placche aterosclerotiche e l’avventizia adottano un fenotipo simile all’organizzatore del tessuto linfoide dopo l’attivazione tramite segnali derivati dalla placca ( ➊ ) e successivamente transdifferenziano in cellule simili a LTo ( ➋ ). Per mezzo del loro fenotipo proliferativo e citochinico che esprime influenzano la ristrutturazione e la scultura dell’avventizia compresa l’angiogenesi, la formazione di HEV e la neogenesi dei vasi linfatici (➌). La commutazione del fenotipo provoca anche l’espressione e la secrezione di chemochine linforganogeniche, cioè CXCL13 e CCL21, promuovendo così la formazione di ATLO raffigurata schematicamente nella parte inferiore del grafico (➍).
Invecchiamento o cronicità o entrambi?
È importante sottolineare che l’invecchiamento è risultato essere un fattore determinante della ristrutturazione e della scultura dell’avventizia. Forma ATLOs completamente sviluppata durante gli stadi avanzati dell’aterosclerosi, ma le loro fasi iniziali, cioè gli aggregati di cellule T/B, emergono parallelamente alla formazione di placche aterosclerotiche(16, 27, 41, 42). Infatti, questi primi ATLOs si formano all’età di ~30 settimane e raggiungono stadi più avanzati intorno alle settimane 52 per raggiungere il picco alle settimane 78 (16, 41). Simili stadi di sviluppo dipendenti dall’età di TLOs sono stati osservati in altre malattie croniche irrisolvibili (1, 42). Questi dati indicano che lo sviluppo di ATLO dipende dall’età e l’invecchiamento è positivamente associato alla scultura avventiziale (Figura 2). Tuttavia, la relazione tra invecchiamento e cronicità è difficile da studiare nell’aterosclerosi murina poiché lo sviluppo della placca aterosclerotica inizia nell’arco aortico, quindi viaggia seminato l’aorta per raggiungere l’aorta addominale nelle fasi successive della malattia prendendo così lunghi periodi di tempo. È necessario un ulteriore lavoro per chiarire l’importante questione se la senescenza delle cellule immunitarie e / o VSMC contribuisca alla formazione di ATLO e quali tipi di cellule, ad esempio, VSMCs, ECs e/o le celle immuni sono coinvolte. Studi in altre forme di formazione di TLO come quelli che si verificano nel polmone e nel tratto gastrointestinale indicherebbero che è la cronicità di una reazione infiammatoria persistente del tessuto piuttosto che gli eventi di invecchiamento in buona fede del sistema immunitario che contribuiscono in modo cruciale alla formazione di ATLOs (43, 44).
Le strutture avventitiche appena formate partecipano alla funzione atlo promuovendo il ricircolo dei linfociti
Gli stadi ATLO avanzati includono aggregati di cellule T/B, centri germinali all’interno dei follicoli delle cellule B attivati, vasi linfatici, HEV nelle aree delle cellule T e meshworks del condotto extracellulare (16). Questi grandi cambiamenti assomigliano a strutture che ricordano quelle che si trovano negli organi linfoidi secondari dove promuovono aspetti fondamentali delle risposte immunitarie verso l’antigene, incluso il ricircolo di linfociti naïve per trovare i loro antigeni cognitivi/autoantigeni e l’organizzazione della maturazione di affinità delle cellule B verso potenziali autoantigeni. Utilizzando studi di trasferimento dei linfociti adottivi, abbiamo osservato che ATLOs migliora notevolmente il reclutamento dei linfociti nella parete arteriosa promuovendo sia l’immigrazione che la concomitante attenuazione dell’emigrazione dei linfociti inesperti di antigene (27). Successivamente al loro reclutamento, le cellule T si attivano, iniziano a proliferare e alcune delle cellule helper CD4 T vengono convertite in cellule regolatrici T indotte. Questi dati rivelano che il sistema immunitario nell’avventizia è altamente reattivo verso la reazione infiammatoria del tessuto sottostante della parete arteriosa. Inoltre, le cellule B che formano i centri germinali nei follicoli delle cellule B attivate sembrano subire una reazione centrale germinale in presenza di cellule dendritiche follicolari dove alcune vengono convertite in cellule B di memoria mentre altre lasciano i centri germinali per diventare plasmacellule (45). Se presi insieme, questi dati indicano che ATLOs piuttosto che gli organi linfoidi secondari (come si pensava in precedenza) organizzano l’immunità all’aterosclerosi.
La formazione di Atlo è altamente territorializzata Indicando che i segnali vengono trasmessi dalle placche all’Avventizia attraverso VSMCs di tipo organizzatore del tessuto linfoide
Un altro aspetto della ristrutturazione dell’avventizia durante l’aterogenesi è che la formazione di ATLO è altamente territorializzata essendo in gran parte limitata ai segmenti di avventizia adiacenti alle placche aterosclerotiche nell’aorta addominale nei topi (16, 45). ATLOs si trovano solo occasionalmente nell’avventizia dell’arteria innominata o dell’arco aortico dove l’aterosclerosi è più prominente. Le cellule immunitarie nei segmenti toracici dell’aorta sono principalmente composte da aggregati di cellule T rispetto ad ATLOs nell’aorta addominale (16, 41). Il meccanismo esatto per la territorialità della formazione di ATLOs nell’aorta addominale è ancora sconosciuto. Le TLOS sembrano essere una caratteristica di molte malattie infiammatorie croniche irrisolvibili e sono caratteristiche di spicco delle malattie autoimmuni (42). La cellularità e le strutture delle TLOs nell’aterosclerosi sono simili alle TLOs in molte altre malattie croniche, inclusa la formazione di TLO associata al cancro (46, 47). Il campo della biologia TLO si è notevolmente ampliato negli ultimi anni aumentando l’importante possibilità che un nuovo obiettivo terapeutico possa essere identificato attraverso la comprensione della funzione di TLO in ciascuna delle malattie associate a TLO. Tuttavia, i vari tipi di TLOs rivelano alcune caratteristiche specifiche della malattia, che possono determinare in ultima analisi se le risposte immunitarie associate sono dannose o protettive. Tali caratteristiche specifiche della malattia possono sorgere attraverso uno dei diversi meccanismi tra cui la specificità degli organi e la natura del danno tissutale (1, 42). Lo sviluppo degli organi linfoidi è un processo complesso che coinvolge le cellule ematopoietiche dell’induttore del tessuto linfoide (LTi), le cellule non ematopoietiche dell’organizzatore del tessuto linfoide stromale (LTo) e la segnalazione LTßR. I nostri studi in vitro su VSMCs dell’aorta di topo hanno indicato che su stimolazione appropriata possono servire come cellule LTo-simili (20), originariamente identificate durante lo sviluppo embrionale durante la formazione di tessuti linfoidi secondari inclusi linfonodi e milza (48, 49) (vedi sotto). È importante notare che gli ATLOs sembrano coinvolgere i VSMC come partecipanti importanti mentre altri TLO coinvolgono altre cellule mesenchimali simili a LTo (50). Il denominatore comune di tutte le forme di TLOs, tuttavia, sembra essere-a differenza degli organi linfoidi secondari-una reazione infiammatoria cronica del tessuto che spinge il sistema immunitario a formare queste strutture linfoidi vicino o in alcuni casi all’interno del tessuto malato (42, 43).
I VSMC contribuiscono direttamente all’immunità avventizia nell’aterosclerosi
In considerazione della natura altamente territorializzata dell’ATLOs adiacente alle placche aterosclerotiche, abbiamo ragionato che i VSMC possono essere coinvolti nella formazione di ATLO e, allo stesso modo, possono adottare un ruolo funzionale nella progressione dell’aterosclerosi. VSMCs altamente esprimono il LTßR costitutivamente (16), mentre il suo ligando LTa1ß2 è espresso su varie cellule immunitarie chiamate cellule LTi (51). Si ipotizza che i VSMC siano attivati attraverso la via di segnalazione LTßR-LT da parte delle cellule LTi coinvolte nella neogenesi del tessuto linfoide secondario. L’origine della cellula LTi non è stata ancora chiaramente determinata sebbene i macrofagi attivati e altre cellule immunitarie nella placca intima siano candidati a questa attività nella neogenesi LTO. In risposta al cellulare e mediatori solubili VSMCs sembra subire un tipo distinto di fenotipo di commutazione a un LTo-come fenotipo di secrezione paracrina della lymphorganogenic chemochine, cioè, CXCL13 e CCL21, attirando le cellule del sistema immunitario, ad esempio, le cellule dendritiche/macrofagi, cellule T, cellule B e locale avventizia ambiente che porta alla formazione di ATLO nell’avventizia (27, 41, 45) (Tabella 1). La carenza globale o VSMC-specifica di LTßR in APOE−/− topi iperlipidemici invecchiati ha dimostrato una maggiore formazione di placca aterosclerotica indicando che il VSMC LTßR ha la capacità di attenuare lo sviluppo di aterosclerosi in alcune condizioni sperimentali (27). Altri studi, tuttavia, hanno dimostrato che i giovani topi globali ApoE−/− LTbR−/−mantenuti sotto una dieta ricca di grassi (HFD) hanno rivelato un carico di placca aortica inferiore rispetto alle loro normali controparti ApoE-/− alimentate con dieta (52). Questi dati apparentemente contraddittori indicano che i ruoli di LTßR nei topi giovani e in condizioni di iperlipidemia eccessiva possono essere diversi nei due modelli. In alternativa, la dieta ricca di grassi che porta a livelli drammatici e possibilmente inebrianti di lipidi plasmatici, può essere responsabile di queste differenze. Poiché non usiamo regolarmente una dieta ricca di grassi nei topi ApoE−/−, queste discrepanze rimangono questioni irrisolte anche se è stato dimostrato che il sistema immunitario può essere sopraffatto da livelli estremi di lipidi plasmatici . Questi dati richiedono ulteriori studi per esaminare le basi molecolari per l’apparente dicotomia dell’LTßR nella progressione dell’aterosclerosi nei topi giovani rispetto all’età avanzata e/o aterosclerosi precoce rispetto a quella avanzata. Inoltre, i macrofagi derivati dal midollo osseo possono funzionare come cellule LTI indipendenti da LTßR e innescare l’espressione di CCL19, CCL20 e CXCL16 da VSMCs (53) (Tabella 1). Pertanto, i VSMC possono partecipare alla formazione di TLOs nell’aterosclerosi mediante sovraregolazione delle chemochine linforganogene per promuovere aggregati di cellule immunitarie nell’avventizia. Come accennato in precedenza, ATLOs sono comuni negli esseri umani gravati da malattia coronarica ischemica (40) e negli aneurismi aortici aterosclerotici umani (38, 39). Se presi insieme, l’insorgenza di ATLOs nei topi sperimentali e nell’aterosclerosi umana solleva importanti domande sulla natura dell’aterosclerosi come malattia autoimmune: è concepibile che durante l’aterogenesi vengano generate cellule T autoimmuni e cellule B autoimmuni dirette contro autoantigeni ancora da identificare. L’isolamento di tali linfociti autoimmuni, compreso il sequenziamento dei loro recettori delle cellule T e / o dei recettori delle cellule B, consentirebbe di testare le principali ipotesi nell’aterosclerosi. In effetti, la ricerca sull’aterosclerosi subirebbe un cambiamento importante e la sperimentazione di singoli cloni linfocitari autoimmuni in sistemi funzionali in vitro e in vivo diventerebbe possibile.
Conclusione
L’aterosclerosi è una malattia infiammatoria delle arterie. I VSMC comunicano sia con l’ECs che con le cellule immunitarie nelle placche aterosclerotiche e con le cellule residenti nell’avventizia. Questa capacità consente ai VSMC di influenzare l’immunità all’aterosclerosi in modi importanti, inclusa la formazione di ATLOs. È necessario un ulteriore lavoro per delineare il ruolo dei VSMC durante le diverse fasi dell’aterosclerosi, determinare il loro ruolo nelle arterie giovani rispetto all’invecchiamento e chiarire ulteriormente i loro ruoli dicotomici nella progressione della malattia. Una migliore comprensione di questi processi può aprire la strada allo sviluppo di strategie terapeutiche per interventi futuri in stadi tardivi clinicamente importanti della malattia.
Contributi dell’autore
Tutti gli autori hanno contribuito alla progettazione, alla scrittura e alla modifica del manoscritto inviato e lo hanno approvato per la pubblicazione.
Finanziamento
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
4. Il nostro sito utilizza cookie tecnici e di terze parti. L’apoptosi delle cellule muscolari lisce vascolari induce caratteristiche di vulnerabilità della placca nell’aterosclerosi. Nat Med. (2006) 12:1075–80. doi: 10.1038 | nm1459
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Owens GK, Kumar MS, Wamhoff FR. Regolazione molecolare della differenziazione delle cellule muscolari lisce vascolari nello sviluppo e nella malattia. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstract | CrossRef Full Text / Google Scholar
6. Il nostro sito utilizza cookie tecnici e di terze parti. La modulazione fenotipica KLF4-dipendente delle cellule muscolari lisce ha un ruolo chiave nella patogenesi della placca aterosclerotica. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstract / CrossRef Testo completo / Google Scholar
7. Gómez D, Owens GK. Commutazione fenotipica delle cellule muscolari lisce nell’aterosclerosi. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093/cvr / cvs115
PubMed Abstract / CrossRef Full Text / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento DI, et al. L’attivazione del fattore di pluripotenza OCT4 nelle cellule muscolari lisce è ateroprotettiva. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstract / CrossRef Testo completo / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilizzazione delle placche aterosclerotiche. Position paper del gruppo di lavoro della Società Europea di Cardiologia (ESC) su aterosclerosi e biologia vascolare. Thrombb Haemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed Abstract / CrossRef Testo completo / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Morte vascolare delle cellule muscolari lisce, autofagia e senescenza nell’aterosclerosi. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr / cvy007
PubMed Abstract / CrossRef Full Text / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Doesch AO, Katus HA, et al. Le due facce dell’interleuchina-17A nell’aterosclerosi. Bersagli Curr droga. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstract / CrossRef Testo completo / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Il fattore di crescita insulino-simile-1 e il TNF-alfa regolano l’autofagia attraverso la chinasi N-terminale c-jun e le vie Akt nelle cellule lisce vascolari aterosclerotiche umane. Biol delle cellule di Immunol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006.01454.x
PubMed Abstract / CrossRef Testo completo / Google Scholar
16. Grabner R, Lotzer K, Doping S, Hildner M, Radke D, Birra M, et al. La segnalazione del recettore beta della linfotossina promuove l’organogenesi linfoide terziaria nell’avventizia dell’aorta di topi ApoE−/− invecchiati. J Scad Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Testo completo / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Maggiore espressione delle chemochine omeostatiche CCL19 e CCL21 nell’aterosclerosi clinica e sperimentale: possibile ruolo patogeno nella destabilizzazione della placca. Arterioscler Thrombb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Abstract | CrossRef Testo completo / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Aumento dei livelli della chemochina omeostatica CXCL13 nell’aterosclerosi umana-potenziale ruolo nella stabilizzazione della placca. Aterosclerosi. (2012) 224:266–73. doi: 10.1016 / j.aterosclerosi.2012.06.071
CrossRef Testo completo / Google Scholar
22. Hikashi Y, Sukhanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. La carenza del recettore del fattore di crescita insulino-simile-1 nei macrofagi accelera l’aterosclerosi e induce un fenotipo di placca instabile nei topi apolipoproteina E-carenti. Circolazione. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstract | CrossRef Testo completo / Google Scholar
23. Alessandro SIGNOR, Owens GK. Controllo epigenetico della differenziazione delle cellule muscolari lisce e della commutazione fenotipica nello sviluppo vascolare e nella malattia. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstract / CrossRef Testo completo / Google Scholar
24. I nostri servizi sono sempre a vostra disposizione. La segnalazione PDGFRbeta regola l’infiammazione locale e sinergizza con l’ipercolesterolemia per promuovere l’aterosclerosi. Nat Commun. (2015) 6:7770. doi: 10.1038 | ncomms8770
PubMed Abstract / CrossRef Testo completo / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Il targeting dell’interleuchina-1beta protegge dagli aneurismi aortici indotti dalla segnalazione beta del fattore di crescita trasformante interrotto. Immunit. (2017) 47:959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Testo completo / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Gli organi linfoidi terziari dell’arteria controllano l’immunità dell’aorta e proteggono dall’aterosclerosi attraverso i recettori beta della linfotossina delle cellule muscolari lisce vascolari. Immunit. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Abstract / CrossRef Testo completo / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. NLRP3 inflammasome espressione e attivazione in aterosclerosi umana. J Am Cuore Assoc. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Testo completo / Google Scholar
30. il suo nome deriva dal greco antico, che significa “la parola di Dio”. Attitudine protettiva di annexin A1 nella formazione neointima arteriosa nei topi inclini all’aterosclerosi-breve rapporto. Arterioscler Thrombb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Testo completo / Google Scholar
32. i nostri servizi sono a vostra disposizione per ogni esigenza. La guida neuroimmune cue netrin-1 promuove l’aterosclerosi inibendo l’emigrazione dei macrofagi dalle placche. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Testo completo / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Senescenza cellulare e fenotipo secretorio senescente: opportunità terapeutiche. J Clin Investire. (2013) 123:966–72. doi: 10.1172 | JCI64098
PubMed Abstract / CrossRef Full Text / Google Scholar
37. Majesky MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Le cellule muscolari lisce differenziate generano una sottopopolazione di cellule progenitrici vascolari residenti nell’avventizia regolata da Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstract | CrossRef Testo completo / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Classificazione degli organi linfoidi terziari avventiziali nell’aterosclerosi umana. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j.carpath.2017.08.002
PubMed Abstract | CrossRef Testo completo / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. La lamina adventitia è il principale sito di accumulo di cellule immunitarie nei topi standard con carenza di apolipoproteina E alimentati con chow. Arterioscler Thrombb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
PubMed Abstract / CrossRef Testo completo / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Gli organi linfoidi terziari dell’arteria contribuiscono alle risposte immunitarie innate e adattive nell’aterosclerosi avanzata del topo. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstract | CrossRef Testo completo / Google Scholar
43. Buettner M, Lochner M. Sviluppo e funzione degli organi linfoidi secondari e terziari nell’intestino tenue e nel colon. Immunol anteriore. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstract | CrossRef Testo completo / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Gli organi linfoidi terziari dell’arteria controllano le risposte delle cellule B dell’aterosclerosi territorializzata multistrato nei topi ApoE–/– invecchiati. Arterioscler Thrombb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Testo completo / Google Scholar
48. van de Pavert SA, Mebius RE. Nuove intuizioni sullo sviluppo dei tessuti linfoidi. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Testo completo / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Fibroblasti stromali in strutture linfoidi terziarie: un nuovo bersaglio nell’infiammazione cronica. Immunol anteriore. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstract | CrossRef Testo completo / Google Scholar
51. E ‘ una delle più importanti aziende italiane nel campo della comunicazione e della comunicazione. Ripristino dell’integrità dell’organo linfoide attraverso l’interazione di cellule tessuto-induttori linfoidi con stroma della zona delle cellule T. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstract / CrossRef Testo completo / Google Scholar
52. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar