Background
L’encefalopatia di Hashimoto (HE) è una rara sindrome neuropsichiatrica associata agli anticorpi tiroidei ed è stata riportata per la prima volta da Brain nel 1996 (Brain et al., 1966). Presenta una vasta gamma di sintomi clinici, tra cui manifestazioni neurologiche come episodi simili a ictus, convulsioni, confusione, mioclono, atassia, tremori e demenza, nonché manifestazioni psichiatriche, tra cui psicosi acuta, disturbi depressivi, cambiamenti di personalità, allucinazioni e schizofrenia (Kirshner, 2014; Menon et al., 2017). In questo caso, descriviamo un paziente con LUI i cui sintomi clinici e risultati dei test di laboratorio hanno imitato l’encefalite virale.
Case Report
Un uomo di 59 anni che presentava febbre, mal di testa e discorsi imbarazzanti che si manifestavano specificamente come discorsi lenti e poco chiari, è stato ricoverato in ospedale. Ha negato infezioni recenti come influenza o gastroenterite, viaggi e altre possibili ragioni, che potrebbero essere responsabili della febbre, che ha raggiunto il picco a 39,5°C. La precedente storia medica ha rivelato la gotta per 20 anni, ma non sono stati prescritti farmaci. Il suo esame neurologico e la tomografia computerizzata cranica (CT) e la risonanza magnetica (MRI) (Figura 1) erano normali. I risultati dell’EEG hanno mostrato piccole irregolarità nelle onde (5-20 µv 14-20 Hz β) emesse dagli emisferi bilaterali. La routine del sangue, la proteina C-reattiva, la vitamina B12 del siero e l’acido folico, così come altri produttori di autoimmunità contenenti anticorpi antinucleari (ANA), anticorpi citoplasmatici anti-neutrofili (ANCA) e fattori reumatoidi erano tutti insignificanti. Il liquido cerebrospinale (CSF) ha mostrato un aumento del numero di globuli bianchi (WBC) (104 × 106/L, intervallo di riferimento 0-8 × 10^6/L) e livelli elevati di proteine (1,68 g/L, intervallo di riferimento 0,15–0,45 g/L). La coltura, lo striscio e gli anticorpi batterici, fungini, virali e tubercolari del bacillo nel siero e nel liquido cerebrospinale erano negativi. Gli è stata diagnosticata un’encefalite virale e trattata con agenti antivirali. I suoi sintomi si attenuarono in una settimana e fu dimesso dall’ospedale. Cinque mesi più tardi, è stato rinviato al nostro ospedale di nuovo a causa di una febbre di 38,5°C e confusione frase occasionale. È stata eseguita un’altra puntura lombare; il CSF aveva un conteggio WBC di 39 × 10^6/L e il contenuto proteico era di 1,32 g/L. I risultati della risonanza magnetica cranica e dei test di laboratorio sono stati quasi normali, ad eccezione della diminuzione della funzionalità tiroidea e dell’aumento dei livelli di autoanticorpo anti-tiroideo (ATA) nel siero e nel liquido cerebrospinale. I primi risultati sono stati i seguenti: il siero, l’ormone stimolante la tiroide (TSH) concentrazione era 43.39 uIU/ml (range di riferimento (RR): 0.27–4.2 uIU/ml), triiodotironina libera (FT3) concentrazione è 2,89 pmol/ml (RR: 3.1–6.8 pmol/ml), tiroxina libera (FT4) concentrazione era 7.18 pmol/ml (RR: 12.0–22.0 pmol/ml), totale triiodotironina (TT3) la concentrazione è pari a 1,17 pmol/ml (RR: 1.3–3.1 pmol/ml), and total thyroxine (TT4) concentration was 44.26 pmol/ml (RR: 66–181 pmol/ml); the titer of anti-thyroglobulin autoantibodies (TgAb) was 1274 IU/ml (RR: < 115 IU/ml) and the titer of anti-thyroperoxidase autoantibodies (TPOAb) was 600 IU/ml (RR: < 35 IU/ml). In the CSF, ATA was positive (TPOAb 17.06 IU/ml, TgAb 16.02 IU/ml). Ultrasound imaging indicated diffuse lesions of the thyroid. Analisi anticorpale di anti-NMDAR, AMPA1, AMPA2, LGI1, CASPR2, GABA, GAD, anti-Hu, Yo, Ri, MAI, MA2, CV2, Amphiphysin, SOX-1, Tr, Zic4, e GAD65, erano tutti negativi sia nel siero e CSF. Il paziente è stato infine diagnosticato con LUI, tiroidite di Hashimoto e ipotiroidismo e prescritto metilprednisolone e Euthyrox. Il metilprednisolone è stato iniziato alla dose di 80 mg/die per 1 settimana e ridotto a 40 mg/die nella settimana 2; successivamente, è stato prescritto prednisolone orale, che è stato svezzato ad una velocità di 5 mg a settimana, cioè prednisolone orale è stato utilizzato per un totale di 8 settimane. I suoi sintomi sono stati alleviati in 3 giorni. Il paziente è rimasto sano durante un periodo di follow-up di 1 anno.
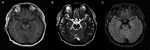
Figura 1. Risonanza magnetica del cervello. Non ci sono risultati anormali nella risonanza magnetica cerebrale del paziente. (A) Immagine ponderata T1; (B) Immagine ponderata T2; (C) Immagine FLAIR.
Discussione
Il tasso di prevalenza stimato di HE è 2,1 su 100.000 e il rapporto di sesso (femmina a maschio) è 4:1 (Ferracci et al., 2004). Il corso di LUI può essere progressivo, recidivante-remittente o addirittura autolimitante. Nel caso in esame, il paziente sembrava avere un decorso recidivante-remittente.
In combinazione con i sintomi del paziente, i normali risultati della risonanza magnetica, gli alti titoli di ATA nel siero e la positività ATA del CSF, il paziente è stato finalmente diagnosticato con HE dopo aver escluso altre potenziali cause tra cui ictus, tumore, infezione del sistema nervoso centrale, encefalite autoimmune e sindrome paraneoplastica.
Nel complesso, la fisiopatologia di HE è ancora inconcludente. Sulla base dei risultati neuropatologici, è stato proposto un meccanismo di vasculite autoimmune. In uno studio precedente, le biopsie cerebrali hanno rivelato che l’infiltrazione linfocitica intorno alle venule e alle arteriole può essere coinvolta (Duffey et al., 2003). Un altro possibile meccanismo coinvolto è che gli ATAS attaccano gli antigeni condivisi dalla tiroide e dal cervello, e per questo motivo alti titoli di ATAS tra cui TPOAB, TgAb e anticorpi anti-TSH (TSH-R) nel siero, e talvolta nel CSF, sono considerati caratteristiche distintive di HE (Yoneda, 2018). Allo stesso modo, nel nostro caso sono stati trovati titoli elevati di ATA e CSF-ATA. In uno studio precedente, la terapia di scambio plasmatico ha portato ad un profondo miglioramento dei sintomi dei pazienti (Tran et al., 2018). Insieme, questi risultati suggeriscono che ATA svolge un ruolo importante in HE. Tuttavia, elevati livelli di ATA nel siero si trovano anche all’interno della popolazione generale e sono particolarmente comuni negli individui anziani. Inoltre, l’entità dell’elevazione ATA non è correlata alla gravità di HE. Sebbene i livelli sierici di ATA dei pazienti siano rimasti elevati dopo la terapia con metilprednisolone, i suoi sintomi sono stati risolti (titolo di autoanticorpi anti-tireoglobulina (TgAb) : 041 UI / ml, RR: < 115 UI/ml; titolo di autoanticorpi anti-tireoperossidasi (TPOA) : 600 UI / ml, RR: < 35 UI / ml). I nostri risultati confermano che non esiste alcuna relazione tra l’entità dell’elevazione ATA e la gravità dell’HE.
Sebbene la correlazione tra ATA e HE non sia ancora chiara (Kirshner, 2014), i criteri diagnostici per LUI sono stati proposti da un team di esperti in Neurologia di Lancet nel 2016. I criteri sono i seguenti: (1) encefalopatia con convulsioni, mioclono, allucinazioni o episodi simili a ictus; (2) malattia subclinica o lieve della tiroide (di solito ipotiroidismo); (3) risultati normali o anomalie non specifiche mostrate dalla risonanza magnetica cerebrale; (4) presenza di anticorpi tiroidei nel siero (perossidasi tiroidea, tireoglobulina); (5) assenza di anticorpi neuronali ben caratterizzati nel siero e nel liquido cerebrospinale; e (6) ragionevole esclusione di cause alternative. Può essere diagnosticato se un paziente soddisfa tutti i criteri (Graus et al., 2016). Il nostro paziente ha soddisfatto tutti i criteri di cui sopra e potrebbe quindi essere diagnosticato con LUI. La maggior parte dei pazienti con LUI risponde bene agli steroidi; tuttavia, quando i pazienti sono resistenti agli steroidi, altre terapie di immunosoppressione tra cui scambio plasmatico, IVIg, metotressato e micofenolato hanno dimostrato di essere efficaci. Alte dosi di metilprednisolone (500-1000 mg) sono più frequentemente utilizzate. Poiché il paziente ha mostrato sintomi lievi e rifiuto l’uso di alte dosi di metilprednisolone, abbiamo prescritto una bassa dose di metilprednisolone. Il nostro paziente è stato sottoposto a terapia steroidea e da allora è rimasto sano. Il paziente non ha ricevuto altri trattamenti di immunoterapia durante il follow-up. In uno studio osservazionale retrospettivo eseguito da Mamoudjy et al. (2013) i risultati della ricerca hanno indicato che alcuni pazienti HE hanno subito una ricaduta, anche un terzo attacco, che ha avuto un intervallo di tempo più breve (media 18 giorni) rispetto a quello del secondo attacco (media 213 giorni). I pazienti con recidive avevano bisogno di metilprednisolone o terapia immunosoppressiva di nuovo (Mamoudjy et al., 2013). Il nostro paziente ha subito una ricaduta circa 150 giorni dopo il primo attacco e la terapia steroidea è stata efficace. Anche le sequele, come mal di testa, disturbi della memoria e così via, erano frequenti (Mamoudjy et al., 2013), tuttavia, il nostro paziente non ha avuto alcuna sequele sinistra per fortuna.
L’encefalopatia di Hashimoto è difficile da diagnosticare con precisione, a causa della sua associazione con una vasta gamma di sintomi clinici, nonché della sua presentazione neuroimaging ed elettroencefalogramma non specifici. Un precedente articolo riportava un caso di HE che inizialmente era stato erroneamente diagnosticato come encefalite virale (He et al., 2013), in cui il paziente presentava una funzione cognitiva progressivamente compromessa e convulsioni incontrollate senza febbre. Nel nostro caso, l’aumento della conta WBC e della proteina CSF combinata con febbre e mal di testa ci portano a diagnosticarlo come encefalite virale. La febbre è stata descritta in diversi pazienti con HE con e senza disturbi della tiroide (Huang et al., 2011; Lu et al., 2015). Anche se la ragione per la febbre in LUI non è chiaro, Lu et al. (2015) ha suggerito che potrebbe essere un risultato diretto dell’infiammazione combinata con la vasculite autoimmune.
L’encefalopatia di Hashimoto può manifestarsi in molti modi diversi, tra cui episodi simili a ictus, convulsioni, confusione, mioclono, psicosi acuta, disturbi depressivi e allucinazioni, causando la SUA confusione con altre malattie. Uwatoko et al. (2018) ha riportato un caso di un paziente che ha presentato parkinsonismo e una lesione simile a un tumore rivelata dalla risonanza magnetica cerebrale. Dopo la biopsia, si è constatato che la lesione non era un tumore, ed è stato finalmente confermato (Uwatoko et al., 2018). I pazienti con HE possono anche presentare sintomi insoliti come paralisi pseudobulbare, polineuropatia sensomotoria, sintomi catatonici, vertigini, debolezza muscolare, corea, opsoclono e cefalea di tipo nevralgia del trigemino, tra gli altri (Beckmann et al., 2011; Salazar et al., 2012; Sharan et al., 2015; Ueno et al., 2016; Karthik et al., 2017; Emeksiz et al., 2018; Oz Tuncer et al., 2018). La demenza rapidamente progressiva, come manifestazione comune di HE, rende necessario distinguere HE da altre malattie causate da fattori vascolari, infettivi, tossico-metabolici e autoimmuni, metastasi / neoplasia, errori iatrogeni / congeniti del metabolismo, malattie neurodegenerative e malattie sistemiche / convulsioni (Paterson et al., 2012).
Conclusione
In conclusione, la diagnosi di HE è piuttosto complessa ma preziosa a causa della sua drammatica risposta alla terapia immunosoppressiva. Quando i medici devono affrontare encefalite inspiegabile, la funzione tiroidea e i livelli di ATA devono essere considerati test convenzionali. Può essere escluso come diagnosi per i pazienti con livelli sierici normali di ATA. Per i pazienti con aumento dei livelli di ATA, dovrebbe essere considerato dopo aver escluso altre possibili malattie.
Dichiarazione di disponibilità dei dati
I set di dati generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Dichiarazione etica
Gli studi che hanno coinvolto partecipanti umani sono stati esaminati e approvati dal Comitato etico del Primo ospedale dell’Università di Jilin, in Cina. I pazienti / partecipanti hanno fornito il loro consenso informato scritto a partecipare a questo studio. Il consenso informato scritto è stato ottenuto dai singoli individui per la pubblicazione di immagini o dati potenzialmente identificabili inclusi in questo articolo.
Contributi dell’autore
HM ha contribuito alla concezione e alla progettazione del manoscritto. IL mio ha scritto la prima bozza del manoscritto. YY, XM, YX e NS hanno scritto sezioni del manoscritto. Tutti gli autori hanno contribuito alla revisione del manoscritto, hanno letto e approvato la versione presentata.
Finanziamento
Questo lavoro è stato supportato dal programma nazionale Key R& D della Cina (No. 2017YFC0110304).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Beckmann, Y. Y., Top, D., e Yigit, T. (2011). Presentazioni insolite dell’encefalopatia di Hashimoto: trigeminal neuralgiaforma mal di testa, deviazione obliqua, ipomania. Endocrino 40, 495-496. doi: 10.1007 / s12020-011-9506-x
PubMed Abstract / CrossRef Testo completo / Google Scholar
Brain, L., Jellinek, E. H., e Ball, K. (1966). Malattia di Hashimoto ed encefalopatia. Lancetta 2, 512-514.
Google Scholar
Nel 2003 è stato pubblicato il primo album in studio della band. Encefalopatia di Hashimoto: risultati post mortem dopo stato fatale epilettico. Neurologia 61, 1124-1126.
PubMed Abstract / Google Scholar
Emeksiz, S., Kutlu, N. O., Alacakir, N., e Caksen, H. (2018). Un caso di encefalopatia di Hashimoto resistente agli steroidi che si presenta con polineuropatia sensomotoria. Turco. J. Pediatr. 60, 310–314. doi: 10.24953 / turkjped.2018.03.012
PubMed Abstract | CrossRef Testo completo / Google Scholar
Ferracci, F., Bertiato, G., e Moretto, G. (2004). Encefalopatia di Hashimoto: dati epidemiologici e considerazioni patogenetiche. J. Neurol. Sic. 217, 165–168.
PubMed Abstract / Google Scholar
Graus, F., Titulaer, M. J., Balu, R., Benseler, S., Bien, C. G., Cellucci, T., et al. (2016). Un approccio clinico alla diagnosi di encefalite autoimmune. Lancet Neurol. 15, 391–404.
Google Scholar
Nel 2013 è stato pubblicato il primo album in studio della cantante. Un caso di encefalopatia di Hashimoto mal diagnosticata come encefalite virale. Essere. J. Caso Rep. 14, 366-369.
Google Scholar
Huang, W., Xia, C., e Chatham, M. (2011). Malattia infettiva o encefalopatia di Hashimoto flares:un caso clinico. Sequestro 20, 717-719. doi: 10.1016 / j.sequestro.2011.04.011
PubMed Abstract | CrossRef Testo completo / Google Scholar
Karthik, MS, Nandhini, K., Subashini, V. e Balakrishnan, R. (2017). Encefalopatia di Hashimoto che si presenta con disturbi comportamentali insoliti in una ragazza adolescente. Caso Rep. Med. 2017, 3494310. doi: 10.1155/2017/3494310
PubMed Abstract / CrossRef Testo completo / Google Scholar
Kirshner, S. S. (2014). Encefalopatia di Hashimoto: una breve recensione. Curr. Neurolo. Neurosci. Rep. 14: 476.
Google Scholar
Lu, T., Zhou, Z., Wu, A., Qin, B., e Lu, Z. (2015). Encefalopatia febbrile di Hashimoto associata a Hashitoxicosi. Acta Neurol. Belg. 115, 811–813.
Google Scholar
Mamoudjy, N., Korff, C., Maurey, H., Blanchard, G., Steshenko, D., Loiseau-Corvez, M. N., et al. (2013). Encefalopatia di Hashimoto: identificazione ed esito a lungo termine nei bambini. EUR. J. Paediatr. Neurolo. 17, 280–287. doi: 10.1016 / j. ejpn.2012.11.003
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2017 si trasferisce a New York. Presentazioni psichiatriche che annunciano l’encefalopatia di Hashimoto: una revisione sistematica e un’analisi dei casi riportati in letteratura. J. Neurosci. Rurale. Pratt. 8, 261–267. doi: 10.4103 / jnrp.jnrp_440_16
PubMed Abstract | CrossRef Full Text / Google Scholar
Oz Tuncer, G., Teber, S., Kutluk, MG, Albayrak, P., e Deda, G. (2018). L’encefalopatia di Hashimoto si presenta come paralisi pseudobulbare. Childs Nerv. Syst. 34, 1251–1254. doi: 10.1007 / s00381-018-3720-2
PubMed Abstract / CrossRef Testo completo / Google Scholar
Nel 2012 è stato pubblicato il primo album in studio della band. Diagnosi e trattamento delle demenze rapidamente progressive. Neurol Clin. Pratt. 2, 187–200.
PubMed Abstract / Google Scholar
Nel 2012 è stato pubblicato il primo album in studio della cantante. Opsoclono come manifestazione dell’encefalopatia di Hashimoto. J. Clin. Neurosci. 19, 1465–1466. doi: 10.1016 / j. jocn.2012.02.012
PubMed Abstract / CrossRef Testo completo / Google Scholar
Sharan, A., Sengupta, S., Mukhopadhyay, S., e Ghosh, B. (2015). L’encefalopatia di Hashimoto che si presenta con la Corea. J. Assoc. Medici India 63, 83-84.
PubMed Abstract / Google Scholar
Tran, M. H., Mkhikian, H., Sy, M., Perez-Alvarez, I., e Demetriou, M. (2018). Scambio plasmatico a lungo termine come terapia di mantenimento per l’encefalopatia di Hashimoto di tipo cerebellare, un caso clinico. Trasfus. Apher. Sic. 57, 418–420. doi: 10.1016 / j.transci.2018.05.027
PubMed Abstract | CrossRef Testo completo / Google Scholar
Ueno, H., Nishizato, C., Shimazu, T., Watanabe, H., Mizukami, T., Kosuge, H., et al. (2016). Encefalopatia di Hashimoto che si presenta con vertigini e debolezza muscolare in un paziente pediatrico maschio. No Hattatsu 48, 45-47.
PubMed Abstract / Google Scholar
Uwatoko, H., Yabe, I., Sato, S., Abe, M., Shirai, S., Takahashi, I., et al. (2018). L’encefalopatia di Hashimoto che imita un tumore al cervello e le sue scoperte patologiche: un caso clinico. J. Neurol. Sic. 394, 141–143. doi: 10.1016 / j.jns.2018.09.008
PubMed Abstract | CrossRef Testo completo / Google Scholar
Yoneda, M. (2018). Encefalopatia di Hashimoto e autoanticorpi. Nervo cerebrale 70, 305-314. doi: 10.11477 / mf.1416201004
PubMed Abstract / CrossRef Full Text / Google Scholar