26 ottobre 2020, dallo staff NCI
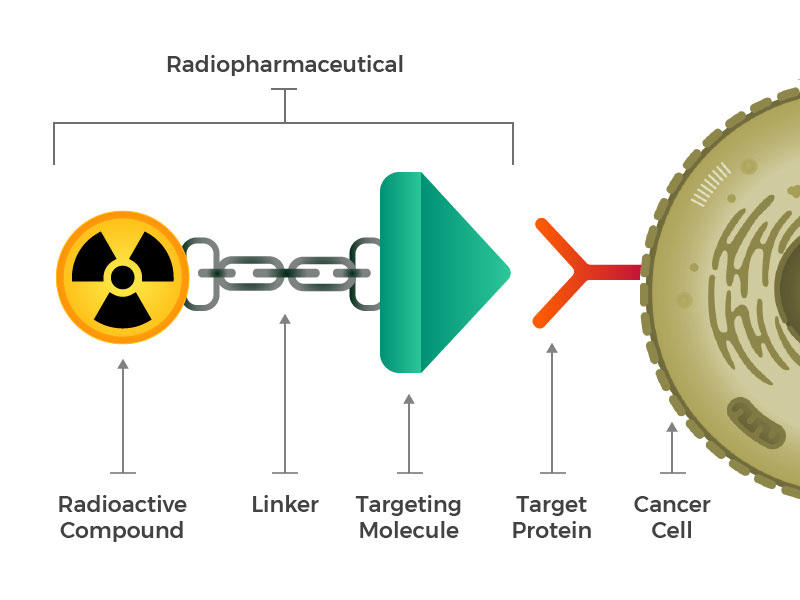
I radiofarmaci sono costituiti da una molecola radioattiva, una molecola di targeting e un linker che unisce i due.
Gli ultimi due decenni hanno portato un cambiamento epocale nel modo in cui molti tipi di cancro sono trattati. Terapie mirate arrestare proteine specifiche nelle cellule tumorali che li aiutano a crescere, dividere, e la diffusione. Le immunoterapie stimolano o sopprimono il sistema immunitario del corpo per aiutare a combattere il cancro. Ma i trattamenti a lungo utilizzati-chirurgia, chemioterapia e radioterapia — rimangono la spina dorsale del trattamento per la maggior parte dei tumori.
La radioterapia è stata utilizzata per il trattamento del cancro più di 100 anni fa. Circa la metà di tutti i pazienti oncologici lo riceve ancora ad un certo punto durante il trattamento. E fino a poco tempo fa, la maggior parte della radioterapia veniva somministrata come 100 anni fa, erogando fasci di radiazioni dall’esterno del corpo per uccidere i tumori all’interno del corpo.
Sebbene efficace, le radiazioni esterne possono anche causare danni collaterali. Anche con moderne apparecchiature di radioterapia, “devi tessuto normale per arrivare a un tumore”, ha detto Charles Kunos, MD, Ph. D., del programma di valutazione della terapia del cancro di NCI (CTEP). Gli effetti collaterali risultanti della radioterapia dipendono dall’area del corpo trattata, ma possono includere perdita di gusto, cambiamenti della pelle, perdita di capelli, diarrea e problemi sessuali.
Ora, i ricercatori stanno sviluppando una nuova classe di farmaci chiamati radiofarmaci, che forniscono la radioterapia direttamente e specificamente alle cellule tumorali. Gli ultimi anni hanno visto un’esplosione di ricerca e studi clinici che testano nuovi radiofarmaci.
Questi studi hanno suggerito che la radioterapia mirata a livello cellulare ha il potenziale per ridurre il rischio di effetti collaterali sia a breve che a lungo termine del trattamento, consentendo allo stesso tempo di uccidere anche piccoli depositi di cellule tumorali in tutto il corpo.
“Penso che trasformeranno l’oncologia da radiazioni nei prossimi 10-15 anni”, ha detto il dottor Kunos.
Costruire su un’affinità naturale
Fornire radiazioni direttamente alle cellule non è di per sé un nuovo approccio. Una di queste terapie, chiamata iodio radioattivo, è stata usata per trattare alcuni tipi di cancro alla tiroide dal 1940. Lo iodio si accumula naturalmente nelle cellule tiroidee. Una versione radioattiva dell’elemento può essere prodotta in laboratorio. Quando ingerito (come una pillola o un liquido), si accumula e uccide le cellule tumorali rimaste dopo l’intervento chirurgico alla tiroide.
Una simile affinità naturale è stata successivamente sfruttata per sviluppare farmaci per trattare il cancro che si è diffuso alle ossa, come il dicloruro di radio 223 (Xofigo), che è stato approvato nel 2013 per trattare il cancro alla prostata metastatico. Quando le cellule tumorali crescono nell’osso, causano la rottura del tessuto osseo che invadono. Il corpo tenta quindi di riparare questo danno sostituendo quell’osso-un processo chiamato turnover osseo.
L’elemento radioattivo radio “sembra una molecola di calcio, quindi viene incorporato in aree del corpo in cui il turnover osseo è più alto”, come le aree in cui il cancro sta crescendo, ha spiegato il dottor Kunos. Il radio è quindi in grado di uccidere le cellule tumorali vicine.
Questi composti radioattivi viaggiano tutti verso le cellule tumorali senza alcun aiuto. I ricercatori si sono chiesti se sarebbe possibile progettare nuove molecole radioattive che mirano specificamente ad altri tumori.
Hanno immaginato radiofarmaci ingegnerizzati che consistono in tre elementi costitutivi principali: una molecola radioattiva, una molecola di targeting (che riconosce e si blocca specificamente sulle cellule tumorali) e un linker che unisce i due. Tali composti potrebbero essere iniettati, infusi, inalati o ingeriti e quindi farsi strada nel flusso sanguigno.
L’idea di collegare una molecola che mira al cancro con una molecola che uccide le cellule tumorali non è nuova. Ad esempio, diversi farmaci chiamati coniugati anticorpo–farmaco, in cui un anticorpo che si lega a specifiche cellule tumorali è collegato a un farmaco tossico, sono stati approvati per il trattamento del cancro.
Ma gli sforzi per creare tali farmaci hanno avuto un successo limitato, ha spiegato il dottor Kunos, perché non è sufficiente che le tossine vengano portate vicino a una cellula tumorale. Le tossine devono essere prese all’interno e rimanere all’interno delle cellule abbastanza a lungo da causare danni. Molte cellule tumorali hanno o sviluppano meccanismi per pompare semplicemente le tossine prima che ciò possa accadere.
I radiofarmaci funzionano meglio anche quando i farmaci possono entrare nelle cellule. Ma questo non è necessario per loro di essere efficace. Una volta che un radiofarmaco si è attaccato a una cellula cancerosa, il composto radioattivo si rompe naturalmente. Questo decadimento rilascia energia che danneggia il DNA delle cellule vicine. E quando il DNA di una cellula viene irrimediabilmente danneggiato, quella cellula muore. Le cellule tumorali sono particolarmente sensibili ai danni del DNA indotti dalle radiazioni.
A seconda del tipo di composto radioattivo utilizzato, l’energia risultante può penetrare nella cellula legata al radiofarmaco e circa 10-30 cellule che circondano quella cellula. Ciò aumenta il numero di cellule tumorali che possono essere uccise con una singola molecola radiofarmaceutica.
A metà degli anni 2010, la Food and Drug Administration (FDA) aveva approvato due radiofarmaci che mirano a molecole su alcune cellule B per trattare alcune persone con linfoma non-Hodgkin, un tipo di cancro del sangue. Ma questi farmaci non sono mai stati ampiamente adottati. Pochi medici che trattano pazienti con linfoma sono stati addestrati a somministrare questi tipi di composti radioattivi. E i radiofarmaci hanno affrontato la concorrenza di nuovi farmaci nonradioattivi.
Il game-changer per il campo è venuto in 2018, ha detto Jacek Capala, Ph. D., del programma di ricerca sulle radiazioni di NCI, quando la FDA ha approvato lutezium Lu 177-dotatate (Lutathera) per il trattamento di alcuni tumori neuroendocrini cancerosi (RETI) che colpiscono il tratto digestivo.
“Questo ha dimostrato che i tumori solidi possono anche essere mirati in questo modo”, con un radiofarmaco costruito da zero, ha detto. In questo caso, gli obiettivi sono determinati recettori ormonali trovati in abbondanza sulla superficie delle cellule NETTE.
Lutezio Lu 177-dotatate era meglio a rallentare la crescita netta di qualsiasi precedente farmaco testato, ha spiegato Aman Chauhan, MD, dell’Università del Kentucky, che sta conducendo diversi nuovi studi clinici del farmaco. “Questo è stato un enorme passo avanti per il nostro campo”, ha detto.
Adattare i farmaci dai composti di imaging
I ricercatori stanno ora progettando e testando radiofarmaci per una gamma di tumori diversi come il melanoma, il cancro del polmone, il cancro del colon-retto e la leucemia, ha detto il dott. Qualsiasi tumore che abbia una molecola targetable sulla superficie delle sue cellule e un buon apporto di sangue—sufficiente per fornire farmaci—potrebbe potenzialmente essere trattato con radiofarmaci, ha aggiunto il dottor Chauhan.
Molti di questi farmaci più recenti sono versioni re-ingegnerizzate di composti esistenti utilizzati per l’imaging nucleare. I test di imaging nucleare, come la tomografia ad emissione di positroni (PET), a volte utilizzano composti debolmente radioattivi legati a molecole che si legano a bersagli specifici sulla superficie delle cellule tumorali. Telecamere specializzate possono quindi rivelare anche piccoli depositi di cellule tumorali, contribuendo a misurare la diffusione del cancro attraverso il corpo.
I ricercatori hanno ora riproposto queste molecole di targeting per trasportare composti radioattivi più potenti, o isotopi, invece-quelli che potrebbero uccidere le cellule tumorali invece di semplicemente aiutare a visualizzarle.
Il cancro alla prostata è stato un primo banco di prova per questo riutilizzo. Una proteina chiamata PSMA si trova in grandi quantità-e quasi esclusivamente-sulle cellule della prostata. Fondendo una molecola che si lega alla PSMA con un composto radioattivo utilizzato nell’imaging a scansione PET, gli scienziati sono stati in grado di visualizzare piccoli depositi di cancro alla prostata che sono troppo piccoli per essere rilevati dall’imaging convenzionale.
Diversi trattamenti radiofarmaceutici mirati alla PSMA vengono ora testati in studi clinici.
La maggior parte dei tumori della prostata sono molto sensibili alle radiazioni e le radiazioni esterne sono comunemente usate per trattare la malattia, ha spiegato Frank Lin, MD, del Centro per la ricerca sul cancro dell’NCI, che sta conducendo uno studio clinico di un radiofarmaco mirato alla PSMA presso il NIH Clinical Center.
La maggior parte degli uomini che ricevono radiazioni come trattamento iniziale non sperimenteranno una recidiva del loro cancro. Ma se lo fanno, a volte si diffonde in tutto il corpo, con molti piccoli depositi di cellule tumorali in molti organi, ha spiegato.
“Quando il tumore si è diffuso in questo modo, non puoi più fare radiazioni a raggi esterni, perché le radiazioni esterne possono essere concentrate e trattare solo una piccola parte del tuo corpo alla volta”, ha detto il dottor Lin.
Avere un radiofarmaco che prende di mira la PSMA è un modo migliore per dare radiazioni in questi casi, perché può essere infuso direttamente nel flusso sanguigno e circolare ampiamente, attaccandosi alle cellule tumorali della prostata che si sono diffuse in tutto il corpo, ha spiegato.
E un grande vantaggio di avere molecole di imaging e trattamento che utilizzano lo stesso obiettivo è che l’imaging può quindi dare ai medici un’anteprima del fatto che il trattamento possa funzionare, ha aggiunto il Dr. Lin.
Ad esempio, nello studio del Dr. Lin, gli uomini devono avere una scansione PET con la versione di imaging del composto prima del trattamento. Se il composto di imaging trova la sua strada verso le cellule tumorali e viene rilevato sulla scansione PET, allora i ricercatori possono supporre che il trattamento radiofarmaco corrispondente colpirà il suo bersaglio.
“Questo sviluppo complementare della diagnostica mano nella mano con le terapie farmacologiche rende questo campo molto più eccitante”, ha affermato il dott. “In questo modo possiamo sapere che stiamo consegnando la terapia direttamente alle cellule tumorali.”
Passare alle terapie combinate
Mentre i radiofarmaci hanno mostrato promesse nei primi studi, sono anche, come nel caso di altri tipi di farmaci antitumorali, improbabile che spazzino via un tumore da soli.
Ad esempio, lutezio Lu 177-dotatate ha più che raddoppiato il numero di persone che avevano i loro tumori neuroendocrini si restringono dopo il trattamento, ma quel numero era ancora modesto: circa il 17%, rispetto al 7% senza il farmaco, ha spiegato il dottor Chauhan.
“C’è ancora un significativo margine di miglioramento”, ha affermato.
L’uso di radiofarmaci in combinazione con altre terapie può essere un modo per guidare tale miglioramento. Alcuni ricercatori stanno ora testando radiofarmaci combinati con sensibilizzatori alle radiazioni—farmaci che rendono le cellule tumorali ancora più vulnerabili alle radiazioni. Ad esempio, il Dr. Chauhan sta conducendo uno studio clinico di lutezio Lu 177-dotatato combinato con un sensibilizzatore di radiazioni chiamato triapina, che blocca le cellule dalla produzione dei composti necessari per la riparazione del DNA dopo danni indotti dalle radiazioni.
In un altro studio, il Dr. Lin sta testando lutezium Lu 177-dotatate con un tipo di farmaco chiamato inibitore PARP. Questi farmaci, che sono già approvati per il trattamento di alcuni tipi di seno, ovarico e altri tumori, bloccano il processo di riparazione del DNA stesso. “Quindi la radiazione causerebbe il danno al DNA e l’inibitore PARP impedirebbe alle cellule tumorali di guarire il loro DNA dopo la radiazione”, ha spiegato.
Altri ricercatori stanno combinando radiofarmaci con immunoterapie per cercare di aumentare l’efficacia di questi farmaci. “Studi recenti hanno dimostrato che i radiofarmaci possono rendere i tumori più reattivi all’immunoterapia”, ha affermato il dott.
Molti tumori sono tumori “freddi”, ha spiegato, in quanto le cellule immunitarie non li riconoscono o non funzionano correttamente nel microambiente intorno ai tumori, ha spiegato.
Ma quando le radiazioni uccidono le cellule tumorali, le proteine e il DNA di quelle cellule possono riversarsi nel flusso sanguigno per far vedere alle cellule immunitarie, il che può consentire alle cellule immunitarie di riconoscere e uccidere altre cellule tumorali in tutto il corpo. La radioterapia può anche rendere il microambiente tumorale più ospitale per le cellule immunitarie, ha aggiunto il dottor Capala.
Insieme, questi effetti possono trasformare un tumore freddo in un tumore” caldo”: uno che ha un’abbondanza di cellule immunitarie e può essere reattivo ai farmaci immunoterapici. Alcuni studi hanno provato a utilizzare radiazioni esterne per creare questo tipo di risposta.
” Ma ci sono dati che suggeriscono che funziona meglio se ogni tumore, ogni metastasi, è esposto alle radiazioni. Quindi la terapia radiofarmaceutica ha un vantaggio lì, in quanto una volta nel corpo raggiunge tutte le metastasi”, ha spiegato il dottor Capala.
Può anche avere senso combinare radiofarmaci con radiazioni esterne, a patto che un’attenta pianificazione del trattamento possa garantire una dose di radiazioni complessiva sicura, ha aggiunto il Dr. Capala. “La radioterapia esterna è molto brava a colpire tumori di grandi dimensioni, e quindi potresti combinarla con la terapia radiofarmaceutica per indirizzare le metastasi”, ha detto.
Sfide e avvertenze
Il campo dei radiofarmaci è ancora agli inizi. Una sfida che l’approccio dovrà superare prima di poter essere utilizzato più ampiamente è la carenza di medici addestrati a somministrare tali farmaci.
“Il numero di medici di medicina nucleare negli Stati Uniti è piccolo”, ha detto il dottor Lin, che ha una formazione sia in medicina nucleare che in oncologia medica. “E penso che addestriamo solo forse 70 o 80 nuove persone all’anno.”
Finora, questa carenza di forza lavoro ha impedito ai radiofarmaci di vivere fino al loro vero potenziale come trattamento personalizzato, ha spiegato il dottor Capala. Questo potenziale riflette il fatto che, a differenza di altri tipi di farmaci contro il cancro, i medici possono utilizzare l’imaging per misurare esattamente quanto di un radiofarmaco ha raggiunto un tumore, quasi in tempo reale, e regolare la dose di conseguenza.
Ma questo tipo di pianificazione del trattamento richiede competenze multidisciplinari che non sono ampiamente disponibili e ha lasciato le persone che usano radiofarmaci più come “chemioterapia radioattiva”, con una dose unica, ha aggiunto. “Ciò significa che molti pazienti non ricevono un trattamento ottimale”, ha affermato il dottor Capala.
Sono necessari anche studi di sicurezza a lungo termine, ha aggiunto il dottor Chauhan. Le persone trattate con radioterapia esterna possono sperimentare alcuni effetti collaterali, chiamati effetti tardivi—come lo sviluppo di secondi tumori-mesi o anni dopo il trattamento. Sebbene la ricerca fino ad oggi non abbia mostrato un alto tasso di effetti tardivi dal trattamento radiofarmaceutico, “questi sono agenti molto nuovi e dobbiamo continuare ad essere cauti e monitorarli”, ha detto.
Smoothing Collaborations
Poiché questi farmaci sono relativamente nuovi, anche con le sperimentazioni in corso, “stiamo solo grattando la superficie dello sviluppo di farmaci per radiofarmaci”, ha detto il dottor Chauhan.
Nel 2019, per aumentare ulteriormente le sperimentazioni di nuovi radiofarmaci promettenti, NCI ha lanciato la Radiofarmaceutical Development Initiative (RDI) per accelerare i nuovi farmaci promettenti nei test clinici.
Una cosa che NCI spera di ottenere con la RDI è quello di mediare più prove utilizzando combinazioni di farmaci prodotti da diverse aziende farmaceutiche che potrebbero non collaborare altrimenti, ha spiegato il dottor Kunos, che sta guidando l’iniziativa. Le preoccupazioni sulla proprietà intellettuale e la mancanza di fiducia possono fermare tali progetti prima che inizino, ha spiegato il dott.
“Questi tipi di collaborazioni non avverrebbero necessariamente a meno che NCI non fosse il broker onesto nel mezzo”, ha affermato. In questo momento, solo circa il 2% degli studi in fase iniziale supportati da NCI stanno testando radiofarmaci, ma con la RDI questo potrebbe crescere esponenzialmente nei prossimi anni, ha aggiunto.
“Non elimineremo macchine o altre tecniche che usiamo nella radioterapia”, ha detto il dottor Kunos. “Ma con la loro natura mirata, pensiamo che i radiofarmaci trasformeranno il modo in cui usiamo le radiazioni.”