Figura 4: Struttura dell’occhio.Questa immagine è tratta da Chirstie (ref. 4) ed è protetto da copyright in base alla fonte fornita (cioè non è opera degli autori).
La struttura dell’occhio: L’area all’interno dell’occhio (vedi figura 4) che rileva la luce e il colore è chiamata Retina. I due tipi di cellule di rilevamento presenti, bastoncelli e coni, elaborano le informazioni che arrivano attraverso la lente e la inviano lungo il nervo ottico al cervello. Le cellule dell’asta (di cui ci sono circa 100 milioni) rilevano il grado di leggerezza che entra nell’occhio e la loro sensibilità dipende dalla quantità di rodopsina presente che è essa stessa generata all’interno delle cellule. Tuttavia, la rodopsina è distrutta bybleaching sull’esposizione a luce e quindi le cellule di asta funzionano soltanto nell’alta illuminazione del asat della luce bassa il livello ridotto di questo pigmento fotosensibile conduce alla sensibilità avery bassa. Le cellule del cono (di cui ci sono intorno 3 milione) inoltre sono sensibili ai livelli luminosi ma mantengono la loro funzione fino ad alta illuminazione via l’uso del pigmento Iodopsin.Il rilevamento del colore è una funzione dei tre tipi di cellule coniche presenti all’interno della retina: tra loro coprono lo spettro visibile. Questo perché eachtype è sensibile a un diverso intervallo di lunghezze d’onda con maximumscorresponding al rosso (lungo), verde (medio) o blu (corto).
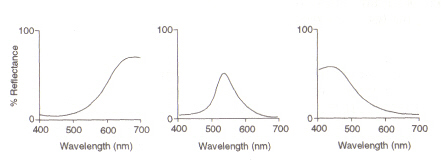
Figura 5: Massimi di (fromleft) rosso, verde e blu cono celle, rispettivamente. Questa immagine è tratta da Chirstie (ref. 4) e il copyright è limitato in base alla fonte fornita (cioè non è opera degli autori).
Il meccanismo di Rhodopsin all’interno delle Rodcells: La rodopsina della proteina contiene il complesso basso del protonatedretinal-Schiff che naturalmente si trova nella tasca inter-membrana formata dai sette trans-membrana a-helicalreceptors. Ci sono molti dischi piatti di rhodopsin all’interno del segmento esterno della cellula di arod che sopra rilevazione leggera subiscono un cambiamento foto-isomerico da Rhodopsin (11-cis) alla retina del tutto-trans. Dopo la cascata di fotoisomerizzazione che avviene tramite 5 intermediati shortlived (diagramma di flusso 1), il trans retinico si diffonde e viene riconvertito in 11-cisretinico prima di rientrare nel ciclo. Questo processo avviene attraverso la riduzione toall-trans retinolo seguita da ossidazione / isomerizzazione al buio. PhotoexcitedRhodopsin (4th dei 5 intermedi) innesca un processo a cascata enzimatica con conseguente idrolisi di GMP. Questo a sua volta chiude i canali specifici per cationi all’interno della membrana cellulare dell’asta che sono naturalmente aperti all’afflusso di Na+al buio e, a causa dell’effetto dell’iperpolarizzazione, il corpo sinatico interno invia un segnale nervoso ad altri neuroni nella retina. Infine, l’abbassamento dei livelli di calcio indotto dalla luce aiuta il recupero dei neuroni eccitati in uno stato passivo, “oscuro”e il ciclo ricomincia al rilevamento della luce. Thephotoreceptors di celle di cono sono anche sette a-helicalreceptors con 11-cis-retinal come loro chromophore. L’intervallo di rilevamento varia dal verde al rosso poiché i tre residui contenenti idrossile non polari vicino al retinale vengono sostituiti sequenzialmente con quelli polari.

Sinistra-Figura 6: Posizione della retina 11-cis all’interno della rodopsina. Questa immagine è tratta da Stryer (ref. 6) e il copyright è limitato in base alla fonte fornita (cioè non è opera degli autori).
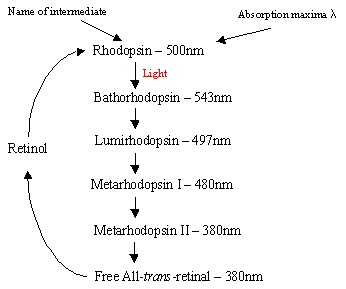
Diritto – Flowchart1: I 5 intermedi del ciclo di rodopsina.
Da dove viene la rodopsina?
gli esseri Umani non possono makeRhodopsin, invece di utilizzare e di origine esterna, b-carotene,che si trova negli alimenti per la sintesi:
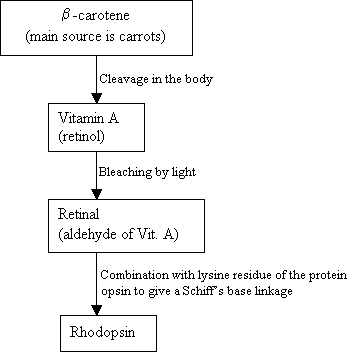 |
Diagramma di flusso 2: Thesynthesis della Rodopsina Nuova immagine =Figura 7: Le strutture di b-carotene (in alto), VitaminA (medio)e l ‘ 11-cis retinale (in basso). |
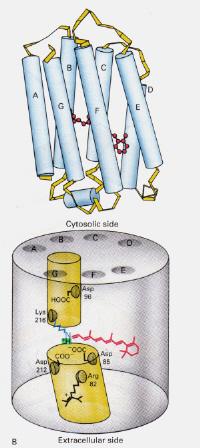
Come funziona il meccanismo di ofBacteriorhodopsin trovato in Halobacteria differire da quella della Rodopsina trovato inRod cellule dell’occhio umano?: Questa volta il complesso di base retinico-Schiff protonato blocca naturalmente un canale attraverso la membrana altrimenti formato da due camere adiacenti. Il complesso trans protonato dona un protone all’Asp-85 che consente l’uscita di quello stesso protone sul lato extracellulare. La fotoisomerizzazione alla struttura 13-cis consente alla base di Schiff di raccogliere un protone dal residuo Asp-96 sul lato citosolico. Dopo il riorientamento della forma cis al trans, continua il ciclo di isomerizzazione e pompa protonica.