Calmodulina
Questa è una video introduzione alla proteina di segnalazione del calcio, calmodulina, dal punto di vista di un chimico inorganico!
Calmodulina, o CaM, è un polipeptide che è onnipresente in tutte le cellule eucariotiche. Questa proteina è conosciuta come calmodulina perché è una proteina calcio-modulata che svolge un ruolo vitale nel processo di trasduzione del segnale del calcio. La trasduzione del segnale del calcio è il processo attraverso il quale le interazioni tra ioni di calcio e numerose proteine mediano la comunicazione tra le cellule. la funzione della calmodulina, pertanto, è necessaria in tutte le cellule eucariotiche e alcuni dei compiti che aiuta a svolgere sono la segnalazione nervosa, il movimento del muscolo scheletrico e la memoria. Rilevando gli ioni di calcio nell’ambiente, la calmodulina si attiva e successivamente agisce come intermedio, avviando il legame di importanti proteine come le chinasi, aiutando le nostre cellule nella funzione di base e sofisticata (“Calmodulina”).
Il video qui sotto mostra il cambiamento strutturale che si verifica all’interno della CAM durante il legame al calcio (codici PDB 3CLN e 1CFD).
La proteina stessa è lunga 148 aminoacidi con due regioni globulari contenenti 2 motivi EF-mano ciascuna, che sono siti caratteristici di polipeptidi mediati dal calcio. Quando attivato, calmodulin ospita 4 ioni Ca2 + che cambiano drasticamente la forma della proteina. Quando calmodulin lega con gli ioni del calcio, la proteina si apre dalla sua forma di apo alla sua forma di alone, esponendo un’elica alfa che è conosciuta come il linker o la regione centrale del cavo. Coniata per la sua flessibilità, la regione centrale del tether è la posizione della proteina su cui le proteine partner si legano e contribuiscono alla cascata che è la messaggistica secondaria del calcio. In base alla sua struttura e al suo bisogno di ioni di calcio per funzionare, la calmodulina deve essere in grado di selezionare gli ioni di calcio nel citoplasma e le interazioni tra lo ion e i ligandi nei domini della mano EF supportano questa idea di selettività (Bertini et. al., 635-638).
Questa immagine è una rappresentazione di come un motivo EF-mano assomiglia a una mano. Il diagramma a nastro a sinistra mostra uno dei quattro caratteristici motivi a mano helix-turn-helix EF di calmodulin. (PDB codice 3CLN)
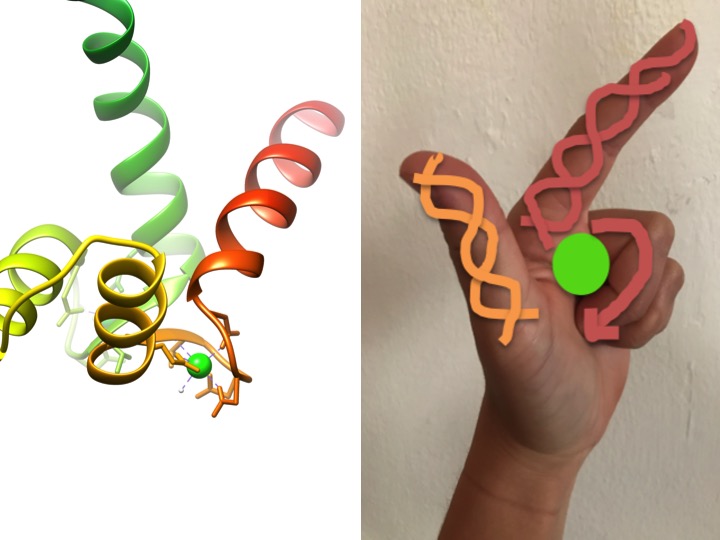
I motivi EF-hand sono regioni strutturali altamente conservate di proteine coinvolte nel legame del calcio. Queste regioni sono conosciute come motivi “a mano” perché assomigliano a una mano fatta a forma di L, dove lo ion metallico si trova nel mezzo del pugno, le eliche alfa sono indicate dall’indice rivolto verso l’alto e dal pollice rivolto verso l’interno, e le dita arricciate rappresentano la regione del giro o del ciclo. Questo è dimostrato nella figura sopra. In un caratteristico motivo EF-mano, gli aminoacidi tra cui glutammati, asparagine, acidi aspartici e acidi glutammici si legano al Ca, così come all’acqua (Bertini et. al. 639). La tipica sequenza di legame del dominio EF-hand è mostrata nella figura seguente.
Questo fumetto illustra gli aminoacidi coordinati in un tipico dominio EF mano (L’esatta composizione aminoacidica varia!). La linea tratteggiata rappresenta la coordinazione di Ca all’ossigeno di un carbonile dorsale, mentre le linee continue indicano la coordinazione alle catene laterali o all’acqua.
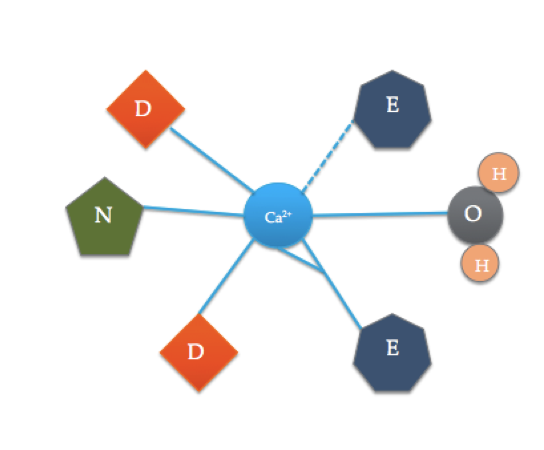
Il sito di legame della calmodulina è leggermente diverso dal dominio della mano EF più tipico mostrato sopra. I 6 ligandi della calmodulina includono le catene laterali di tre acidi asparatici (D), 1 acido glutammico (E) che forma due legami covalenti coordinati con lo ion, 1 molecola d’acqua dalla soluzione e 1 molecola carbonile dalla spina dorsale. Il sito di legame della calmodulina è costituito da uno ion Ca2+ circondato da 6 ligandi mentre forma 7 legami.
Si può notare che il motivo EF all’interno di calmodulin include molti degli stessi ligandi, solo in luoghi diversi. Questa conformazione può dare un’idea del perché la calmodulina è selettiva per il calcio e di come solo la presenza di uno ion calcio può soddisfare il sito di legame che causa l’attivazione della proteina. Questo è legato alla termodinamica della calmodulina all’interno della cellula e al modo in cui risponde alla presenza di ioni calcio.
Per comprendere la termodinamica che accoppia l’attivazione della calmodulina, bisogna prima comprendere la concentrazione di ioni come calcio e magnesio all’interno di una cellula eucariotica, compresa quella di un essere umano. La concentrazione di questi ioni deve essere strettamente regolata. All’interno della cellula, la segnalazione del calcio è accompagnata da un temporaneo aumento della concentrazione di ioni calcio, che viene rilevata da proteine come la calmodulina (Bertini et. al., 636). Questo aumento di calcio potrebbe essere dovuto a proteine G intracellulari che inducono il reticolo ruvido e liscio a rilasciare calcio, o gli ioni di calcio potrebbero essere portati dallo spazio extracellulare. Nel caso della calmodulina, di solito risponde al calcio che viene portato nella cellula dall’esterno, che si verifica durante processi come la segnalazione nervosa (Bertini et. al. 637). Prima che la concentrazione di calcio sia momentaneamente aumentata, la concentrazione all’interno della cellula è solitamente compresa tra 10-100 nm, mentre durante il breve afflusso di ioni, la concentrazione aumenta a 1.000-100.000 nm. Il cambiamento di concentrazione fa sì che la calmodulina percepisca gli ioni calcio, li leghi e inizi un’ulteriore trasduzione del segnale (Bertini et. al., 635).
Come, quindi, la calmodulina lega definitivamente gli ioni di calcio e non, ad esempio, gli ioni di magnesio? Gli ioni Mg2 + sono in realtà abbastanza simili agli ioni di calcio: si impegnerebbero in interazioni elettrostatiche piuttosto che covalenti, e sono considerati atomi duri. La ragione per cui la calmodulina sembra favorire gli ioni di calcio piuttosto che gli ioni di magnesio è correlata alle costanti di legame di ciascun ion. La calmodulina può esistere mentre è legata ad altri ioni, come il magnesio, ma se c’è una maggiore concentrazione di calcio, gli ioni di calcio competeranno immediatamente gli ioni di magnesio per occupare i siti di legame al calcio. Questo perché la costante di legame di CaM e Ca2 +(Ka) è maggiore di quella di CaM e Mg2+, come mostrato in Figura 7. Ciò indica che quando legato agli ioni di calcio, la calmodulina produrrebbe più prodotti. Bisogna considerare tutte queste idee tenendo presente che questo processo avviene innumerevoli volte al secondo, e il turnover di questa proteina cambia per rispondere alla concentrazione di calcio sempre modulata della cellula.
Perché il legame della calmodulina con gli ioni di calcio è più favorevole rispetto ad altri metalli? Potrebbe essere a causa della dimensione degli ioni in relazione all’ostacolo sterico indotto dai ligandi. Il sito di legame è caratterizzato da 6 ligandi che formano 7 legami coordinati. Poiché gli ioni di calcio sono più grandi degli ioni di magnesio, come dimostrato nella Figura 8, è possibile che il calcio sia favorito perché aumenta la distanza dei ligandi l’uno dall’altro, diminuendo quindi le interazioni steriche tra i ligandi. La struttura stessa della proteina stessa potrebbe anche rappresentare una ragione per la selettività degli ioni calcio. Nel complesso, è noto che a causa della termodinamica basata sulla variazione della concentrazione cellulare di ioni calcio, la calmodulina percepirà l’aumento degli ioni, li legherà e aiuterà a svolgere la sua funzione.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+CaM + Ca2+ <–> Ca2+CaM + Mg2+
perché KCaM-Ca > KCaM-Mg
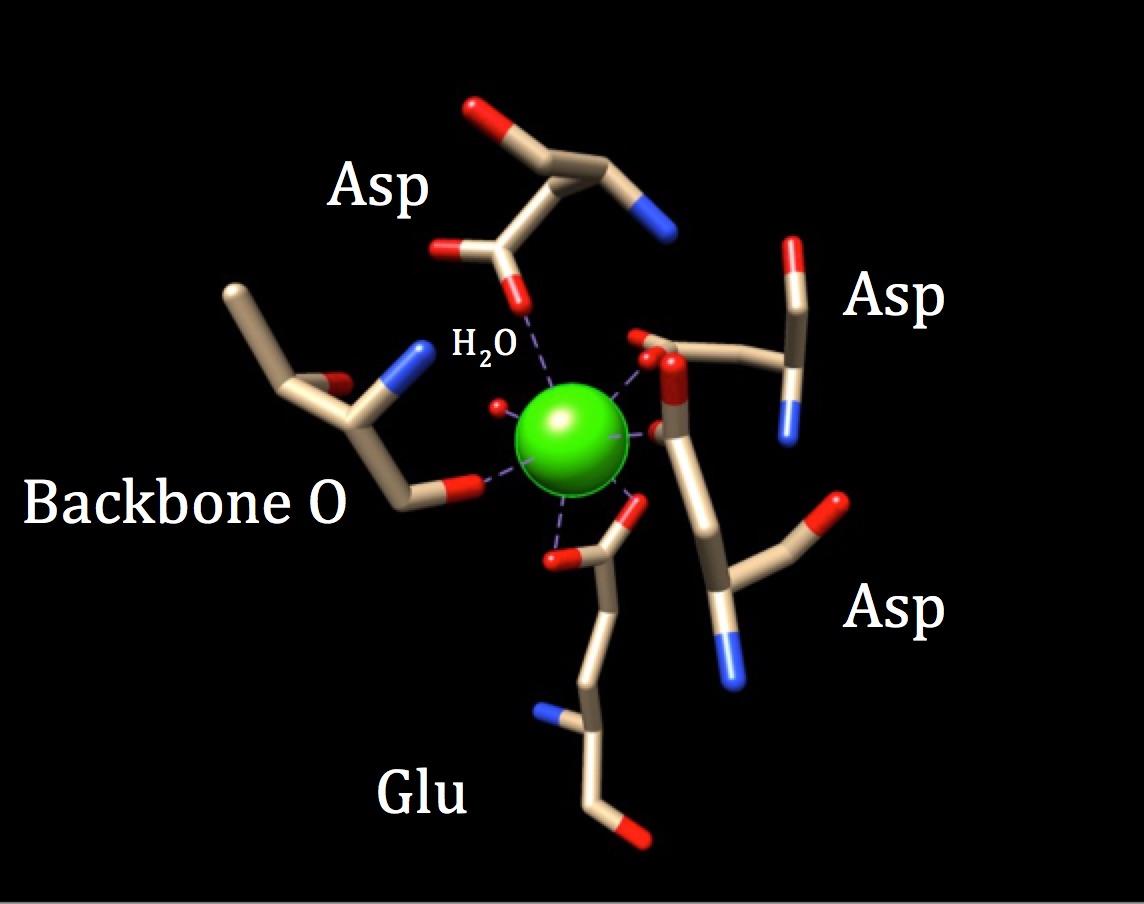
In un ulteriore approfondimento della chimica del sito di legame della calmodulina, la geometria di coordinazione dovrebbero essere esplorate. Poiché lo calcium calcio interagisce con sette atomi donatori, il sistema è noto come sistema eptadentato. Poiché la calmodulina è circondata da sei ligandi, si assumerebbe una geometria di coordinazione ottaedrica. Ma, poiché uno dei ligandi interagisce in modo bidentato con lo ion—il che significa che ha due legami covalenti coordinati provenienti da atomi diversi in un amminoacido—il complesso di coordinazione assume una forma ottaedrica distorta. Il coordinamento specifico è delineato nella figura seguente.
La geometria di coordinazione del sito di legame del calcio della calmodulina. Lo ion metallico del calcio del centro è circondato da tre asparagine (Asp), da un ossigeno della spina dorsale, da un acido gluatmic (Glu) e da una molecola di acqua. (PDB codice 3CLN)
Possiamo anche fare riferimento alla teoria dell’effetto chelato per comprendere meglio la capacità della calmodulina di legarsi agli ioni dei metalli con alta affinità. Un chelatore è un atomo che è in grado di legarsi con più di un atomo donatore. Il legame polidentato è correlato all’effetto chelato, che afferma che quando un ligando si lega con molti gruppi donatori (poli), i legami covalenti coordinati sono molto più forti o più strettamente tenuti. Questa teoria è sostenuta dalla termodinamica, in particolare che il legame polidentato aumenta l’entropia di un sistema, rendendolo più positivo (più disturbo), che è termodinamicamente favorevole. L’applicazione di questa teoria alla calmodulina aiuta a spiegare non solo l’importanza del legame polidendato all’interno dei siti stessi, ma anche la necessità che la proteina leghi 4 diversi ioni di calcio per attivare la sua funzione. Richiedendo essenzialmente il legame di quattro ioni Ca2+ all’interno dei siti, il sistema incoraggia un aumento dell’entropia introducendo più substrati/reagenti per formare un numero maggiore di prodotti. Ciò si verifica a causa del maggior numero di legame all’interno delle interazioni ligando di ogni sito di legame. Tutto sommato, il legame dello calcium calcio nei siti del polipeptide è supportato dalla teoria dell’effetto chelato e fa luce sull’efficienza della calmodulina nel legare il calcio.
I motivi EF-hand hanno una certa struttura basata sul fatto che il calcio è il metallo centrale. Questo vale anche per i siti di legame alla calmodulina. Lo ion Ca2 + si lega con atomi simili nelle strutture di alcuni amminoacidi basati su una teoria chiamata Teoria acido-base dura/morbida. Questa teoria separa metalli e ligandi in due categorie in base alla polarizzabilità e al loro rapporto carica-raggio. Gli acidi e le basi dure sono ioni più piccoli che hanno un rapporto carica / dimensione maggiore, e questo li porta ad interagire in modo elettrostatico (ovvero attrazioni tra + e-cariche), mentre gli acidi e le basi molli sono di dimensioni maggiori e quindi hanno un rapporto carica / raggio minore, portandoli a creare legami con carattere covalente. La frase “come si lega con come” si riferisce al fatto che gli acidi e le basi dure tendono ad interagire con altri atomi duri, e lo stesso vale per gli acidi e le basi morbide. Ca2 + è caratterizzato come un acido duro perché, sebbene abbia un ampio raggio, interagisce con i ligandi in modo prevalentemente elettrostatico. Quando si osserva il sito di legame del calcio della calmodulina, si può vedere che lo ion calcio si lega agli atomi di ossigeno degli acidi aspartici 3, dell’acido glutammico, dell’acqua e del carbonile dorsale. Questo legame è in linea con “come si lega con come” perché l’acqua e gli amminoacidi ligandi, acido glutammico e acido asparatico, legano attraverso donatori di ossigeno che sono caratterizzati come basi dure. La figura 10 rivisita i siti di legame della calmodulina mostrando anche le sidechain negative degli amminoacidi che interagirebbero con gli ioni di calcio indicati in blu.
Per quanto riguarda gli atomi donatori dei ligandi legati e la loro capacità di donare coppie di elettroni al complesso di coordinazione, la serie spettrochimica spiega come gli atomi interagiscono con il metallo centrale. Nel caso del sito di legame del calcio, gli ossigeni che interagiscono con lo ion Ca2 + sono tutti considerati donatori σ e donatori π perché gli ossigeni donatori possiedono 2 o più coppie di elettroni. Le categorie dei seires spettrochimici che specificano la disponibilità e la donazione di elettroni hanno implicazioni sulla designazione dello spin (bassa o alta), che indica come gli elettroni d riempiono i loro orbitali e la dimensione delta (Δ) tra gli orbitali d del metallo, ma questo non fa differenza per il calcio perché gli orbitali d del calcio non sono occupati a causa Ciò rende gli orbitali d essenzialmente trascurabili nella maggior parte delle conversazioni riguardanti la proteina. Un’eccezione è legata alla considerazione della labilità dello ion calcio nel sistema.
La mancanza di elettroni negli orbitali d di Ca produce energia di stabilizzazione del campo del ligando pari a zero e spiega l’elevata labilità dello ion calcio. Labilità si riferisce alla velocità con cui i ligandi possono essere sostituiti in complessi di coordinazione, e quindi descrive la cinetica di un sistema. Gli atomi sono labili se si scambiano ligandi rapidamente. A causa della sua funzione pertinente in tutte le cellule eucariotiche, si prevede che la calmodulina leghi e rilasci ioni calcio milioni di volte al secondo per inviare e ricevere messaggi dalle cellule circostanti attraverso il trasferimento di ioni calcio. Per quanto riguarda la capacità della calmodulina di legare e rilasciare Ca2 + rapidamente, è importante considerare l’occupazione degli orbitali dell’elettrone di valenza D. Come affermato, il calcio possiede orbitali vuoti di valenza D. Questi orbitali non occupati possono dare origine a una spiegazione per la labilità di uno Ca Ca2+. Poiché tutti gli orbitali d dello calcium calcio sono vuoti, possiede un’energia di stabilizzazione del campo del ligando (LFSE) di 0. Ciò indica che il calcio è instabile quando si considera LFSE a causa del fatto che le molecole stabili di solito hanno un valore negativo per LFSE. L’instabilità in questo caso si traduce in una volontà di reagire rapidamente e di andare avanti e indietro complessi, sostenendo l’affermazione che gli ioni Ca2+ incoraggiano reazioni veloci e possono essere caratterizzati come labili. Anche se questo sembra essere controintuitivo alla discussione che coinvolge effetto chelato, resta inteso che queste due teorie non si contraddicono a vicenda. La stabilità dei legami di coordinazione strettamente tenuti che è suggerita dall’effetto chelato incoraggia la calmodulina a rimanere stabile abbastanza a lungo per legare le proteine di supplemento. Una volta che è completato e la concentrazione di calcio ritorna alla normalità, è efficiente nello stripping del sito degli ioni calcio.
La calmodulina, in base alla sua struttura e alla composizione del suo sito di legame vitale, svolge parte integrante di innumerevoli processi eseguiti dalle cellule eucariotiche. Attraverso l’accettazione e il legame degli ioni di calcio nella trasduzione del segnale, la calmodulina agisce come componente fondamentale del funzionamento di base e di alto livello in organismi come gli esseri umani. Applicando la teoria bioinorganica e cogliendo una comprensione dell’ambiente delicatamente monitorato di una cellula eucariotica, si può comprendere correttamente la capacità della calmodulina di selezionare per gli ioni di calcio e incoraggiare un ulteriore funzionamento che coinvolge più di 100 proteine partner.