Vitamina E Trattamento per pazienti con steatoepatite non alcolica
Jhonathan Ferney Vélez M. (1), Gustavo Amador Crespo H. (1), Juan Carlos Restrepo G. MD. Esp, MSc, dottorato di ricerca. (2)
(1) Studente di medicina presso la Facoltà di Medicina dell’Universidad de Antioquia di Medellín, Colombia.
(2) Professore associato presso il Dipartimento di Medicina Interna e il Gruppo di Gastroepatologia presso l’Universidad de Antioquia e Epatologo presso l’Ospedale Pablo Tobón Uribe a Medellín, Colombia. [email protected]
Ricevuto: 12-02-14 Accettato: 05-11-14
Abstract
La steatoepatite non alcolica (NASH) è caratterizzata istologicamente dal ballooning di epatociti, infiammazione lobulare e steatosi. Se si sospetta questa diagnosi, è importante escludere altre cause di danno epatico, in particolare il consumo eccessivo di alcol. Tuttavia, ad oggi, una biopsia è l’unico metodo disponibile per confermare la diagnosi. La vitamina E deve essere considerata una terapia di prima linea per il trattamento di questa malattia perché diversi studi clinici hanno dimostrato che una dose di 800 UI/die migliora l’istologia degli adulti non diabetici affetti da NASH anche quando non vi è alcun impatto significativo sulla fibrosi. Questi risultati sono stati confermati da biopsie. Nonostante i comprovati benefici dell’uso di questo farmaco, è importante essere consapevoli che il suo uso non può sostituire i cambiamenti nella dieta e nell’esercizio fisico, ma dovrebbe essere visto come un complemento a queste misure.
Parole chiave
Steatoepatite non alcolica, vitamina E, stress ossidativo.
INTRODUZIONE
NASH è caratterizzato istologicamente dal ballooning di epatociti, infiammazione lobulare e steatosi (1, 2). Attualmente, NASH può essere diagnosticata solo attraverso una biopsia epatica che è il gold standard diagnostico. Fornisce inoltre informazioni riguardanti la presenza e il grado di infiammazione, necrosi e fibrosi che sono tutti importanti per stabilire la prognosi del paziente (2-5). Le differenze tra NASH e steatoepatite alcolica sono microscopicamente piccole che rendono difficile distinguere istologicamente tra loro. Per questo motivo, è importante ottenere informazioni dal paziente sulle sue abitudini di consumo (4).
NASH fa parte di un’entità molto più ampia chiamata NAFLD (steatosi epatica non alcolica) che include le prime fasi della steatosi epatica: steatosi senza infiammazione e steatosi con lieve infiammazione. In definitiva, la NAFLD si sviluppa nella caratteristica condizione infiammatoria di NASH che progredisce verso la fibrosi e infine la cirrosi (1, 2, 5). Non è ancora del tutto chiaro che gli individui progrediscano dalla semplice steatosi allo stato infiammatorio. Le interazioni tra suscettibilità genetica, disturbi metabolici e stress ossidativo sono i fattori più importanti (6, 7).
La NAFLD è la malattia epatica più diffusa in tutto il mondo (2, 4, 6). Si stima che la prevalenza di NAFLD sia dal 20% al 30% e che la prevalenza di NASH sia dal 2% al 3% nella popolazione generale del mondo occidentale (8).
A causa delle sue qualità antiossidanti, la vitamina E è stata raccomandata nelle attuali linee guida americane per il trattamento di NASH. “La vitamina E (α-tocoferolo) somministrata alla dose giornaliera di 800 UI / die migliora l’istologia epatica negli adulti non diabetici con NASH comprovato da biopsia” Ciò non esclude l’importanza dell’intervento nello stile di vita e nella dieta del paziente come parte del trattamento di base per i pazienti con NASH (9, 10). In questo articolo esaminiamo la fisiopatologia di NASH con enfasi sul ruolo della vitamina E nel trattamento dei pazienti con questa malattia.
FISIOPATOLOGIA
Mentre la patogenesi di NASH non è ancora del tutto chiara, l’ipotesi più accettata proposta fino ad oggi per spiegare gli eventi che hanno portato alla steatosi e successivamente alla steatoepatite è la teoria “a due colpi”. Il primo colpo nell’insorgenza di questa malattia è il sovraccarico di grasso (11, 12). Uno stile di vita sedentario, fattori genetici e un aumento dell’apporto calorico rendono gli individui più suscettibili allo sviluppo di insulino-resistenza e iperinsulinemia che porta ad un aumento della sintesi lipidica epatica e al rilascio di acidi grassi liberi dal tessuto adiposo. Se il fegato viene mantenuto in questo stato, diventa incapace di metabolizzare tutti gli acidi grassi che produce e che vengono rimossi dalla circolazione. Questa condizione alla fine porta al secondo colpo che è la steatosi epatica e lo stress ossidativo (4, 5, 13).
Lo stress ossidativo è uno squilibrio che favorisce i pro-ossidanti rispetto agli antiossidanti (3). Durante la steatosi epatica, gli epatociti entrano in uno stato ipermetabolico che porta ad un aumento della produzione di radicali liberi negli organelli cellulari (13). Quantità crescenti di specie reattive dell’ossigeno (ROS) negli epatociti portano alla perossidazione lipidica che è una reazione che fornisce un apporto continuo di radicali liberi aggiuntivi con effetti potenzialmente devastanti (14, 15).
Un antiossidante è la vitamina E (tocoferolo) che reagisce con i perossidi lipidici per ridurli verso gli acidi grassi. Formano il tocoferossile radicale relativamente stabile che persiste abbastanza a lungo da tornare al tocoferolo mediante una reazione con vitamina C sulla superficie cellulare (12). A causa di questa caratteristica, la vitamina E è stata considerata per uso come trattamento per i pazienti con NASH (13, 16).
MANIFESTAZIONI E DIAGNOSI
La NAFLD è una sindrome comune che va dalla semplice steatosi alla steatoepatite (NASH) con successiva fibrosi e cirrosi (5). Sebbene alla diagnosi la maggior parte dei pazienti sia asintomatica, alcuni pazienti, specialmente i bambini, possono lamentare affaticamento e disagio. Il disagio nel quadrante superiore destro dell’addome, il sospetto dovuto all’aumento dei livelli di aminotransferasi e un’ecografia addominale con una malattia epatica brillante sono tutti segni di questa malattia. Obesità, diabete e dislipidemia dovrebbero anche essere presi in considerazione durante la valutazione delle condizioni che potrebbero essere associate a NAFLD e NASH (5, 17).
Durante la valutazione diagnostica dovrebbero essere escluse altre cause comuni di malattia epatica, ma alla fine una biopsia epatica è l’unico metodo disponibile per confermare la diagnosi. È anche importante per definire la prognosi del paziente (Tabella 1) (3, 4). Nonostante il suo grande valore clinico, una biopsia è costosa e porta ad un leggero aumento della morbilità e, in rare occasioni, si traduce in mortalità. Questo strumento deve essere considerato solo per i pazienti per i quali si sospetta la presenza di steatosi epatica non alcolica che sono ad alto rischio di steatoepatite e fibrosi avanzata (obesità, diabete mellito di tipo II, dislipidemia e sindrome metabolica) e nei casi di diagnosi incerta (3, 9).

RUOLO DELLA VITAMINA E NEL TRATTAMENTO DELLA STEATOEPATITE NON ALCOLICA
Attualmente non esiste un trattamento efficace per NASH. Tuttavia, considerando l’importante ruolo della vitamina E come fattore antiossidante, ci sono stati diversi studi clinici per dimostrare i suoi benefici nell’evoluzione clinica e istopatologica di questa malattia (Tabella 2).
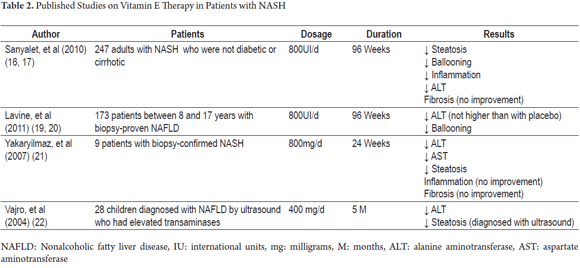
Tra questi vi è lo studio PIVENS (Pioglitazone versus vitamina E versus placebo per il trattamento di pazienti non diabetici con steatoepatite non alcolica). Si è trattato di uno studio multicentrico, in doppio cieco, controllato con placebo, in cui è stato valutato il miglioramento istologico in 247 pazienti non diabetici e non cirrotici con NASH. I pazienti sono stati assegnati in modo casuale a ricevere una dose giornaliera di pioglitazone (80 pazienti), vitamina E (84 pazienti) o un placebo (83 pazienti) per novantasei settimane (18). I dosaggi giornalieri erano 30 mg per pioglitazone e 800 U per vitamina E. Questo studio ha rilevato che il 43% dei pazienti che hanno ricevuto vitamina E (P = 0,001) è migliorato rispetto al 34% di quelli che hanno ricevuto pioglitazone (P = 0,04) e al 19% di quelli che hanno ricevuto placebo. La differenza nei tassi di miglioramento tra pioglitazone e placebo non era statisticamente significativa mentre la differenza tra i tassi di miglioramento della Vitamina E e dei placebo era. Tuttavia, entrambi i farmaci sono stati associati a un miglioramento dei livelli di aminotransferasi, alla riduzione della steatosi e all’infiammazione lobulare, ma nessuno dei due ha portato a un miglioramento della fibrosi. Lo stesso studio ha dimostrato che dopo il trattamento con vitamina E è stato sospeso i livelli di aminotransferasi aumentati indicando che la somministrazione indefinita del trattamento può essere necessario. Inoltre, non sono state riscontrate differenze significative tra gli effetti avversi della vitamina E e gli effetti avversi dei placebo (19).
Una rivalutazione dello studio PIVENS di Hoofnagle et al. focalizzato sulla risposta delle ALT sieriche nei pazienti che hanno ricevuto vitamina E o placebo e sull’associazione di questa risposta con i cambiamenti clinici, istologici iniziali e le interazioni con i cambiamenti del peso corporeo. Hanno scoperto che i cambiamenti nelle ALT erano più comuni tra coloro che ricevevano vitamina E (48%) rispetto a quelli che ricevevano placebo (16%; p <0,001). Tra il gruppo che ha ricevuto vitamina E, le risposte ALT sono state associate a una diminuzione dell’attività della steatosi epatica non alcolica (NAFLD), ma non vi è stato alcun miglioramento nella fibrosi dopo la fine del trattamento a 96 settimane. I livelli di ALT sono aumentati nel gruppo trattato con vitamina E al termine della somministrazione, ma non sono aumentati nel gruppo trattato con placebo al termine della somministrazione. Entrambi i gruppi di trattamento avevano livelli di ALT quasi identici alla settimana 120. Questi risultati sono simili a quelli mostrati nella coorte completa della pubblicazione principale dello studio PIVENS. Inoltre, i risultati hanno mostrato che la perdita di peso (2 kg o più) è anche associata alla risposta ALT, con miglioramento della NAFLD (<0,001) e miglioramento della fibrosi (p <0,02), ma la vitamina E ha avuto effetti maggiori sulla NAFLD indipendentemente dai cambiamenti nel peso corporeo. Infine va notato che gli effetti della vitamina E e della perdita di peso sulla risposta ALT e sull’istologia sono indipendenti, il che significa che anche i pazienti che perdono peso trarrebbero beneficio dalla terapia con vitamina E (20).
Lo studio TONIC (Treatment of nonalcoholic steat liver disease in children) era un altro studio multicentrico, in doppio cieco, controllato con placebo. Comprendeva 173 pazienti di età compresa tra gli otto ei diciassette anni. I pazienti sono stati assegnati in modo casuale a ricevere vitamina E (58 pazienti), metformina (57 pazienti) o placebo (58 pazienti) per 96 settimane. I dosaggi sono stati 400 UI due volte al giorno per la vitamina E e 500 mg due volte al giorno per la metformina (21). Nessuno dei due agenti è risultato superiore ai placebo per aver raggiunto una riduzione sostenuta di almeno il 50% dei livelli di ALT al basale o livelli di ALT sostenuti di 40 U/L o meno. Le misurazioni sono state effettuate ogni 12 settimane dalla settimana 48 alla settimana 96. Questo studio ha anche rilevato che la risoluzione di NASH era significativamente più alta nel gruppo di pazienti trattati con vitamina E rispetto al gruppo placebo. Questo risultato è stato attribuito alla significativa diminuzione del ballooning epatocellulare riscontrata nei pazienti trattati con vitamina E. Ciò è simile ai risultati di PIVENS anche se lo studio TONIC non ha esaminato la diminuzione del ballooning epatocellulare come risultato primario a causa delle differenze istopatologiche tra NALFD nei pazienti pediatrici e negli adulti. Lo studio TONICO non ha rilevato alcun miglioramento nella fibrosi (22).
Prima di questi due grandi studi c’erano stati altri studi più piccoli che avevano risultati con grandi differenze nei risultati primari valutati. Oltre a popolazioni molto più piccole, questi studi hanno avuto meno tempo di monitoraggio e alcuni di essi non sono stati controllati con gruppi placebo.
Uno studio del 2007 di Yakaryilmaz et al. ha esaminato l’effetto della vitamina E su nove pazienti le cui diagnosi di NASH erano state verificate mediante biopsia. Lo studio ha valutato l’effetto della vitamina E sul recettore gamma attivato dal proliferatore del perossisoma (PPARG) e sulla resistenza all’insulina. I pazienti hanno ricevuto 800 mg di vitamina E al giorno per 24 settimane. Prima dell’inizio del trattamento i fegati dei pazienti sono stati valutati biochimicamente e istologicamente. Queste valutazioni sono state ripetute dopo la fine del trattamento. Alla fine delle 24 settimane sono state riscontrate diminuzioni statisticamente significative di AST, ALT e steatosi, ma non sono stati rilevati cambiamenti istologici nel livello di infiammazione e fibrosi. Nessun paziente ha avuto effetti avversi a questo dosaggio di vitamina E (23).
Vajro, et al. (2004) ha condotto uno studio su un gruppo di 28 bambini con disfunzione epatica correlata all’obesità. I pazienti sono stati divisi in due gruppi. L’età media del primo gruppo era di 9,88 (+/- 3,97) anni, e del secondo gruppo era di 10,7 (+/- 3,45). I pazienti sono stati valutati per determinare se vi fossero effetti benefici del trattamento con vitamina E sulla perdita di peso, sui livelli di transaminasi e sulla steatosi misurata mediante ultrasuoni. I bambini inclusi in questo studio avevano tutti ipertransaminasemia cronica (livelli di AST o ALT 1,5 volte superiori al valore normale per più di 6 mesi) e segni di steatosi negli ultrasuoni. Lo studio ha avuto un design a singolo cieco in cui i pazienti sono stati randomizzati in uno dei due gruppi: Gruppo 1 (placebo più dieta) e Gruppo 2 (vitamina E + dieta). Successivamente ogni gruppo è stato suddiviso in base alla conformità del paziente con il trattamento. Gruppo 1 è stato diviso in Sottogruppo 1A per coloro che hanno rispettato la dieta e Sottogruppo 1B per coloro che non avevano rispettato. Il gruppo 2 è stato diviso in Sottogruppo 2A per coloro che avevano rispettato la terapia con vitamina E e Sottogruppo 2B per coloro che non avevano rispettato la terapia con vitamina E. Il sottogruppo 2A è stato ulteriormente suddiviso in Sottogruppo 2A1 per coloro che non hanno rispettato la dieta e Sottogruppo 2A2 per coloro che hanno rispettato la dieta. Lo studio ha rilevato che il dosaggio di 400 mg/die di vitamina E ha prodotto significative diminuzioni dei valori di ALT per i pazienti del sottogruppo 2A che si sono avvicinati alla normalizzazione indipendentemente da eventuali cambiamenti di peso. D’altra parte, quei pazienti che hanno raggiunto alti livelli sierici di vitamina E e hanno anche perso peso hanno raggiunto la normalizzazione ALT e la remissione della steatosi. Inoltre, un confronto tra il sottogruppo 1A che rispettava solo la dieta e il sottogruppo 2A1 che rispettava solo la terapia con vitamina E ha rilevato che entrambi i gruppi di pazienti avevano livelli di ALT diminuiti a due mesi di monitoraggio, ma che c’era una diminuzione maggiore nel sottogruppo 1A (rispettava solo la dieta) rispetto al sottogruppo 2A1 (rispettava solo la vitamina E) a cinque mesi di monitoraggio. Tutti i segni di steatosi sono scomparsi dalle immagini ecografiche nel sottogruppo 2A2 che ha perso peso durante il trattamento con 400 mg di vitamina E. Questi risultati evidenziano l’importanza di promuovere un’alimentazione sana come uno dei principali interventi di trattamento per i pazienti con NASH, ma dobbiamo anche notare che molti pazienti non rispettano i regimi dietetici che portano al fallimento dell’intervento. Ciò sottolinea l’importanza di utilizzare antiossidanti come la vitamina E come una buona terapia alternativa per questi pazienti (24).
Uno studio pilota di Kugelmas, et al. (2003) ha valutato gli effetti della Fase 1 della dieta American Heart Association combinata con un aumento dell’esercizio aerobico con e senza somministrazione giornaliera di vitamina E sui profili delle citochine (TNF alfa, IL-8, IL -6) e dei livelli di enzimi epatici in 16 pazienti tra i 18 ei 65 anni di età con biopsia provata NASH. Questo è stato uno studio in cieco singolo in cui i pazienti sono stati assegnati in modo casuale a ricevere 800 UI di vitamina E al giorno. I pazienti che non hanno ricevuto vitamina E hanno ricevuto placebo. Il test è stato effettuato per un periodo di 12 settimane. I valori delle citochine non sono diminuiti significativamente con la perdita di peso con o senza somministrazione di vitamina E durante lo studio. I cambiamenti nello stile di vita sono stati associati a miglioramenti degli enzimi epatici e del colesterolo plasmatico nei pazienti con NASH, mentre il dosaggio di vitamina E utilizzato in questo studio non ha mostrato alcun beneficio aggiuntivo. Questo risultato può essere dovuto alla piccola dimensione del campione, al breve tempo di follow-up o al dosaggio di vitamina E utilizzata (25, 26).
Una recensione pubblicata nel novembre 2013 circa attualmente le opzioni disponibili per il trattamento di pazienti con NASH riconosciuto l’attuale raccomandazione per l’uso di vitamina E come terapia di prima linea in pazienti con NASH confermata da biopsia che non cirrotici e che non hanno il diabete, ma anche sottolineato il fatto che questa terapia ha solo mostrato un significativo beneficio in meno della metà dei pazienti. Per questo motivo, la revisione ha concluso che le future strategie di trattamento dovrebbero essere basate su percorsi di malattia patogena se verrà mai sviluppato un trattamento efficace per i pazienti con NASH (27).
Ji H-F et al. ha condotto una meta-analisi per valutare l’effetto della vitamina E sulla diminuzione delle aminotransferasi in pazienti con NAFLD, NASH e epatite cronica C (CHC). I quattro studi che hanno esaminato includevano pazienti con NASH che hanno ricevuto integratori di vitamina E. Gli studi hanno incluso le prove TONIC e PIVENS. Hanno scoperto che la vitamina E potrebbe ottimizzare i livelli di AST e ALT in questi pazienti. Tuttavia, va notato che questa meta-analisi è stata limitata da una incapacità di escludere l’impossibilità di escludere effetti di interventi che coinvolgono cambiamenti di stile di vita, esercizio fisico e l’uso di altri antiossidanti e l’impossibilità di escludere gli effetti di altri fattori di rischio per malattie croniche del fegato come l’uso di droga e alcool, in Aggiunta a questo, l’eterogeneità degli studi deve essere preso in considerazione in quanto si limita l’analisi complessiva oltre ad avere meno specificità per aminotransferasi di biopsie effettuate al momento della diagnosi di una malattia del fegato (28).
Sebbene tra i principali studi per valutare l’effetto dell’uso della vitamina E nei pazienti con NASH non abbiamo trovato differenze statisticamente significative con l’uso di placebo e altre opzioni terapeutiche a breve termine, vi è preoccupazione per i possibili effetti avversi dell’uso prolungato della vitamina E.
Una revisione sistematica di nove studi randomizzati ha incluso nuovi studi randomizzati controllati con placebo al fine di valutare gli effetti della vitamina E per un periodo di almeno un anno sull’incidenza complessiva di incidenti cerebrovascolari e sottotipi di incidenti cerebrovascolari. Ha trovato un aumentato rischio di ictus emorragico (RR = 1,22, 95% CI: da 1,0 a 1,48, p = 0,045). A causa dei risultati ottenuti dalla loro revisione, i ricercatori raccomandano di evitare l’uso indiscriminato di vitamina E a causa delle gravi conseguenze degli ictus emorragici nella morbilità e mortalità (29).
Uno studio randomizzato controllato con placebo che ha incluso 35.533 pazienti seguiti per un minimo di sette anni ha studiato i rischi della vitamina E correlati al cancro alla prostata. Ha confrontato un gruppo placebo con un gruppo che riceve vitamina E ad una dose giornaliera di 400 UI. C’è stato un aumento significativo del rischio di cancro alla prostata tra coloro che hanno assunto vitamina E (HR 1.17; 99% CI, 1.004-1.360; p = 0.008). L’aumento assoluto del rischio è stato di 1,6 per 1000 anni persona (30).
Un’altra meta-analisi ha esaminato la relazione dose-risposta della supplementazione di vitamina E e della mortalità totale negli adulti. Ha mostrato che i pazienti che ricevono alte dosi di vitamina E (maggiori o uguali a 400 UI/die) avevano aumentato la mortalità per tutte le cause. Questa meta-analisi ha limitato la sua ricerca a studi randomizzati controllati i cui campioni di pazienti consistevano in adulti che ricevevano un trattamento con vitamina E da soli o in combinazione con altre vitamine o minerali e che escludevano le donne in gravidanza e che avevano un minimo di 1 anno di trattamento e monitoraggio. I risultati forniti da questa meta-analisi devono essere considerati con cautela perché molti degli studi hanno campioni di piccole dimensioni e sono stati eseguiti tra pazienti con diverse malattie croniche. Ciò limita la capacità dello studio di generalizzare i risultati alla popolazione adulta sana (31).
CONCLUSIONE
Sebbene non esista attualmente una terapia farmacologica efficace per i pazienti con NASH, le prove mostrate dallo studio PIVENS suggeriscono che una corretta somministrazione di vitamina E migliora l’istologia epatica nei pazienti adulti non cirrotici con NASH che non hanno il diabete. Tuttavia, sono necessari ulteriori studi prima che questa raccomandazione possa essere estesa ai pazienti diabetici o ai pazienti che hanno cirrosi con NASH. Studi condotti su pazienti pediatrici con NASH non hanno trovato prove sufficienti per sostenere l’uso della vitamina E. Oltre alla somministrazione di vitamina E, è stato dimostrato che la perdita di peso riduce la steatosi e l’infiammazione del fegato. La perdita di peso attraverso una dieta a basso contenuto calorico combinata con una maggiore attività fisica dovrebbe essere raccomandata per tutti i pazienti. Per quanto riguarda gli effetti collaterali, non abbiamo trovato differenze statisticamente significative nell’uso a breve termine della vitamina E con placebo e altre opzioni di trattamento. Tuttavia, l’uso indiscriminato della vitamina E non è raccomandato per lunghi periodi di tempo in quanto vi sono prove che suggeriscono un aumento dei rischi di cancro alla prostata, ictus emorragico e morte per tutte le cause.
1. Abbas AK, Fausto N. Hígado, vesícula biliare y vías biliares. It: Robbins SL, Mitchell RN, Kumar V, Abbas AK, Fausto N. Patologia funzionale e strutturale. 8va Ed. Barcellona: Elsevier; 2012. pag. 645-687.
2. Brunt E, Neuschwander-Tetri B, Burt AD. Malattia del fegato grasso: alcolica e non alcolica. It: Burt AD, Ferrell, L Portmann BC. Patologia di MacSween del fegato. 6a edizione. Regno Unito: Elservier; 2012. pag. 293-359.
3. Corrado RL, Torres DM, Harrison SA. Revisione delle opzioni di trattamento per la malattia del fegato grasso non alcolica. Med Clin N Am 2014; 98: 55-72.
4. Koek GH, Liedorp PR, Bast A. Il ruolo dello stress ossidativo nella steatoepatite non alcolica. Clinica Chimica Acta 2011; 412: 1297-1305.
5. Cortez-Pinto H, Ermelinda Camilo M. Steatosi epatica non alcolica / steatoepatite non alcolica( NAFLD / NASH): diagnosi e decorso clinico. Best Practice & Ricerca clinica gastroenterologia 2004; 18(6): 1089-104.
6. Mishra A, Younossi ZM. Epidemiologia e Storia naturale della steatosi epatica non alcolica. Journal of Clinical and Experimental Hepatology 2012; 2(2): 135-44.
7. Rolo AP, Teodoro JS, Palmeira CM. Ruolo dello stress ossidativo nella patogenesi della steatoepatite non alcolica. Gratis Radic Biol Med 2012; 52(1): 59-69.
8. Machado MV, Cortez-Pinto H. Diagnosi non invasiva della malattia del fegato grasso non alcolica. Una valutazione critica. Rivista di epatologia 2013; 58 (5): 1007-19.
9. Chalasani N, et al. La diagnosi e la gestione della malattia del fegato grasso non alcolica: linea guida pratica dall’Associazione americana per lo studio delle malattie del fegato, dall’American College of Gastroenterology e dall’American Gastroenterological Association. Epatologia 2012; 55.
10. Mazzella N, Ricciardi LR, Mazzotti A, Marchesini G. Il ruolo dei farmaci per la gestione dei pazienti con NAFLD. Clin Fegato Dis 2014; 18: 73-89.
11. I nostri servizi sono a vostra disposizione. La supplementazione dietetica di α-e γ-tocoferolo attenua lo stress ossidativo indotto dal lipopolisaccaride e le risposte correlate all’infiammazione in un modello murino obeso di steatoepatite non alcolica. Journal of Nutritional Biochemistry 2010; 21: 1200-1206.
12. Giorno CP, James DI. Steatoepatite: una storia di due “colpi”? Gastroenterologia 1998; 114: 842-4.
13. Harper HA, Murray RK, Rodwell VW, Bender DA. Bioquímica ilustrada, 28 ed. México: McGraw-Hill Interamericana; 2010. pag. 484-485.
14. Neuschwander-Tetri BA. Lipotossicità epatica e patogenesi della steatoepatite non alcolica: ruolo centrale dei metaboliti degli acidi grassi non trigliceridi. Epatologia 2010; 52 (2): 774-88.
15. Le T, Loomba R. Gestione della steatosi epatica non alcolica e della steatoepatite. Journal of Clinical and Experimental Hepatology 2012; 2: 156-173.
16. Verdam FJ, Dallinga JW, Driessen, de Jonge C, Moonen E, van Berkel J, Luijk J, Bouvy ND, Buurman AW, Rensen SS, Greve JW. Steatoepatite non alcolica: una diagnosi non invasiva mediante analisi del respiro espirato. Rivista di epatologia 2013; 58: 543-548.
17. Palmentieri B, de Sio I, La Mura V, et al. Il ruolo del modello luminoso di eco del fegato sull’esame ecografico B-mod nella diagnosi della steatosi epatica. Dig Dis fegato 2006; 38: 485-9.
18. Sanyal AJ, et al. Pioglitazone versus vitamina E versus placebo per il trattamento di pazienti non diabetici con steatoepatite non alcolica: progetto di studio PIVENS. Prove Contemp Clin 2009; 30 (1): 88-96.
19. Il suo nome deriva dal greco antico, che significa “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”, “terra”. Pioglitazone, vitamina E o placebo per steatoepatite non alcolica. N Engl J Med 2010; 362 (18): 1675-85.
20. Hoofnagle JH, Van Natta ML, Kleiner DE, Clark JM, Kowdley KV, Loomba R, et al. Vitamina E e cambiamenti nei livelli sierici di alanina aminotransferasi in pazienti con steatoepatite non alcolica. Aliment Pharmacol Ther 2013; 38 (2): 134-43.
21. Il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. Trattamento della malattia del fegato grasso non alcolica nei bambini: disegno di prova tonico. Prove Contemp Clin 2010; 31( 1): 62-70.
22. Il sito utilizza cookie tecnici e di terze parti. Effetto della vitamina e o della metformina per il trattamento della malattia del fegato grasso non alcolica nei bambini e negli adolescenti: Lo studio tonico randomizzato controllato. JAMA 2011; 305 (16): 1659-68.
23. Yakaryilmaz F, Guliter S, Savas B, Erdem O ,sOy R, Erden E, et al. Effetti del trattamento con vitamina E sull’espressione del recettore alfa attivato dal proliferatore del perossisoma e sulla resistenza all’insulina in pazienti con steatoepatite non alcolica: risultati di uno studio pilota. Stagista Med J 2007; 37 (4): 229-35.
24. Vajro P, Mandato C, Franzese A, Ciccimarra E, Lucariello S, Savoia M, et al. Trattamento con vitamina E nella malattia epatica pediatrica correlata all’obesità: uno studio randomizzato. J Pediatr Gastroenterol Nutr 2004; 38(1): 48-55
25. Papastergiou V, et al. Nove modelli di punteggio per la mortalità a breve termine nell’epatite alcolica: convalida incrociata in una coorte comprovata da biopsia. Aliment Pharmacol Ther 2014; 39: 721-732.
26. Kugelmas M, Hill DB, Vivian B, Marsano L, McClain CJ. Citochine e NASH: Uno studio pilota sugli effetti della modificazione dello stile di vita e della vitamina E. Hepatologia 2003; 38 (2): 413-9.
27. Younossi ZM, Reyes MJ, Mishra MA, Mehta R, Henry L. Revisione sistematica con meta-analisi: steatoepatite non alcolica-un caso per un trattamento personalizzato basato su bersagli patogeni. Aliment Pharmacol Ther2014; 39: 3-14.
28. Ji HF, et al. Effetto della supplementazione di vitamina E sui livelli di aminotransferasi in pazienti con NAFLD, NASH e CHC: risultati di una meta-analisi. Nutrizione 2014; 1-6.
29. Markus S, Robert JG, Pamela MR, Christophe T, Tobias K. Effetti della vitamina E sui sottotipi di ictus: meta-analisi di studi randomizzati controllati. BMJ 2010; 341.
30. Klein EA, Thompson IM, Tangen CM, et al. La vitamina e e il rischio di cancro alla prostata: lo studio di prevenzione del cancro al selenio e alla vitamina e (select). JAMA 2011; 306 (14): 1549-56.
31. Miller ER, 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analisi: l’integrazione di vitamina E ad alto dosaggio può aumentare la mortalità per tutte le cause. Ann Intern Med 2005; 142(1): 37-46.