프로토콜
하이브리도마 생산
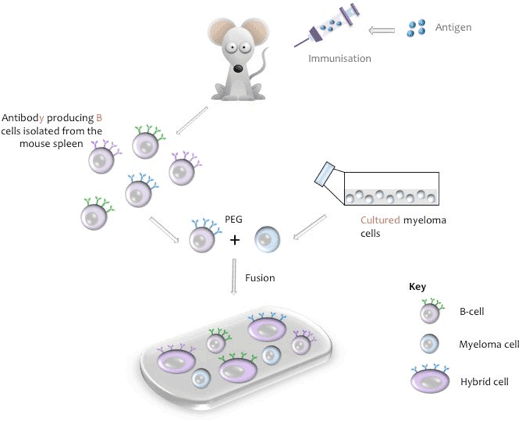
하이브리도마는 배양에서 항원의 한 에피토프에 특이적인 단일 클론 항체를 영구적으로 분비할 수 있는 하나의 하이브리드 세포로부터 발생하는 세포주이다. 잡종 세포는 면역화 된 동물(일반적으로 마우스,쥐 또는 토끼)에서 비-세포를 생산하는 특정 항체의 융합을 통해 생산되며”불멸의”배양 된 골수종 세포주(예:마우스)의 세포와 함께 수명이 유한합니다.
마우스 하이브리드 세포의 생산
융합 과정 동안,비 세포는 마우스 비장에서 분리되고,마우스 골수종 세포주와 혼합되고,융합은 폴리에틸렌 글리콜(페그,부록 1 참조)으로 유도된다. (관련 골수종 라인은 다른 동물 종의 세포가 사용될 때 사용됩니다). 생성 된 하이브리도마는 하이포 카틴,아미노 페린,티미 딘(모자)을 함유하는 조직 배양 배지에서 배양되며,이는 다른 약한 하이브리도마 세포를 능가 할 수있는 융합되지 않은 골수종 세포를 죽이는 단계입니다. 융합되지 않은 비 세포 분열의 힘이 제한적이며 배양에서 자연적으로 죽을 것입니다. 융합 과정 후 10 일,배양 상청액을 수집하여 원하는 항체의 존재에 대해 시험한다.
세포융합의 개략적 표현
필요한 장비
- 세포(층류 또는 클래스 2 캐비닛)를 준비 하 고 처리 하는 무 균 환경
- 인큐베이터 37 로 설정,5%이산화탄소 및 습도 95%
- 거꾸로 현미경
- 캐비닛에 배치할 수 있는 37 물 목욕
- 스윙 아웃 로터가있는 원심 분리기
- 멸균 해부 기기-이상적으로 두 세트-각각 두 쌍의 가위와 겸자(곡선 하나와 무딘 끝 하나)로 구성됩니다.
- 75 미리리터 조직 코닝 문화 플라스크–참조. 15430641
- 24 잘 팔콘 플레이트-참조. 353047
- 멸균 피펫
- 멸균 파스퇴르 피펫
- 타이머
매체 및 기타 시약(자세한 내용은 부록 참조)
- 1640 중탄산염 완충제,글루타민(론자 참조) 1640 헤페스 버퍼링,글루타민 없음
- 양질(배치 테스트)태아 소 혈청(제니셀 참조). 1.본 약관은 2018 년 1 월 1 일부터 시행합니다. 15070-063)
- 15950-017)
- 모자(하이포 카틴,아미노 페린,티미 딘)(깁코 참조. 21060-017)
- 나무못 1500(로슈 심판. 10783641001)
시작하기 전에(자세한 내용은 부록 1 참조)
- 골수종 세포의 해동과 성장
해동과 성장
해동과 성장 골수종 세포 라인 및 중간에서 성장. 다음 방법을 사용하여 골수종 세포주를 해동 및 배양하십시오.
- 골수종 세포의 냉동 바이알을 엘엔 2 저장소에서 제거한다.
- 세포를 37 개의 물 욕조에 넣습니다.
- 오염의 가능성을 줄이기 위해 물 표면 위의 냉동 바이알의 뚜껑을 유지하십시오.
- 세포가 거의 해동 될 때(단지 약간의 얼음 덩어리 만 남아 있음)조직 배양 후드로 이동합니다.
- 70%에탄올로 바이알의 외부를 닦고 상단을 제거하십시오.
- 멸균 파스퇴르 피펫을 사용하여 셀 현탁액을 조심스럽게 제거하십시오.
- 상청액을 제거하고 세포를 10 밀리리터의 신선한 배지에 다시 넣고 작은(25 센티미터 2)플라스크에 넣는다. 이것은 첫번째 플라스크에 있는 농도가 너무 높은 경우에,세포의 두번째(더 낮은)농도가 유효하다는 것을 보증합니다.
- 플라스크를 이산화탄소 배양기에 넣으십시오. 플라스크 뚜껑을 약간 열어 가스 교환을 허용하십시오.
융합 과정
3 일 전-융합을위한 골수종 세포 준비
골수종 세포는 사용할 때 기하 급수적 인 성장 단계에 있어야하며 경험이 필요합니다. 그러나 골수종 세포의 75 센티미터 2 플라스크 두 개를 설정하면 1:40 의 희석과 1:60(아래 참조)에 하나씩,융합 3 일 전에 플라스크 중 하나가 융합 당일에 이상적이어야합니다. (처음에 위의 희석에 추가 플라스크를 설정하고 여기에 주어진 것들 아래에 필요한 경험을 제공해야한다 후속 융합을 위해 골수종 세포의 성장 속도를 판단).
1 일 전-배지를 준비합니다.
1500 호일을 포장(말뚝은 빛에 민감한)무 균 유니버설
- 미니 수 욕조 1282>
- 쥐를 죽이기(제도 지침에 따라),비장을 추출하여 5 밀리리터의 증류수를 담은 멸균 용기에 담는다.물 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 100 밀리리터의 증류수 모든 후속 단계는 층류 후드에서 수행해야 합니다.
- 비장과 매체를 페트리 접시에 넣으십시오.
- 비장을 멸균 포셉으로 움직여 씻으십시오. 유착을 제거하고 비장을 두 번째 페트리 접시에 옮깁니다
- 비장을 두 개로 자릅니다. 무딘 집게로 절반을 잡고 다른 한 쌍의 곡선 집게를 사용하여 비장 캡슐에서 세포를 부드럽게 애타게하여 가능한 한 많은 세포를 제거하도록하십시오. 비장의 후반부를 사용하여 반복
- 비장 캡슐 파편을 제거하고 멸균 파스퇴르 피펫을 사용하여 세포를 잘 혼합하지만 매우 부드럽게 혼합하십시오.
- 세포 현탁액을 15 밀리람베르트 튜브로 옮기고 또 다른 5 밀리람베르트 배양액을 사용하여 페트리 접시를 헹구고 튜브의 비장 세포에 첨가한다.
- 골수종 및 비장 세포를 계산합니다.
- 비장 세포 10 개당 골수종 세포 1 개 비율이 필요합니다.
- 골수종 세포를 50 밀리람베르트 원추형 튜브에 추가합니다.비장 세포(15 밀리람베르트 튜브)와 골수종 세포 모두를(50 밀리람베르트 튜브)에서 300 그램으로 10 분 동안 원심분리한다.
- 두 관의 상등액을 매우 조심스럽게 붓고,펠릿을 각각 10 밀리리터의 매질에 부드럽게 재섭입한다.)
- 다시 삽입 된 비장 세포와 골수종 펠릿을 하나의 50 미리리터 원심 분리기 튜브에 결합하십시오.
- 300 그램에서 5 분 동안 원심 분리기.
- 가능한 한 많은 상청액을 매우 조심스럽게 붓습니다.
- 벤치에 튜브를 부드럽게 눌러 펠렛을 다시 주입합니다. 펠릿을 가볍게 치지 않거나 이것이 융합을 위해 유효한 세포 수를 감소시키는 관의 주위에 세포를 위로 배부하기 때문에 피펫 그것.
- 수제 물 욕조에 튜브를 놓습니다.
- 추가 1.2 미리리터 페그 드롭 드롭 이상 분,교반 부드럽게 모든 몇 방울.1 분 이상 한 방울 씩 떨어 뜨리고 몇 방울마다 부드럽게 저어줍니다.2 분 동안 한 방울 씩 떨어 뜨리고 몇 방울마다 부드럽게 저어줍니다.4 분 동안 한 방울씩 떨어 뜨리고 몇 방울마다 부드럽게 저어줍니다.
- 매우 신중 하 게 상청 액 캔트 및 1 분 동안 세포 펠 릿을 다시 10 밀리람베르트 매체+. 이 작업을 수행하려면,펠렛을 깰 시작하는 매체의 몇 밀리리터를 추가합니다. 이 세포 덩어리를 매우 부드럽게 빨아 들여 피펫에서 위아래로 움직입니다. 이 세포를 추방하고 과정을 반복하십시오. 매우 부드러운 수,떨어져 펠 릿을 강제 하지 않습니다,당신은 세포의 작은 덩어리가 있을 수 있습니다. 이 단계에서 세포는 매우 약합니다.
- 넣어 10mls 의 resuspended 에 융합으로 혼합 190ml 의 따뜻한 중 A+
- 최종 볼륨 200ml
- 1ml 를 넣어의 이 현탁액으로 각각의 잘 8×24(2ml)니다. (총 192 개의 우물)
- 플레이트를 인큐베이터에 밤새(약 24 시간)두십시오.
퓨전 후 하루
- 추가 8 미리리터 모자 200 미리리터 매체+.
- 이 선택적 매질의 1 밀리리터를 8 개의 플레이트의 각 웰에 넣는다.
- 판을 인큐베이터에 두십시오. 식민지는 7~10 일 사이에 나타납니다

배양기:
글루타민(중탄산염 완충제)을 함유한 배양기. 1570>+10% 또한,이 약물은 다른 약물과 함께 사용할 수 있습니다. 15070-063)배양배지+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)