Ionische elektrolyten
Water en andere polaire moleculen worden aangetrokken door ionen, zoals weergegeven in Figuur \(\Paginindex{2}\). De elektrostatische aantrekking tussen een ion en een molecuul met een dipool wordt een ion-dipool aantrekking genoemd. Deze attracties spelen een belangrijke rol bij het oplossen van ionische verbindingen in water.
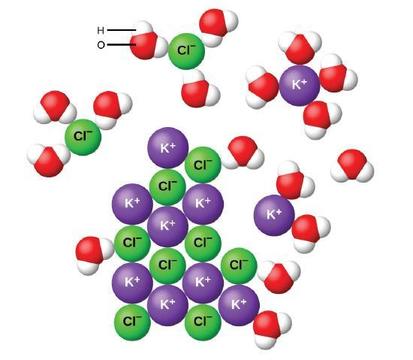
wanneer ionverbindingen in water oplossen, scheiden en verspreiden de ionen in de vaste stof zich gelijkmatig door de oplossing omdat watermoleculen de ionen omringen en oplossen, waardoor de sterke elektrostatische krachten tussen de ionen worden verminderd. Dit proces vertegenwoordigt een fysieke verandering die bekend staat als dissociatie. Onder de meeste omstandigheden, ionische verbindingen zal dissociëren bijna volledig wanneer opgelost, en dus worden ze geclassificeerd als sterke elektrolyten.
laten we eens kijken wat er op microscopisch niveau gebeurt als we vaste KCl aan water toevoegen. Ion-dipoolkrachten trekken het positieve (waterstof) uiteinde van de polaire watermoleculen naar de negatieve chloride-ionen aan het oppervlak van de vaste stof, en ze trekken de negatieve (zuurstof) uiteinden naar de positieve kaliumionen. De watermoleculen dringen tussen individuele K+− en Cl-ionen door en omringen ze, waardoor de sterke interionische krachten die de ionen aan elkaar binden, worden verminderd en ze in oplossing worden gebracht als opgeloste ionen, zoals figuur laat zien. De vermindering van de elektrostatische aantrekking staat de onafhankelijke beweging van elk gehydrateerd ion in een verdunde oplossing toe, resulterend in een verhoging van de wanorde van het systeem aangezien de ionen van hun vaste en geordende posities in het kristal aan mobiele en veel meer wanordelijke Staten in oplossing veranderen. Deze verhoogde wanorde is verantwoordelijk voor de ontbinding van vele Ionische samenstellingen, met inbegrip van KCl, die met absorptie van hitte oplossen.
in andere gevallen zijn de elektrostatische aantrekkingen tussen de ionen in een kristal zo groot, of zijn de iondipool-krachten tussen de ionen en watermoleculen zo zwak, dat de toename van de wanorde de energie die nodig is om de ionen te scheiden niet kan compenseren, en is het kristal onoplosbaar. Dit is het geval voor verbindingen zoals calciumcarbonaat (kalksteen), calciumfosfaat (de anorganische component van bot), en ijzeroxide (roest).