Dimethyl Sulfoxide Oxidations
Dimethyl sulfoxide-based oxidation of primary alcohols to aldehydes or secondary alcohols to ketones is a mild method that does not depend upon heavy metal oxidants. Here is a brief, chronological history of the procedure.
Index:
-
Swern Oxidation (trifluoroacetic anhydride)
-
Swern Oxidation (oxalyl chloride)
Kornblum Oxidation: (1959) een primair tosylaat wordt bij 150o verwarmd om SN2-verplaatsing te veroorzaken door de zuurstof van dimethylsulfoxide (DMSO) in aanwezigheid van NaHCO3. Het geaccepteerde mechanisme op dat moment was een E2 eliminatie zoals getoond. Dimethylsulfide (DMS) is het reductieproduct van de reactie. Dit werk vormde het tosylaat uit het alkyljodide met zilvertosylaat. Vermoedelijk kan de tosylaat worden bereid uit de alcohol die een meer directe route is. Het nadeel van de procedure is de verhoogde temperatuur, hoewel de contacttijd is slechts een paar minuten. De essentiële kwestie is om een methode te vinden om het sulfenaatzout te genereren.

Barton Modification: (1964) Barton en collega ‘ s waren in staat om sulfenaatzouten te genereren door alkylchloroformaten met DMSO te behandelen met verlies van CO2. Toevoeging van triethylamine genereert het oxidatieproduct. Deze procedure verbeterde de barre omstandigheden van de Kornblum procedure. Bovendien is het chloroformaat gemakkelijk beschikbaar door behandeling van de alcohol te oxideren met overtollig fosgeen.

Moffatt-Pfitzner Oxidatie: (1963) deze variant van een op dimethylsulfoxide gebaseerde oxidatie werd ontwikkeld bij Syntex. De activator wordt bereid door protonatie van dicyclohexylcarbodiimide (1, DCC), dat wordt aangevallen door dimethylsulfoxide. Intermediate 2 wordt opnieuw geprotoneerd om de toevoeging van alcoholzuurstof aan het zwavelatoom te vergemakkelijken. Stabiel dicyclohexylureum 4 wordt gevormd samen met sulfenaatzout 3. Deze soort lijdt onder invloed van het dihydrogeenfosfaat anion aan instorting tot de carbonylverbinding. Hoewel fosforzuur een effectieve zuurkatalysator is voor deze reactie, zijn zwavelzuur, waterstofchloride en trifluorazijnzuur dat niet. Pyridinium trifluoroacetaat is echter een effectieve katalysator. Het is van cruciaal belang dat de geconjugeerde base van het zuur basisch genoeg is om de laatste stap van de reactie te bewerkstelligen.

Torrsell Mechanism: (1966) de Zweedse chemicus Torrsell toonde aan dat het mechanisme van deze DMSO-gebaseerde oxidaties niet via een intermoleculaire β-eliminatie verloopt. De eliminatie is een intramoleculair proces. Sulfenaatzout 5 werd bereid volgens de Moffatt-Pfitzner-procedure (zie hierboven). Indien het kornblummechanisme zou worden toegepast, zou het verkregen dimethylsulfide verstoken zijn van deuterium (Experiment 1). Er werd echter dimethylsulfide-d1 (7) verkregen. Dit resultaat is consistent met een basis die de methylgroep in bijlage aan zwavelvormend ylid 6 deprotoneert. Het ylid ontleedt door intramoleculaire deprotonatie om de waargenomen producten te produceren.
Experiment 1:

om dit mechanisme te bevestigen werd het deuterium in DMSO opgenomen als DMSO-d6. Bijgevolg produceerde de reactie dimethylsulfide-d5 (12) en ongeëuteerde aldehyde 11 (Experiment 2).
Experiment 2:

Parikh-Doering oxidatie: (1967) deze oxidatie maakt gebruik van het pyridine zwaveltrioxide complex (13) als activator van dimethylsulfoxide. Sulfaat is de verlaat groep in de verplaatsing door de alcohol (primaire of secundaire) in intermediaire 14. Sulfenaat 15 wordt afgebroken door het intramoleculaire mechanisme (vide supra) om een aldehyde of keton te produceren.

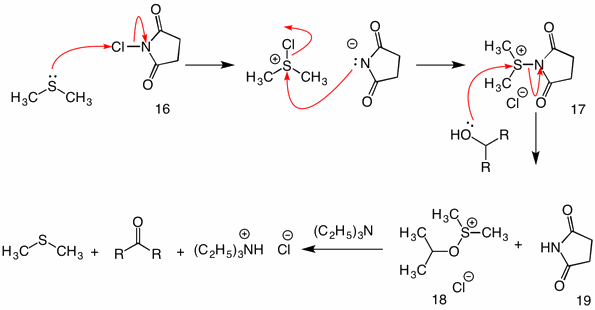
Corey-Kim Oxidatie: (1972) in deze procedure wordt dimethylsulfide geactiveerd (geoxideerd) met N-chloorsuccinimide (16) om reagens 17 te leveren. In de reactie van deze soort met een alcohol, functioneert de succinimidylgroep als een verliezende groep. Het gebruikelijke sulfenaat tussenproduct 18 stort in door het intramoleculaire mechanisme bij de toevoeging van triethylamine.
Swern oxidatie: (1976) deze vroege swern oxidatie maakt gebruik van trifluoroacetic anhydride (20) bij-50oC om dimethylsulfoxide te activeren. Toevoeging van de alcohol aan midden 21 levert het gewenste sulfenaat 22. Het keton of aldehyde wordt op de gebruikelijke manier geproduceerd met triethylamine.

Swern oxidatie: (1978) deze latere swern procedure is een handige methode voor de productie van reagens 24 zonder gebruik te maken van dimethylsulfide en chloor. Dimethylsulfoxide, dat hetzelfde oxidatieniveau heeft als zout 24, reageert met oxalylchloride (23) om koolmonoxide, kooldioxide en reagens 24 te produceren. Toevoeging van de primaire of secundaire alcohol gevolgd door deprotonatie van sulfenaat 25 met triethylamine leidt tot respectievelijk het gewenste aldehyde of keton.
