- protocollen
- Hybridoma productie
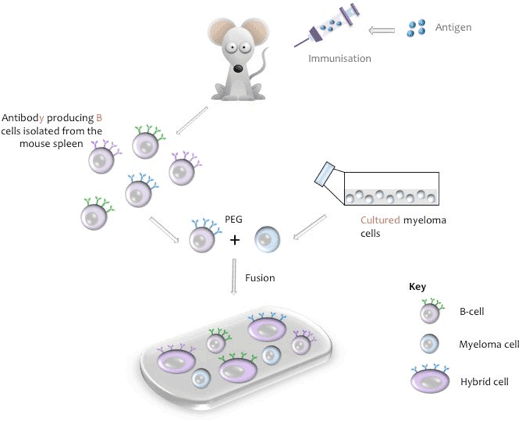
- Schematische weergave van cell fusion
- de Apparatuur die nodig is
- Medium en andere reagentia (zie Bijlage A voor meer details))
- Voordat u begint (zie Bijlage A voor meer informatie)
- Ontdooien en de groei van de myeloom cellen
- het fusieproces
- drie dagen voor-Bereid de myelomacellen voor op de fusie
- één dag voor – bereid het medium
- Dag van de fusion
- dag na de fusie
- Aanhangsel I
protocollen
Hybridoma productie
een hybridoma is een cellijn die voortkomt uit één hybride cel die in staat is een monoklonaal antilichaam te secreteren dat specifiek is voor één epitoop van uw antigeen permanent in cultuur. De hybride cel wordt geproduceerd door de fusie van specifieke antilichaam produceren B-cel van een geïmmuniseerd dier (meestal een muis, rat of konijn) en die een eindige levensduur heeft, met een cel van een “onsterfelijke” gekweekte myeloma cellijn (bijvoorbeeld muis NS-1 of NS-0).
productie van een hybride muiscel
tijdens het fusieproces worden B-cellen geïsoleerd uit de milt van de muis, gemengd met de myeloomcellijn van de muis en fusie wordt geïnduceerd met polyethyleenglycol (PEG, Zie bijlage I). (De relevante myeloomlijn wordt gebruikt wanneer B-cellen van andere diersoorten worden gebruikt). De resulterende hybridomas worden dan gekweekt in weefselkweekmedium dat Hypoxathine, Aminopterine, Thymidine (HAT) bevat, een stap die om het even welke niet-gefuseerde myelomacellen doodt die de andere zwakkere hybridomacellen zouden kunnen ontgroeien. De niet-gefuseerde cellen van B hebben beperkte bevoegdheden van afdeling en zullen van nature in cultuur afsterven. Tien dagen na het fusieproces wordt kweek supernatant verzameld en getest op de aanwezigheid van het gewenste antilichaam.
Schematische weergave van cell fusion
de Apparatuur die nodig is
- Een steriele omgeving, om in te bereiden en te verwerken cellen (laminaire flow-of klasse II-kabinet)
- Een incubator ingesteld op 37ºC, met 5% CO2 en luchtvochtigheid van 95%
- Een omgekeerde microscoop
- EEN 37ºC waterbad die kunnen worden geplaatst in de kast
- Een centrifuge met een swing-out rotor
- Steriele het ontleden van de instrumenten -bij voorkeur twee sets bestaande uit twee paren schaar en tang (een gebogen en een stompe kegel).
- 75 ml weefselkweken-Ref. 15430641
- 24 put Falcon plates-Ref. 353047
- steriele pipetten
- Pipetvuller
- steriele pasteurpipetten
- een timer
Medium en andere reagentia (zie Bijlage A voor meer details))
- RPMI 1640 bicarbonaat gebufferd, met L-Glutamine (Lonza Ref. BE12-702F)
- rpmi 1640 hepes gebufferd, zonder L-Glutamine
- goede kwaliteit (batch getest) foetaal Runderserum (Genycell Ref. GCS0101-500)
- penicilline/streptomycine (Gibco Ref. 15070-063)
- Ultraser G (Pall Ref. 15950-017)
- HAT (Hypoxathine, Aminopterine, Thymidine) (Gibco Ref. 21060-017)
- PEG 1500 (Roche Ref. 10783641001)
Voordat u begint (zie Bijlage A voor meer informatie)
- Maak 500 ml van Een
- Maak 500 ml medium+
- Maak 100 ml medium B
- Maak 100 ml medium C
- Maak 500 ml medium D
Ontdooien en de groei van de myeloom cellen
Ontdooien van het myeloom cellijn en groeien in medium A. Gebruik de volgende methode om de myeloomcellijn te ontdooien en te cultiveren.
- verwijder de bevroren injectieflacon met myelomacellen uit de LN2-opslag.
- plaats de cellen in een waterbad van 37 ° C.
- houd het deksel van de injectieflacon met vriesvak boven het wateroppervlak om de kans op verontreiniging te verkleinen.
- wanneer de cellen bijna ontdooid zijn (er blijft slechts een klein stukje ijs over), verplaatsen ze zich naar de weefselkweekkap.
- veeg de buitenkant van de injectieflacon schoon met 70% ethanol en verwijder de bovenkant.
- verwijder voorzichtig de celsuspensie met een steriele pasteurpipet.
- breng de inhoud over in een centrifugebuis met 10 ml medium A (Zie aanhangsel A)
- draai de celsuspensie gedurende 5 minuten voorzichtig in 300 g.
- verwijder het supernatans en resuspendeer de cellen in 10 ml vers medium A en plaats ze in een kleine (25cm2) kolf.
- neem 1 ml suspensie uit de oorspronkelijke erlenmeyer en voeg aan een tweede met 9 ml medium A toe.dit garandeert dat als de concentratie in de eerste erlenmeyer te hoog is, een tweede (lagere) concentratie cellen beschikbaar is.
- plaats de kolven in de CO2-incubator. Vergeet niet de deksels van de kolf licht open te laten om gasuitwisseling mogelijk te maken.
het fusieproces
drie dagen voor-Bereid de myelomacellen voor op de fusie
de myelomacellen moeten zich in een exponentiële groeifase bevinden wanneer u ze gebruikt en dit vereist ervaring. Als u echter twee kolven van 75 cm2 van uw myeloomcellen instelt, één bij een verdunning van 1:40 en één bij 1: 60 (zie hieronder), moet 3 dagen voor de fusie een van de kolven ideaal zijn op de dag van de fusie. (In eerste instantie het opzetten van extra kolven bij verdunningen boven en onder de hier gegeven moet u de ervaring die nodig is beoordelen van de groeisnelheid van de myeloomcellen voor volgende fusies).
één dag voor – bereid het medium
het volgende moet worden gemaakt en voorverwarmd tot 37ºC (u kunt ze ‘ s nachts in uw incubator zetten).
- Twee x 200ml medium Een+ in twee 75cm2 kolven
- 100 ml medium B
- 100 ml medium C
- 1x4ml PEG 1500 overgebracht naar een folie verpakt (PEG is licht gevoelig) steriele universele
- Een mini-waterbad, gemaakt van een 200 ml bekerglas met ongeveer 100 ml gedestilleerd water en gekruist met tape breed genoeg zijn zodat er een opening tot het houden van een 50 ml Falcon buis rechtop
Dag van de fusion
- Doden van de muis (volgende institutionele richtlijnen), extract van de milt en zet het in een steriele container met 5 ml medium C.
- alle volgende stappen moeten worden uitgevoerd in een laminaire afzuigkap.
- doe de milt en het medium in een petrischaaltje.
- beweeg de milt met een steriele pincet om deze te wassen. Verwijder eventuele verklevingen en breng de milt over in een tweede petrischaal
- snijd de milt in tweeën. Houd de ene helft vast met een stompe pincet en gebruik een ander paar gebogen pincet, plag de cellen voorzichtig uit de miltcapsule, wees voorzichtig om zoveel mogelijk cellen te verwijderen. Herhaal dit met de tweede helft van de milt
- verwijder het miltcapsuleafval en meng de cellen goed, maar zeer voorzichtig met een steriele pasteurpipet.Breng de celsuspensie over in een 15 ml tube en gebruik nog eens 5 ml medium C om het petrischaaltje te spoelen en toe te voegen aan de cellen van de milt in de tube.
- tel het myeloom en de miltcellen.
- u moet een verhouding hebben van 1 myelomacel tot elke 10 miltcellen
- voeg de myelomacellen toe aan een 50 ml conische buis.Centrifugeer zowel de miltcellen (15 ml tube) als de myelomacellen in (50 ml tube) gedurende 300 g gedurende 10 minuten.
- giet het supernatans van beide buisjes voorzichtig af en resuspendeer de pellets voorzichtig in 10 ml medium B. de afwezigheid van FBS totdat het fusieproces is voltooid is uiterst belangrijk omdat cellen niet zullen fuseren als er FBS aanwezig is.)
- Combineer de geresuspendeerde miltcel en myeloma pellets in één 50ml centrifugebuis.
- centrifugeer gedurende 5 minuten bij 300 g.
- giet zo voorzichtig mogelijk supernatans af.
- Resuspendeer de pellet door zachtjes tegen de buis op de bank te tikken. Veeg niet met de pellet of Pipetteer de pellet, omdat hierdoor de cellen rond de buis worden verdeeld waardoor het aantal cellen dat beschikbaar is voor fusing wordt verminderd.
- plaats de buis in het zelfgemaakte waterbad.
- voeg druppelsgewijs gedurende 1 minuut 1,2 ml PEG toe, voorzichtig om de paar druppels roeren.
- voeg 1 ml medium B toe, druppel voor druppel gedurende één minuut, voorzichtig om de paar druppels roeren.
- voeg nog eens 2 ml medium B toe, druppel voor druppel gedurende twee minuten, zachtjes om de paar druppels roeren.
- voeg nog eens 4 ml medium B toe, druppel voor druppel gedurende vier minuten, zachtjes om de paar druppels roeren.
- voeg aan het einde van de tijd 8 ml medium C.
- centrifugeer de tube met cellen gedurende 5 minuten 300g.
- decanteer het supernatant zeer voorzichtig en resuspendeer de celpellet gedurende 1 minuut met 10 ml medium A+. Om dit te doen, voeg een paar ml van het medium om te beginnen met het breken van de pellet. Zuig deze klontjes cellen heel voorzichtig op en beweeg op en neer in de pipet. Verwijder deze cellen en herhaal het proces. Wees heel voorzichtig, forceer de pellet niet uit elkaar, U kunt kleine klontjes cellen hebben wanneer u klaar bent. De cellen zijn extreem kwetsbaar in dit stadium.
- doe de 10 ml resuspendeerd fusiemengsel in 190 ml warm medium A +
- het uiteindelijke volume is 200 ml
- Doe 1 ml van deze suspensie in elk putje van 8 x 24 putje (2 ml) platen. (192 putjes totaal)
- laat de platen gedurende een nacht (ongeveer 24 uur) in de incubator.
dag na de fusie
- voeg 8 ml HAT toe aan 200 ml medium A+.
- Doe 1 ml van dit selectieve medium in elk putje van de 8 platen.
- laat de platen in de incubator. De kolonies zullen tussen 7 en 10 dagen verschijnen

Aanhangsel I
kweekmedium A:
RPMI 1640 medium met L-Glutamine (bicarbonaat gebufferd) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ penicilline (100 E/ml)/streptomycine (100mg/l) (Gibco Ref. 15070-063)
Kweekmedium A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)