- plasticiteit van Vsmc ’s in Fysiologie en ziekte
- Vsmc ‘ s beïnvloeden Adventitia immuunresponsen bij Hyperlipidemische Muizen
- veroudering of Chroniciteit of beide?
- nieuw gevormde Adventitia-structuren nemen deel aan de atlo-functie door het bevorderen van Lymfocytenrecirculatie
- Atlo Vorming is Zeer Territorialized Aangeeft dat de Signalen Van de Plaques aan de Adventitia via Lymfoïde Weefsel Organizer-Zoals VSMCs
- Vsmc ’s dragen rechtstreeks bij tot Adventitia immuniteit bij atherosclerose
- conclusie
- Auteursbijdragen
- financiering
- belangenverstrengeling verklaring
plasticiteit van Vsmc ’s in Fysiologie en ziekte
vasculaire gladde spiercellen (Vsmc’ s) zijn de belangrijkste bestanddelen van middelgrote en grote slagaders. Hoewel de mechanismen van atherogenese grotendeels nog moeten worden gedefinieerd, hebben de studies aangetoond dat de ziekteprogressie kruisverwijzing tussen immune cellen met zowel ECs als VSMCs impliceert. Sommige van deze interacties bevorderen de groei van plaque, terwijl andere de grootte, cellulaire samenstelling en stabiliteit van atherosclerotische plaques verzwakken (1, 2) (Figuur 1, Tabel 1). Vsmc ‘ s vertonen opmerkelijke plasticiteit in reactie op vasculaire schade, ontsteking, en lipoproteïne accumulatie tijdens ziekteprogressie via het herprogrammeren van genexpressie en een verschuiving naar een proliferatieve, Pro-migratie, en geactiveerd fenotype, d.w.z., fenotype switching (5). In Figuur 1 verbeelden we kritische moleculaire schakelaars die zijn voorgesteld om belangrijke regulatoren van ziekteprogressie (3, 6, 8, 11). Tijdens atherosclerose initiatie, bloed-afgeleide monocyten, die zijn aangeworven in de intima, accumuleren lipide waardoor ze een schuimig uiterlijk. Deze schuimcellen dragen bij tot de vorming van vetstrepen die het vroegste en mogelijk omkeerbare stadium van atherosclerotische plaques vormen. Vetachtige strepen ontwikkelen zich geleidelijk tot atheromen / plaques die uiteindelijk leiden tot geëxpandeerde plaques die vsmc ‘ s, T-cellen en myeloïde cellen bevatten (figuur 1) (33). Intrigerend, de samenstelling van een atherosclerotische plaque in plaats van zijn grootte bepaalt zijn stabiliteit als vezelig GLB dikte en necrotische kerngrootte zijn potentiële kenmerken van een stabiele VS.een onstabiele plaque, respectievelijk (4, 9). Vsmc ‘ s in de intima-laag worden traditioneel gezien als gunstig tijdens atherogenese omdat ze extracellulaire matrixcomponenten produceren, waardoor de vorming van sterkere vezelige kappen wordt bevorderd wat resulteert in bescherming tegen plaquescheuring (4, 9). Het wordt steeds duidelijker dat Vsmc ‘ s een overvloed aan structurele en functionele fenotypische transformaties ondergaan en zelfs hun inheemse kenmerken volledig kunnen verliezen om kenmerken van andere celtypes, waaronder macrofagen, te verwerven. Gegevens wijzen erop dat Vsmc ‘ s dichotomische fenotypen kunnen verwerven met een Janus head-type karakter, d.w.z. pro – vs.anti-atherogene eigenschappen, afhankelijk van de weefselomgeving en de werking van risicofactoren (3). Vsmc ‘ s geven cytokines vrij om aangrenzende ECs te stimuleren om adhesiemoleculen tot expressie te brengen en cytokines vrij te geven, en/of chemotaxis van monocyten/macrofagen in de plaque te versterken (3, 34, 35) (Tabel 1). Deze gegevens wijzen erop dat accumulatie van Vsmc ’s in de vezelige dop of intima gunstig zijn, terwijl hun verlies of overgang naar een inflammatoir fenotype schadelijk zijn, en dat de balans tussen vsmc’ s proliferatie/migratie Versus dood/senescentie atheroprogressie Versus plaque stabiliteit bepaalt (3). Diverse aanvullende aspecten van vsmc biologie in gezondheid en ziekte werden onlangs behandeld in een reeks uitstekende beoordelingen (https://academic.oup.com/cardiovascres/issue/114/4) en zullen hier niet worden behandeld. Hieronder richten we daarom de aandacht op de rol van de adventitia en de potentiële impact van Vsmc ‘ s in ATLO-vorming.

figuur 1. Fenotypes van Vsmc ‘ s tijdens atherosclerose progressie onthullen buitengewone plasticiteit. ECs en Vsmc ‘ s in atherosclerotische plaques tonen geactiveerde fenotypen (➊) (3, 4). Sommige van de Vsmc ‘ s ontstaan in de media na werving in de intima; andere Vsmc ‘ s kunnen beenmerg-afgeleid zijn of ze kunnen afkomstig zijn van myeloïde cellen in de circulatie (➋) (3). Een fractie van Vsmc ‘ s woekert (➌) (3, 5). Vsmc ‘ s scheiden extracellulaire matrixcomponenten af; de pluripotente transcriptiefactor, d.w.z. Klf4, kan een belangrijke rol spelen in een proces dat aangeduid wordt als fenotype switching (➍) (6, 7). In pogingen om de atherosclerotische plaque te beschermen tegen dodelijke breuk, kan Oct4 een proces controleren dat remigratie wordt genoemd om een vezelige dop ( ➎ ) te vormen (4, 8-10). Senescentie en apoptose leiden tot het ontstaan van extra ontstekingscytokines om een necrotische kern te vormen die een vicieuze cirkel met dodelijke klinische gevolgen tijdens de late stadia van de ziekte ( ➏ ) initiëren (3, 4, 11).
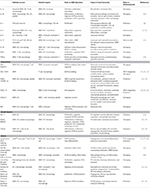
Tabel 1. Belangrijke inflammatoire mediatoren betrokken bij vsmc-gemedieerde atherosclerose immuniteit.
Vsmc ‘ s beïnvloeden Adventitia immuunresponsen bij Hyperlipidemische Muizen
gedurende de laatste twee decennia werd het steeds duidelijker dat adventitia een zeer complex en immunologisch actief weefsel is dat cellen herbergt die zo divers zijn als stromale cellen, zenuwen, lymfevaten, vasa vasora en residente leukocyten/voorlopercellen, die allemaal het vermogen hebben om de voortgang van de ziekte te beïnvloeden (36, 37). We merkten op dat de adventitia van ApoE – / – muizen belangrijke herstructureringsgebeurtenissen ondergaat tijdens alle stadia van atherosclerose: Zowel aangeboren als adaptieve immuuncellen accumuleren naast de naburige atherosclerotische plaques (Figuur 2). Bovendien werden onze studies in experimentele muizen bevestigd in menselijke zieke slagaders: wij en anderen observeerden ATLO-achtige structuren in de adventitia van patiënten met atherosclerotische aorta-aneurysma ‘ s (38, 39) en meer recent, Akhavanpoor et al. waargenomen goed ontwikkelde ATLOs in de adventitia van een aanzienlijk percentage patiënten met ischemische hartziekte (40). Bij muriene atherosclerose zijn lymfevat-, high endothelial venule (HEV)-, en bloedvatneogenese prominente kenmerken van dit herstructureringsproces (16, 41).
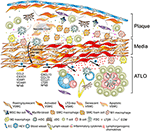
Figuur 2. Vasculaire gladde spiercellen (vsmc) nemen deel aan adventitia-immuniteit tijdens de vorming van plaque. Vsmcs sandwiched tussen atherosclerotic plaques en adventitia keuren een lymphoid weefselorganisator-als fenotype na activering via plaque-afgeleide cues (➊) goed en transdifferentiate vervolgens in LTO-als cellen (➋). Door middel van hun proliferative en cytokine-uitdrukkend fenotype beà nvloeden zij de herstructurering en het beeldhouwen van adventitia met inbegrip van angiogenese, de vorming van HEV, en de lymfevatneogenese (➌). Fenotype switching resulteert ook in de expressie en secretie van lymforganogene chemokines, d.w.z. CXCL13 en CCL21, waardoor ATLOVORMING wordt bevorderd die schematisch wordt weergegeven in het onderste deel van de grafiek (➍).
veroudering of Chroniciteit of beide?
belangrijk was dat veroudering een belangrijke determinant was van adventitia herstructurering en beeldhouwen. Volledig ontwikkelde ATLOs vorm tijdens geavanceerde stadia van atherosclerose maar hun vroege stadia, d.w.z., T/B cel aggregaten, ontstaan parallel aan de vorming van atherosclerotische plaques (16, 27, 41, 42). Inderdaad, deze vroege ATLOs vormen op de leeftijd van ~ 30 weken en bereiken meer gevorderde stadia rond 52 weken tot piek bij 78 weken (16, 41). Vergelijkbare leeftijdsafhankelijke ontwikkelingsstadia van TLOs zijn waargenomen bij andere chronische niet-oplosbare ziekten (1, 42). Deze gegevens geven aan dat ATLO ontwikkeling leeftijdsafhankelijk is en veroudering positief geassocieerd wordt met adventitial beeldhouwen (Figuur 2). Nochtans, is de relatie tussen het verouderen en chronicity moeilijk om in muriene atherosclerose te bestuderen aangezien atherosclerotic plaque ontwikkeling in de aortaboog begint, dan reist gezaaid de aorta om de abdominale aorta bij latere ziektestadia te bereiken die aldus langere periodes van tijd nemen. Er is meer werk nodig om de belangrijke kwestie te verduidelijken of immuuncel-en / of vsmc-senescentie bijdraagt aan ATLO-vorming en welke cellen, d.w.z., Vsmc’ s, ECs, en/of immuuncellen zijn betrokken. Studies in andere vormen van TLO-vorming, zoals die die in de longen en het maag-darmkanaal voorkomen zou erop wijzen dat het de chroniciteit van een aanhoudende inflammatoire weefselreactie eerder dan bonafide verouderingsgebeurtenissen van het immuunsysteem dat cruciaal bijdraagt aan de vorming van ATLOs (43, 44).
nieuw gevormde Adventitia-structuren nemen deel aan de atlo-functie door het bevorderen van Lymfocytenrecirculatie
geavanceerde ATLO-stadia omvatten T/B-celaggregaten, germinale centra in geactiveerde B-celfollikels, lymfevaten, HEV ‘ s in t-celgebieden en extracellulaire leidingnetten (16). Deze belangrijke veranderingen lijken op structuren die doen denken aan die gevonden in secundaire lymfoïde organen waar zij fundamentele aspecten van immune reacties naar antigeen met inbegrip van recirculatie van naïeve lymfocyten bevorderen om hun cognitieve antigenen/autoantigenen te vinden, en het organiseren van affiniteit rijping van B-cellen naar potentiële autoantigenen. Met behulp van adoptive lymfocyt transfer studies, merkten we dat ATLOs sterk verbeteren lymfocyten rekrutering in de arteriële wand door zowel het bevorderen van Immigratie en gelijktijdige verzwakking van emigratie van antigeen-onervaren lymfocyten (27). Na hun rekrutering, worden de cellen van T geactiveerd, beginnen zich te verspreiden, en sommige de helpercellen van CD4 T worden omgezet in veroorzaakte regelgevende cellen van T. Deze gegevens tonen aan dat het immuunsysteem in adventitia zeer responsief is naar de onderliggende inflammatoire weefselreactie van de arteriële wand. Bovendien, lijken de cellen van B die germinal centra in geactiveerde de celfollikelen van B vormen om een germinal centrum reactie in aanwezigheid van folliculaire dendritische cellen te ondergaan waar wat in geheugen B cellen worden omgezet terwijl anderen de germinal centra verlaten om plasmacellen (45) te worden. Wanneer samen genomen, geven deze gegevens aan dat ATLOs eerder dan secundaire lymfoïde organen (zoals eerder gedacht) atherosclerose immuniteit organiseren.
Atlo Vorming is Zeer Territorialized Aangeeft dat de Signalen Van de Plaques aan de Adventitia via Lymfoïde Weefsel Organizer-Zoals VSMCs
een Ander aspect van de adventitia herstructurering tijdens de agents is dat ATLO vorming is zeer territorialized wordt grotendeels beperkt tot de adventitia segmenten naast atherosclerotische plaques in de abdominale aorta in muizen (16, 45). ATLOs worden slechts af en toe gevonden in de adventitia van de innominate slagader of van de aortaboog waar atherosclerose het meest prominent is. Immuuncellen in de thoracale segmenten van de aorta zijn voornamelijk samengesteld uit T-cel aggregaten in vergelijking met ATLOs in de abdominale aorta (16, 41). Het exacte mechanisme voor territorialiteit van ATLOs vorming in de abdominale aorta is nog onbekend. TLOs blijken een kenmerk te zijn van vele chronische niet oplosbare ontstekingsziekten en zijn prominente kenmerken van auto-immuunziekten (42). De cellulariteit en structuren van Tlos in atherosclerose zijn vergelijkbaar met Tlos in vele andere chronische ziekten, waaronder kanker-geassocieerde TLO vorming (46, 47). Het gebied van TLO biologie is dramatisch uitgebreid in de afgelopen jaren het verhogen van de belangrijke mogelijkheid dat nieuw therapeutisch doel kan worden geà dentificeerd via begrip van TLO ‘ s functie in elk van TLO-geassocieerde ziekten. Nochtans, onthullen de verschillende types van TLOs sommige ziekte-specifieke kenmerken, die uiteindelijk kunnen bepalen of de bijbehorende immune reacties schadelijk of beschermend zijn. Dergelijke ziekte-specifieke kenmerken kunnen ontstaan door een van de verschillende mechanismen, waaronder orgaanspecificiteit en de aard van weefselschade (1, 42). De ontwikkeling van lymfoïde organen is een complex proces waarbij hematopoietic lymfoïde weefsel inductor (LTi) cellen, niet-hematopoietic stromale lymfoïde weefsel organizer (LTo) cellen en LTßR signalering. Onze in-vitro studies van muis aorta Vsmc ‘ s gaven aan dat ze na passende stimulatie kunnen dienen als LTo-achtige cellen (20), oorspronkelijk geïdentificeerd tijdens de embryonale ontwikkeling tijdens de vorming van secundaire lymfoïde weefsels, waaronder lymfeklieren en milt (48, 49) (zie hieronder). Het is belangrijk op te merken dat Atlo ’s Vsmc’ s als belangrijke deelnemers lijken te betrekken, terwijl andere TLO ‘ s andere LTo-achtige mesenchymcellen betrekken (50). De gemeenschappelijke noemer van alle vormen van TLOs, echter, lijkt-in tegenstelling tot secundaire lymfoïde organen-een chronische inflammatoire weefselreactie die het immuunsysteem drijft om deze lymfoïde structuren dicht bij of in sommige gevallen binnen het zieke weefsel te vormen (42, 43).
Vsmc ’s dragen rechtstreeks bij tot Adventitia immuniteit bij atherosclerose
gezien de sterk territorialiseerde aard van ATLOs grenzend aan atherosclerotische plaques, redeneerden wij dat Vsmc’ s betrokken kunnen zijn bij ATLOVORMING en op dezelfde manier een functionele rol kunnen aannemen bij atherosclerose progressie. VSMCs drukt zeer constitutief LTßR (16) uit, terwijl zijn ligand LTa1ß2 op diverse immune cellen wordt uitgedrukt die LTI cellen worden genoemd (51). VSMCs wordt verondersteld om door de signalerende weg LTßR-LT door LTI cellen worden geactiveerd die bij secundaire lymfoïde weefselneogenese betrokken zijn. De oorsprong van LTI-cel is nog niet duidelijk bepaald hoewel geactiveerde macrofagen en andere immuuncellen in de intima plaque kandidaten zijn voor deze activiteit in LTO-neogenese. In reactie op cellulaire en oplosbare mediatoren lijken Vsmc ‘ s een verschillend type fenotype te ondergaan dat naar een LTO-achtig fenotype wordt overgeschakeld door paracrinesecretie van de lymforganogene chemokines, d.w.z. CXCL13 en CCL21, waardoor immuuncellen worden aangetrokken, bijv. macrofagen/dendritische cellen, T-cellen en B-cellen naar het lokale adventitia-milieu, wat leidt tot vorming van ATLO in de adventitia (27, 41, 45) (Tabel 1). De algemene of VSMC-specifieke deficiëntie van LTßR in oude hyperlipidemic ApoE−/− muizen toonde verhoogde atherosclerotische plaquevorming aan die erop wijzen dat de Vsmc LTßR de capaciteit heeft om ontwikkeling van atherosclerose onder sommige experimentele omstandigheden te verminderen (27). Andere studies toonden echter aan dat jonge globale ApoE−/− LTbR−/−muizen die onder een vetrijk dieet (HFD) werden gehouden, een lagere aorta plaquelast vertoonden dan hun normale ApoE-/− tegenhangers die met een dieet werden gevoed (52). Deze schijnbare tegenstrijdige gegevens geven aan dat de rollen van LTßR in jonge muizen en onder voorwaarden van bovenmatige hyperlipidemie in de twee modellen verschillend kunnen zijn. Alternatief, kan het vetrijke dieet dat tot dramatische en mogelijk bedwelmende niveaus van plasmalipiden leidt, van deze verschillen de oorzaak zijn. Aangezien we niet regelmatig een vetrijk dieet gebruiken bij ApoE – / – muizen, blijven deze discrepanties onopgeloste kwesties hoewel het is aangetoond dat het immuunsysteem kan worden overweldigd door extreme niveaus van plasmalipiden . Deze gegevens vragen om verdere studies om de moleculaire basis voor de schijnbare dichotomie van LTßR in atherosclerosisvooruitgang in jonge Versus oude muizen en/of vroege Versus gevorderde atherosclerose te onderzoeken. Bovendien kunnen van beenmerg afgeleide macrofagen functioneren als LTßR-onafhankelijke LTI-cellen en leiden tot de expressie van CCL19, CCL20 en CXCL16 door VSMCs (53) (Tabel 1). Aldus, kunnen VSMCs in de vorming van Tlos in atherosclerose door upregulation van lymforganogenic chemokines deelnemen om immune celaggregaten in adventitia te bevorderen. Zoals hierboven vermeld, ATLOs komen vaak voor bij mensen belast door ischemische coronaire hartziekte (40) en bij menselijke atherosclerotische aorta-aneurysma ‘ s (38, 39). Wanneer samen genomen, brengt het voorkomen van ATLOs in experimentele muizen en in menselijke atherosclerose belangrijke vragen betreffende de aard van atherosclerose als auto-immune ziekte op: het is denkbaar dat tijdens atherogenesis de auto-immune T cellen en auto-immune B cellen tegen nog worden geà dentificeerd autoantigens worden geproduceerd. De isolatie van dergelijke auto-immune lymfocyten met inbegrip van het rangschikken van hun t-celreceptoren en/of de celreceptoren van B zou toelaten om belangrijke hypothesen in atherosclerose te testen. Inderdaad, atherosclerose onderzoek zou een belangrijke verschuiving ondergaan en het testen van individuele auto-immune lymfocyt klonen in functionele In vitro en in vivo systemen zou mogelijk worden.
conclusie
atherosclerose is een ontstekingsziekte van slagaders. Vsmc ‘ s communiceren met zowel de ECs als de immuuncellen in de atherosclerotische plaques en residentcellen in de adventitia. Deze capaciteit staat VSMCs toe om atherosclerosisimmuniteit op belangrijke manieren met inbegrip van de vorming van ATLOs te beà nvloeden. Het verdere werk wordt vereist om de rol van VSMCs tijdens verschillende stadia van atherosclerose te omschrijven, hun rol in jonge versus het verouderen slagaders te bepalen, en nader hun dichotomic rollen in ziekteprogressie te verklaren. Een beter begrip van deze processen kan de weg openen om therapeutische strategieën voor toekomstige interventie in klinisch belangrijke late stadia van de ziekte te ontwikkelen.
Auteursbijdragen
alle auteurs hebben bijgedragen aan het ontwerp, het schrijven en de redactie van het ingediende manuscript en hebben het goedgekeurd voor publicatie.
financiering
belangenverstrengeling verklaring
de auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die als een potentieel belangenconflict kunnen worden opgevat.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD et al. Apoptose van vasculaire gladde spiercellen veroorzaakt kenmerken van plaque kwetsbaarheid in atherosclerose. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Owens GK, Kumar MS, WAMHOFF BR. Moleculaire regulering van vasculaire gladde spierceldifferentiatie in ontwikkeling en ziekte. Physiol Rev. (2004) 84: 767-801. doi: 10.1152 / physrev.00041.2003
PubMed Abstract / CrossRef Full Text / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM, et al. KLF4-afhankelijke fenotypische modulatie van gladde spiercellen heeft een belangrijke rol in atherosclerotische plaque pathogenese. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Gomez D, Owens GK. Gladde fenotypische schakeling van spiercellen in atherosclerose. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093/cvr | cvs115
PubMed Abstract | CrossRef Full Text / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento OF, et al. Activering van de pluripotency factor OCT4 in gladde spiercellen is atheroprotectief. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
PubMed Abstract / CrossRef Full Text / Google Scholar
10. Yla-Herttuala S, Bentzon JF, Daemen M, Falk E, Garcia-Garcia HM, Herrmann J, et al. Stabilisatie van atherosclerotische plaques. Position paper of the European Society of Cardiology (ESC) Working Group on atherosclerosis and vascular biology. Tromb Hemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed Abstract / CrossRef Full Text / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, et al. Vasculaire gladde spier celdood, autofagie en senescentie in atherosclerose. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093/cvr / cvy007
PubMed Abstract / CrossRef Full Text / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler s, Doesch AO, Katus HA, et al. De twee gezichten van Interleukin-17A in atherosclerose. Curr Drugsdoelwitten. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed Abstract / CrossRef Full Text / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Insuline-achtige groeifactor-1 en TNF-alfa regelen autofagie via C-jun N-terminaal kinase en AKT-routes in humane atherosclerotische vasculaire gladde cellen. Immunol Cel Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711. 2006. 01454.X
PubMed Abstract / CrossRef Full Text / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, Beer M, et al. Lymfotoxine bèta receptor signalering bevordert tertiaire lymfoïde organogenese in de aorta adventitia van oude ApoE – / – muizen. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Full Text / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T, et al. Verbeterde expressie van de homeostatische chemokines CCL19 en CCL21 in klinische en experimentele atherosclerose: mogelijke pathogene rol in plaque destabilisatie. Arterioscler Tromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Abstract / CrossRef Full Text / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen AE, Skjelland M, et al. Verhoogde niveaus van de homeostatische chemokine CXCL13 in menselijke atherosclerose-potentiële rol in plaque stabilisatie. Aderverkalking. (2012) 224:266–73. doi: 10.1016 / j. atherosclerose.2012.06.071
CrossRef Full Text / Google Scholar
22. Higashi Y, Suchanov S, Shai SY, Danchuk S, Tang R, Snarski P, et al. Insuline-achtige groei factor-1 receptor deficiëntie in macrofagen versnelt atherosclerose en induceert een instabiel plaque fenotype bij apolipoproteïne e-deficiënte muizen. Circulatie. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Abstract / CrossRef Full Text / Google Scholar
23. Alexander MR, Owens GK. Epigenetische controle van gladde spierceldifferentiatie en fenotypische switching in vasculaire ontwikkeling en ziekte. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed Abstract / CrossRef Full Text / Google Scholar
24. He C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R, et al. Pdgfrbeta signalisatie reguleert lokale ontsteking en synergiseert met hypercholesterolemie om atherosclerose te bevorderen. Nat Commun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed Abstract / CrossRef Full Text / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M, et al. Het richten interleukine-1beta beschermt tegen aorta-aneurysma ‘ s die door verstoorde het transformeren van de BÃ ta signaleren van de Groeifactor worden veroorzaakt. Immuniteit. (2017) 47: 959-73 e9. doi: 10.1016 / j.immuni.2017.10.016
CrossRef Full Text / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, et al. Arterie tertiaire lymfoïde organen controleren de aorta immuniteit en beschermen tegen atherosclerose via vasculaire gladde spier cellymfotoxine beta receptoren. Immuniteit. (2015) 42:1100–15. doi: 10.1016 / j.immuni.2015.05.015
PubMed Abstract / CrossRef Full Text / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, et al. Nlrp3 inflammasome uitdrukking en activering in menselijke atherosclerose. J Am Heart Assoc. (2016) 5: e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Full Text / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, Winter C, Ferraro B, et al. Beschermende geschiktheid van annexin A1 in arteriële neointima vorming in atherosclerose-gevoelige muizen-kort rapport. Arterioscler Tromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Full Text / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ, et al. De neuroimmune guidance cue netrin-1 bevordert atherosclerose door de emigratie van macrofagen uit plaques te remmen. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Full Text / Google Scholar
35. Tchkonia T, Zhu Y, Van Deursen J, Campisi J, Kirkland JL. Cellulaire senescentie en het senescent secretoire fenotype: therapeutische mogelijkheden. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed Abstract / CrossRef Full Text / Google Scholar
37. Majesty MW, Horita H, Ostriker A, Lu S, Regan JN, Bagchi A, et al. Gedifferentieerde gladde spiercellen genereren een subpopulatie van residente vasculaire voorlopercellen in de adventitia gereguleerd door Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Abstract / CrossRef Full Text / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, et al. Adventitiële tertiaire lymfoïde orgaanclassificatie bij humane atherosclerose. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j.carpath.2017.08.002
PubMed Abstract / CrossRef Full Text / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, et al. De lamina adventitia is de belangrijkste plaats van immune cel accumulatie in standaard chow-fed apolipoproteïne E-deficiënte muizen. Arterioscler Tromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
PubMed Abstract / CrossRef Full Text / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, et al. Arteriële tertiaire lymfoïde organen dragen bij aan aangeboren en adaptieve immuunresponsen in gevorderde muizenatherosclerose. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
PubMed Abstract / CrossRef Full Text / Google Scholar
43. Buettner M, Lochner M. ontwikkeling en functie van secundaire en tertiaire lymfoïde organen in de dunne darm en de dikke darm. Front Immunol. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Abstract / CrossRef Full Text / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, et al. Arterie tertiaire lymfoïde organen controleren meerlaagse territorialized atherosclerose B-cel responsen in oude ApoE — / — muizen. Arterioscler Tromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Full Text / Google Scholar
48. van de Pavert SA, Mebius RE. Nieuwe inzichten in de ontwikkeling van lymfoïde weefsels. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Full Text / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Stromale fibroblasten in tertiaire lymfoïde structuren: een nieuw doelwit in chronische ontsteking. Front Immunol. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Abstract / CrossRef Full Text / Google Scholar
51. Scandella E, Bolinger B, Lattmann E, Miller S, Favre s, Littman DR, et al. Herstel van lymfoïde orgaanintegriteit door de interactie van lymfoïde weefsel-inducerende cellen met stroma van de T-celzone. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
PubMed Abstract / CrossRef Full Text / Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann S, Klatt C, et al. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar