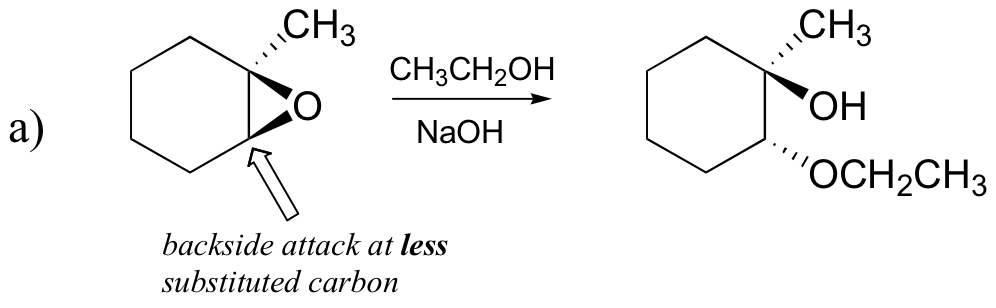
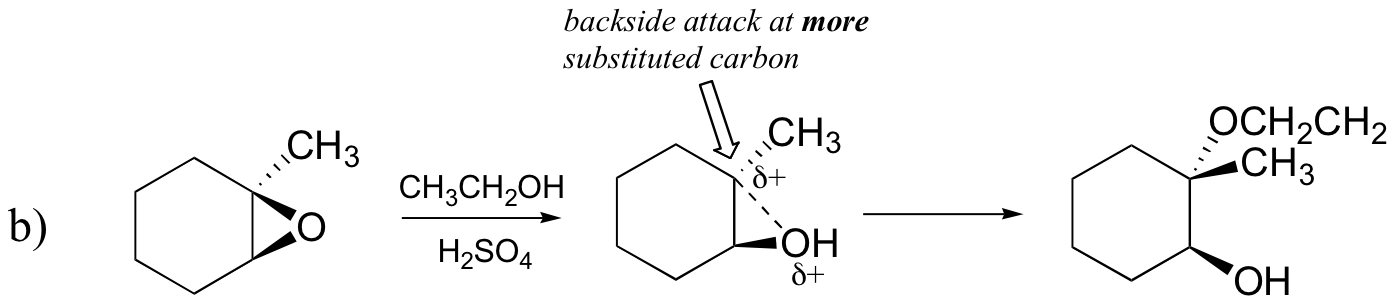
epoxide ring-openings reacties – SN1 vs.SN2, regioselectiviteit en stereoselectiviteit
de niet-enzymatische ring-openings reacties van epoxiden geven een mooi overzicht van veel van de concepten die we al in dit hoofdstuk hebben gezien. De Ring-openings reacties kunnen door of SN2 of SN1 mechanismen verlopen, afhankelijk van de aard van het epoxide en van de reactievoorwaarden. Als het epoxide asymmetrisch is, zal de structuur van het product variëren afhankelijk van welk mechanisme domineert. Wanneer een asymmetrisch epoxide solvolyse ondergaat in basisch methanol, vindt ringopening plaats door een SN2-mechanisme, en de minder gesubstitueerde koolstof is de plaats van nucleofiele aanval, wat leidt tot wat we product B zullen noemen.:

omgekeerd, wanneer solvolyse optreedt in zure methanol, vindt de reactie plaats door een mechanisme met een substantieel SN1-karakter, en de meer gesubstitueerde koolstof is de plaats van aanval. Als gevolg daarvan overheerst product A.

dit zijn beide goede voorbeelden van regioselectieve reacties. In een regioselectieve reactie zijn twee (of meer) verschillende constitutionele isomeren mogelijk als producten, maar één wordt bij voorkeur (of soms uitsluitend) gevormd.
laten we eerst de basic, SN2 case onderzoeken. De leaving group is een alkoxyde anion, omdat er geen zuur beschikbaar is om de zuurstof te protoneren voorafgaand aan het openen van de ring. Een alkoxide is een slechte verliezende groep, en dus is het onwaarschijnlijk dat de ring open gaat zonder een ‘push’ van het nucleofiel.

het nucleofiel zelf is krachtig: een gedeprotoneerd, negatief geladen methoxyde-ion. Wanneer een nucleofiele substitutiereactie een slechte verlaat groep en een krachtig nucleofiel impliceert, is het zeer waarschijnlijk om door een SN2 mechanisme te gaan.
hoe zit het met de elektrofiel? Er zitten twee elektrofiele koolstofatomen in het epoxide, maar het beste doelwit voor het nucleofiel in een SN2-reactie is de koolstof die het minst wordt gehinderd. Dit verklaart het waargenomen regiochemische resultaat. Net als in andere SN2 reacties, vindt nucleofiele aanval plaats vanaf de achterkant, resulterend in inversie bij de elektrofiele koolstof.
waarschijnlijk is de beste manier om de zuurkatalyseerde epoxide ringopening reactie af te beelden als een hybride, of kruis, tussen een SN2 en SN1 mechanisme. Eerst wordt de zuurstof geprotoneerd, waardoor een goede vertrekgroep ontstaat (stap 1 hieronder) . Dan begint de koolstof-zuurstofbinding te breken (stap 2) en begint de positieve lading zich op te bouwen op de meer gesubstitueerde koolstof (denk aan de discussie uit paragraaf 8.4 B over de stabiliteit van de carbocatie).

in tegenstelling tot een SN1-reactie valt het nucleofiel de elektrofiele koolstof aan (Stap 3) voordat een volledig carbocatie-intermediair de kans heeft zich te vormen.

aanval vindt bij voorkeur plaats vanaf de achterkant (zoals in een SN2-reactie) omdat de koolstof-zuurstofbinding nog steeds tot op zekere hoogte aanwezig is, en de zuurstofblokken vallen aan vanaf de voorkant. Merk echter op hoe de regiochemische uitkomst verschilt van de base-gekatalyseerde reactie: in het zuur gekatalyseerde proces, valt het nucleofiel de meer gesubstitueerde koolstof aan omdat het deze koolstof is die een grotere mate van positieve lading bevat.
oefening 8.17:
voorspel het belangrijkste product (en) van de ringopenreactie die optreedt wanneer het onderstaande epoxide wordt behandeld met:
a) ethanol en een kleine hoeveelheid natriumhydroxide
b) ethanol en een kleine hoeveelheid zwavelzuur

Hint: denk aan zowel regiochemie als stereochemie!
video ‘ s van Khan academy

Ringopening onder zure omstandigheden: