26 oktober 2020, door NCI personeel
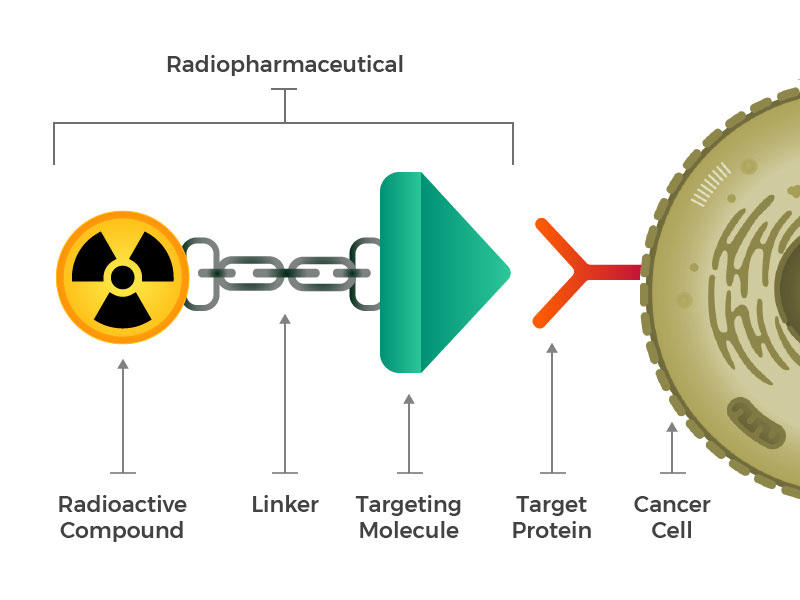
radiofarmaceutica bestaan uit een radioactief molecuul, een het richten molecuul, en een linker die zich bij de twee voegt.
de afgelopen twee decennia hebben een grote verandering gebracht in de manier waarop vele soorten kanker worden behandeld. Gerichte therapieën sluiten specifieke eiwitten in kankercellen af die hen helpen groeien, verdelen en verspreiden. Immunotherapieën stimuleren of onderdrukken het immuunsysteem van het lichaam om kanker te helpen bestrijden. Maar lang gebruikte behandelingen-chirurgie, chemotherapie en radiotherapie — blijven de ruggengraat van de behandeling voor de meeste kankers.
radiotherapie werd meer dan 100 jaar geleden voor het eerst gebruikt voor de behandeling van kanker. Ongeveer de helft van alle kankerpatiënten krijgt het nog steeds tijdens hun behandeling. Tot voor kort werd de meeste bestralingstherapie net zo gegeven als 100 jaar geleden, door stralingsbundels van buiten het lichaam af te leveren om tumoren in het lichaam te doden.
hoewel uitwendige straling effectief is, kan deze ook nevenschade veroorzaken. Zelfs met moderne radiotherapie apparatuur ,” je moet normaal weefsel om een tumor te krijgen, “zei Charles Kunos, M. D., Ph. D., van NCI’ s Cancer Therapy Evaluation Program (CTEP). De resulterende bijwerkingen van bestralingstherapie zijn afhankelijk van het gebied van het behandelde lichaam, maar kunnen verlies van smaak, huidveranderingen, haaruitval, diarree en seksuele problemen omvatten.
nu ontwikkelen onderzoekers een nieuwe klasse geneesmiddelen die radiofarmaceutica worden genoemd en die radiotherapie rechtstreeks en specifiek aan kankercellen leveren. De afgelopen jaren is er een explosie geweest van onderzoek en klinische proeven waarbij nieuwe radiofarmaceutica werden getest.
deze studies hebben gesuggereerd dat gerichte bestralingstherapie op cellulair niveau het risico van bijwerkingen op zowel korte als lange termijn van de behandeling kan verminderen, terwijl tegelijkertijd zelfs kleine afzettingen van kankercellen in het hele lichaam kunnen worden gedood.
” ik denk dat ze radioncologie gaan transformeren in de komende 10 tot 15 jaar,” zei Dr.Kunos.
voortbouwen op een natuurlijke affiniteit
het rechtstreeks aan cellen leveren van straling is op zichzelf geen nieuwe benadering. Een dergelijke therapie, genaamd radioactief jodium, is gebruikt voor de behandeling van sommige soorten schildklierkanker sinds de jaren 1940. jodium natuurlijk accumuleert in schildkliercellen. Een radioactieve versie van het element kan in het lab worden geproduceerd. Wanneer ingenomen (als een pil of een vloeistof), het accumuleert in en doodt kankercellen overgebleven na schildklieroperatie.
een vergelijkbare natuurlijke affiniteit werd later benut om geneesmiddelen te ontwikkelen voor de behandeling van kanker die zich naar de botten heeft verspreid, zoals radium 223 dichloride (Xofigo), dat in 2013 werd goedgekeurd voor de behandeling van gemetastaseerde prostaatkanker. Wanneer kankercellen in het bot groeien, veroorzaken ze dat het botweefsel dat ze binnendringen afbreekt. Het lichaam probeert dan deze schade te herstellen door dat bot te vervangen—een proces dat bot turnover wordt genoemd.
het radioactieve element radium ” ziet eruit als een calciummolecuul, dus wordt het opgenomen in gebieden van het lichaam waar de botomzetting het hoogst is,” zoals gebieden waar kanker groeit, legt Dr.Kunos uit. Het radium is dan in staat om nabijgelegen kankercellen te doden.
deze radioactieve verbindingen reizen allemaal zonder hulp naar kankercellen. Onderzoekers vroegen zich af of het mogelijk zou zijn om nieuwe radioactieve moleculen te ontwikkelen die specifiek gericht zijn op andere kankers.
zij hadden geconstrueerde radiofarmaceutica voor ogen die bestaan uit drie belangrijke bouwstenen: een radioactief molecuul, een doelmolecuul (dat kankercellen herkent en zich specifiek vastklampt) en een linker die de twee verbindt. Dergelijke verbindingen kunnen worden geïnjecteerd, geïnfundeerd, geïnhaleerd of ingenomen, en dan hun weg in de bloedbaan.
het idee om een kankerbestrijdende molecule te koppelen aan een molecuul dat kankercellen doodt, is ook niet nieuw. Bijvoorbeeld, zijn verscheidene drugs genoemd antilichaam-drugconjugaten, waarin een antilichaam dat aan specifieke kankercellen bindt met een giftige drug verbonden is, goedgekeurd voor het behandelen van kanker.
maar pogingen om dergelijke geneesmiddelen te maken hebben weinig succes gehad, legde Dr. Kunos uit, omdat het niet genoeg is dat toxines dicht bij een kankercel worden gebracht. De gifstoffen moeten naar binnen worden genomen en lang genoeg in de cellen blijven om schade te veroorzaken. Veel kankercellen hebben of ontwikkelen mechanismen om gifstoffen gewoon terug te pompen voordat dat kan gebeuren.
radiofarmaceutica werken ook het beste wanneer de geneesmiddelen in cellen kunnen komen. Maar dat is niet nodig om effectief te zijn. Zodra een radiofarmaceuticum aan een kankercel vastzit, breekt de radioactieve verbinding op natuurlijke wijze af. Dit verval geeft energie vrij die het DNA van nabijgelegen cellen beschadigt. En als het DNA van een cel onherstelbaar beschadigd is, sterft die cel. Kankercellen zijn bijzonder gevoelig voor door straling veroorzaakte DNA-schade.
afhankelijk van het gebruikte type radioactieve verbinding kan de resulterende energie de cel binnendringen die gebonden is aan het radiofarmaceuticum en ongeveer 10 tot 30 cellen rond die cel. Dit verhoogt het aantal kankercellen dat met één enkel radiofarmaceutisch molecuul kan worden gedood.Tegen het midden van 2010 had de Food and Drug Administration (FDA) twee radiofarmaceutica goedgekeurd die zich richten op moleculen op bepaalde B-cellen voor de behandeling van sommige mensen met non-Hodgkinlymfoom, een type bloedkanker. Maar deze medicijnen werden nooit op grote schaal gebruikt. Weinig artsen die patiënten met lymfoom behandelen, werden getraind om dit soort radioactieve verbindingen toe te dienen. En de radiofarmaceutica werden geconfronteerd met concurrentie van nieuwere, niet-radioactieve geneesmiddelen.
de game-changer voor het veld kwam in 2018, zei Jacek Capala, Ph. D., van NCI ‘ s Radiation Research Program, toen FDA lutetium Lu 177-dotatate (Lutathera) goedkeurde voor de behandeling van bepaalde kanker neuro-endocriene tumoren (netten) die het spijsverteringskanaal beïnvloeden.
” dit toonde aan dat vaste tumoren ook op deze manier kunnen worden aangepakt,” met een radiofarmaceuticum gebouwd vanaf nul, zei hij. In dit geval, zijn de doelstellingen bepaalde hormoonreceptoren die in overvloed op het oppervlak van netto cellen worden gevonden.
Lutetium Lu 177-dotataat was beter in het vertragen van de netto groei dan enig eerder getest geneesmiddel, aldus Aman Chauhan, arts, van de Universiteit van Kentucky, die verschillende nieuwe klinische studies van het geneesmiddel leidt. “Dit was een enorme stap voorwaarts voor ons veld,” zei hij.
Adapting Drugs from Imaging Compounds
onderzoekers ontwerpen en testen nu radiofarmaceutica voor een reeks van kankers zo divers als melanoom, longkanker, colorectale kanker en leukemie, aldus Dr.Capala. Elke tumor met een doelgericht molecuul op het oppervlak van zijn cellen en een goede bloedtoevoer—voldoende om drugs te leveren—kan mogelijk worden behandeld met radiofarmaceutica, voegde Dr.Chauhan.
veel van deze nieuwere geneesmiddelen zijn herontwikkelde versies van bestaande verbindingen die worden gebruikt voor nucleaire beeldvorming. De nucleaire weergavetests, zoals de tomografie van de positronemissie (PET), gebruiken soms zwak radioactieve samenstellingen verbonden aan molecules die aan specifieke doelstellingen op de oppervlakte van kankercellen binden. Gespecialiseerde camera ‘ s kunnen dan zelfs kleine afzettingen van kankercellen onthullen, wat helpt om de verspreiding van kanker door het lichaam te meten.
onderzoekers hebben deze doelmoleculen nu hergebruikt om in plaats daarvan meer krachtige radioactieve verbindingen of isotopen te vervoeren—die kankercellen kunnen doden in plaats van ze simpelweg te helpen visualiseren.
prostaatkanker is een vroeg testterrein geweest voor deze herbestemming. Een eiwit genaamd PSMA wordt gevonden in grote hoeveelheden—en bijna uitsluitend-op prostaatcellen. Door een molecule te fuseren die aan PSMA aan een radioactieve samenstelling bindt die in de weergave van het PETAFTASTEN wordt gebruikt, hebben de wetenschappers uiterst kleine afzettingen van prostate kanker kunnen visualiseren die te klein zijn om door conventionele weergave te worden ontdekt.
verschillende radiofarmaceutische behandelingen die gericht zijn op PSMA worden nu getest in klinische studies.
de meeste prostaatkankers zijn zeer gevoelig voor straling, en externe straling wordt vaak gebruikt om de ziekte te behandelen, verklaarde Frank Lin, M. D., van NCI ‘ s Center for Cancer Research, die leidt een klinische studie van een PSMA-targeting radiofarmaceuticum in het Klinische Centrum van NIH.
de meeste mannen die bestraling ondergaan als hun eerste behandeling zullen geen herhaling van hun kanker ervaren. Maar als ze dat doen, verspreidt het zich soms door het hele lichaam, met veel kleine afzettingen van kankercellen in veel organen, legde hij uit.
” als de tumor zo is uitgezaaid, kun je niet echt externe straling meer doen, omdat externe straling alleen kan worden gericht op en de behandeling van een klein deel van je lichaam op een moment,” Dr.Lin zei.
het hebben van een radiofarmaceuticum dat zich richt op PSMA is een betere manier om straling in deze gevallen te geven, omdat het direct in de bloedstroom kan worden toegediend en op grote schaal kan circuleren, waarbij het zich hecht aan prostaatkankercellen die zich door het hele lichaam hebben verspreid, legde hij uit.
en een groot voordeel van het hebben van beeldvormings-en behandelingsmoleculen die hetzelfde doel gebruiken, is dat beeldvorming artsen dan een sneak preview kan geven van de kans dat de behandeling zal werken, voegde Dr.Lin toe. In het onderzoek van Dr. Lin bijvoorbeeld, moeten mannen vóór de behandeling een PET-scan hebben met de beeldvormende versie van de stof. Als de weergavesamenstelling zijn weg naar de kankercellen vindt en op het Pet-aftasten wordt ontdekt, dan kunnen de onderzoekers veronderstellen dat de overeenkomstige radiofarmaceutische behandeling zijn doel zal raken.
” deze complementaire ontwikkeling van diagnostiek hand-in-hand met medicijntherapieën maakt dit veld zo veel spannender,” zei Dr.Chauhan. “Op deze manier kunnen we weten dat we de therapie rechtstreeks aan de tumorcellen leveren.”
overgang naar combinatietherapieën
hoewel radiofarmaceutica in vroege studies veelbelovend zijn gebleken, is het ook onwaarschijnlijk dat zij, zoals het geval is met andere soorten kankergeneesmiddelen, een tumor op zichzelf zullen uitroeien.Zo verdubbelde lutetium Lu 177-dotataat bijvoorbeeld meer dan het aantal mensen bij wie hun neuro-endocriene tumoren krimpen na de behandeling, maar dat aantal was nog steeds bescheiden: ongeveer 17%, tegenover 7% zonder de drug, verklaarde Dr.Chauhan.
“er is nog steeds aanzienlijke ruimte voor verbetering,” zei hij.
het gebruik van radiofarmaceutica in combinatie met andere therapieën kan een manier zijn om die verbetering te stimuleren. Sommige onderzoekers testen nu radiofarmaceutica in combinatie met stralingsgevoelige middelen—geneesmiddelen die kankercellen nog kwetsbaarder maken voor straling. Bijvoorbeeld, leidt Dr. Chauhan een klinisch onderzoek van lutetium Lu 177-dotatate gecombineerd met een stralingsensibilisator genoemd triapine, die cellen blokkeert van het produceren van de verbindingen die nodig zijn voor DNA-reparatie na straling-veroorzaakte schade.
in een andere studie test Dr. Lin lutetium Lu 177-dotataat met een type geneesmiddel dat een PARP-remmer wordt genoemd. Deze drugs, die reeds worden goedgekeurd om sommige types van borst, ovariale, en andere kanker te behandelen, blokkeren het proces van de reparatie van DNA zelf. “Dus de straling zou de DNA-schade veroorzaken, en de PARP-remmer zou voorkomen dat de tumorcellen van het helen van hun DNA na de straling,” legde hij uit.
andere onderzoekers combineren radiofarmaceutica met immunotherapieën om de werkzaamheid van deze geneesmiddelen te vergroten. “Recente studies hebben aangetoond dat radiofarmaceutica tumoren beter kunnen reageren op immunotherapie,” zei Dr.Capala.
veel tumoren zijn “koude” tumoren, legde hij uit, omdat immuuncellen ze niet herkennen, of niet goed werken in de micro-omgeving rond tumoren, legde hij uit.
maar wanneer straling kankercellen doodt, kunnen eiwitten en DNA van die cellen in de bloedbaan terechtkomen zodat immuuncellen kunnen zien, waardoor de immuuncellen andere kankercellen in het hele lichaam kunnen herkennen en doden. Radiotherapie kan ook de tumor micro-omgeving meer gastvrij om immuuncellen, voegde Dr. Capala.
samen kunnen deze effecten een koude tumor veranderen in een” hete ” tumor: een tumor die een overvloed aan immuuncellen heeft en kan reageren op immunotherapiemedicijnen. Sommige studies hebben geprobeerd met behulp van externe straling om dit soort reactie te creëren.
” maar er zijn gegevens die suggereren dat het beter werkt als elke tumor, elke metastase, wordt blootgesteld aan straling. Dus radiofarmaceutische therapie heeft een voordeel daar, in dat zodra het in het lichaam bereikt alle metastasen,” Dr.Capala uitgelegd.
het kan zelfs zinvol zijn om radiofarmaceutica te combineren met externe straling, zolang een zorgvuldige planning van de behandeling kan zorgen voor een veilige totale stralingsdosis, voegde Dr.Capala toe. “Externe bestralingstherapie is zeer goed in het richten van grote tumoren, en dan kun je het combineren met radiofarmaceutische therapie te richten metastasen,” zei hij.
uitdagingen en waarschuwingen
het gebied van radiofarmaceutica staat nog in de kinderschoenen. Een uitdaging die de aanpak zal moeten overwinnen voordat ze op grotere schaal kan worden gebruikt, is het tekort aan artsen die zijn opgeleid om dergelijke geneesmiddelen toe te dienen. “Het aantal artsen in de nucleaire geneeskunde in de VS is klein,” zei Dr.Lin, die een opleiding heeft in zowel nucleaire geneeskunde als medische oncologie. “En ik denk dat we maar 70 of 80 nieuwe mensen per jaar trainen.”
tot nu toe heeft dit personeelsgebrek radiofarmaceutica ervan weerhouden hun ware potentieel als een gepersonaliseerde behandeling waar te maken, aldus Dr.Capala. Dat potentieel weerspiegelt het feit dat, in tegenstelling tot andere soorten kankermedicijnen, artsen beeldvorming kunnen gebruiken om precies te meten hoeveel van een radiofarmaceuticum een tumor heeft bereikt, bijna in real time, en de dosis dienovereenkomstig aan te passen.
maar dit soort behandelplanning vereist multidisciplinaire expertise die niet op grote schaal beschikbaar is en heeft ervoor gezorgd dat mensen radiofarmaceutica meer gebruiken als “radioactieve chemotherapie”, met een one-size-fits-all dosis, voegde hij eraan toe. “Dit betekent dat veel patiënten niet krijgen optimale behandeling,” zei Dr. Capala.
ook langetermijn veiligheidsstudies zijn nodig, voegde Dr. Chauhan eraan toe. Mensen die worden behandeld met externe bestralingstherapie kunnen enkele bijwerkingen ervaren, zogenaamde late effecten—zoals de ontwikkeling van tweede kankers—maanden of jaren na de behandeling. Hoewel onderzoek tot nu toe geen hoge mate van late effecten van radiofarmaceutische behandeling heeft aangetoond,” dit zijn zeer nieuwe middelen, en we moeten blijven voorzichtig zijn en toezicht op hen, ” zei hij.
Smoothing Collaborations
omdat deze geneesmiddelen relatief nieuw zijn, zelfs met de proeven aan de gang, “we zijn net het oppervlak van de ontwikkeling van geneesmiddelen voor radiofarmaceutica aan het krassen,” zei Dr.Chauhan.
in 2019 lanceerde het NCI het radiofarmaceutisch Ontwikkelingsinitiatief (RDI) om veelbelovende nieuwe geneesmiddelen sneller in klinische tests te brengen. Eén ding dat het NCI met de RDI hoopt te bereiken, is om meer proeven te doen met combinaties van geneesmiddelen geproduceerd door verschillende farmaceutische bedrijven die anders niet zouden kunnen samenwerken, verklaarde Dr.Kunos, die het initiatief leidt. Zorgen over intellectueel eigendom en een gebrek aan vertrouwen kunnen dergelijke projecten stoppen voordat ze beginnen, legt Dr.Kunos uit.
” dit soort samenwerkingen zou niet noodzakelijk gebeuren tenzij NCI de eerlijke makelaar in het midden was,” zei hij. Op dit moment, slechts ongeveer 2% van de vroege fase studies ondersteund door NCI testen radiofarmaceutica, maar met de RDI dit kan exponentieel groeien in de komende jaren, voegde hij eraan toe.
” we zijn niet van plan om machines of andere technieken die we gebruiken in radiotherapie te elimineren, ” zei Dr.Kunos. “Maar met hun doelgerichte karakter denken we dat radiofarmaceutica de manier waarop we straling gebruiken gaan veranderen.”