Figuur 4: structuur van het oog.Deze afbeelding is afkomstig van Chirstie (ref. 4) en is auteursrechtelijk beperkt volgens de gegeven bron (dat wil zeggen het is niet het eigen werk van de auteurs).
de structuur van het oog: het gebied in het oog (zie figuur 4) dat licht en kleur detecteert, wordt het netvlies genoemd. De tweeotypes van aanwezige opsporingscel, staven en kegels, procesinformatie comingdoor de Lens en sturen het naar beneden de oogzenuw naar de hersenen. De staafcellen (waarvan er rond 100 miljoen zijn) ontdekken de graad van lichtheid die het oog ingaan en hun gevoeligheid is afhankelijk van de hoeveelheid Rhodopsin huidig die zelf binnen de cellen wordt geproduceerd. Nochtans, wordt Rhodopsin vernietigd door te lerenop blootstelling aan licht en daarom werken de staafcellen slechts in weinig licht aangezien hoge verlichting het verminderde niveau van dit lichtgevoelige pigment tot zeer lage gevoeligheid leidt. Kegelcellen (waarvan er ongeveer 3 miljoen zijn) zijn ook gevoelig voor lichtniveaus maar behouden hun functie tot hoge verlichting via het gebruik van het pigment Iodopsine.De detectie van kleur is een functie van de drie soorten kegelcellen die in het netvlies aanwezig zijn: daartussen beslaan ze het zichtbare spectrum. Dit komt omdat elk type gevoelig is voor een ander golflengtebereik met maximumscorresponsen op rood (lang), groen (medium) of blauw (kort).
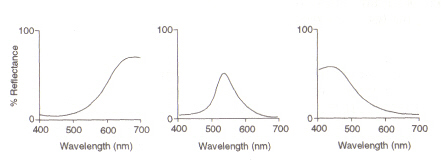
Figuur 5: maxima van respectievelijk (van links) rode, groene en blauwe kegelcellen. Deze afbeelding is afkomstig van Chirstie (ref. 4) en is het auteursrecht beperkt volgens de opgegeven bron (d.w.z. het is niet het eigen werk van de auteurs).
het mechanisme van rhodopsine binnen de Rodcells: het eiwit rhodopsine bevat het protonatedretinal-Schiff ‘ s base complex dat van nature ligt in de intermembraan pocket gevormd door zeven trans-membraan a-helicalreceptoren. Er zijn vele vlakke schijven van rhodopsin binnen het buitensegment van arod cel die op lichte opsporing een foto-isomeric verandering van Rhodopsin (11-cis) aan al-trans netvlies ondergaan. Na de fotoisomerisatiecascade die plaatsvindt via 5 kortsluitintermediaten (stroomdiagram 1), verspreidt het trans-netvlies weg en wordt het terug omgezet in 11-cisretinaal voordat het opnieuw in de cyclus wordt opgenomen. Dit proces vindt plaats via reductie totall-trans-retinol, gevolgd door oxidatie/isomerisatie in het donker. Photoexcitedrhodopsine (4de van de 5 tussenproducten) veroorzaakt een enzymatische cascade proces dat resulteert in de hydrolyse van GMP. Dit sluit op zijn beurt kationspecifieke kanalen met het membraan van de staafcel, die van nature open staan voor instroom van Na+in het donker, en door het effect van hyperpolarisatie, stuurt het binnenste synatische lichaam een zenuwsignaal naar andere neuronen in het netvlies. Ten slotte helpt de licht-geïnduceerde bloei van calciumniveaus het herstel van opgewekte neuronen naar een passieve, “donkere”toestand en de cyclus begint opnieuw bij detectie van licht. Thephotoreceptoren van kegelcellen zijn ook zeven a-helicalreceptoren met 11-CIS-netvlies als hun chromophore. Het detectiebereik varieert van groen tot rood omdat de drie niet-polaire hydroxylbevattende residu ’s nearretinaal sequentieel worden vervangen door polaire residu’ s.

links-Figuur 6: Positie van 11-cis retinale binnen rhodopsine. Deze afbeelding is afkomstig van Stryer (ref. 6) en is het auteursrecht beperkt volgens de opgegeven bron (d.w.z. het is niet het eigen werk van de auteurs).
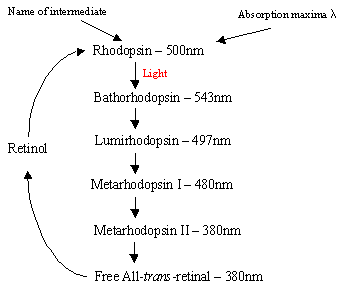
Rechts-Stroomdiagram 1: De 5 tussenproducten van de Rhodopsincyclus.
waar komen Rhodopsin vandaan?
mensen kunnen geen hodopsine maken, in plaats daarvan gebruiken ze en externe bron, b-caroteen,dat in voedsel wordt gevonden om het te synthetiseren:
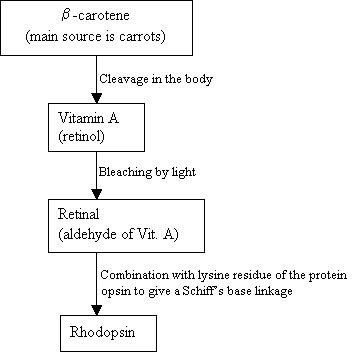 |
stroomdiagram 2: Thesynthese van rhodopsine New picture =Figuur 7: de structuren van b-caroteen (boven), VitaminA (Midden) en 11-cis retinale (onder). |
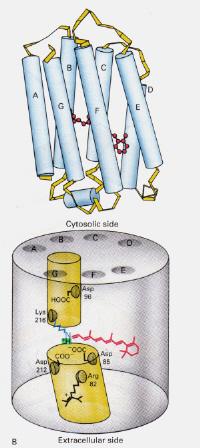
Hoe werkt het mechanisme ofBacteriorhodopsin gevonden in Halobacteria verschillen van die van Rhodopsine gevonden inRod cellen van het menselijk oog?: Deze keer blokkeert het protonated retinale-Schiff ‘ s basecomplex van nature een kanaal door het membraan dat anders door twee aangrenzende kamers wordt gevormd. Het protonated trans complex doneert een proton aan Asp-85 die dan uitgang van dat zelfde proton aan de extracellulaire kant toestaat. De Photoisomerisation aan de structuur 13-cis staat de basis van Schiff toe om een proton van het ASP-96 residu aan de cytosolic kant op te nemen. Na de heroriëntering van het cis-formulier op het trans, wordt de cyclus van isomerisatie en protonpomping voortgezet.