Calmodulin
Dit is een video-inleiding tot het calciumsignaaleiwit calmodulin, vanuit het perspectief van een anorganische chemicus!
Calmodulin, of CaM, is een polypeptide dat alomtegenwoordig is in alle eukaryotic cellen. Dit eiwit staat bekend als calmoduline omdat het een calcium-gemoduleerd eiwit is dat een vitale rol speelt in het proces van calciumsignaaltransductie. De transductie van het calciumsignaal is het proces waardoor de interactie tussen calciumionen en talrijke proteã nen communicatie tussen cellen bemiddelt. de functie van calmodulin is daarom noodzakelijk in alle eukaryotische cellen, en sommige van de taken die het helpt te bereiken zijn zenuwsignalen, skeletspierbeweging en geheugen. Door calciumionen in de omgeving te detecteren, activeert calmoduline en fungeert het vervolgens als een tussenproduct, waardoor de binding van belangrijke eiwitten zoals kinasen in gang wordt gezet en onze cellen worden geholpen bij de basis-en geavanceerde functie (“Calmoduline”).
onderstaande video toont de structurele verandering die optreedt binnen CaM tijdens calciumbinding (PDB-codes 3CLN en 1CFD).
het eiwit zelf is 148 aminozuren in lengte met twee bolvormige gebieden die elk 2 EF-handmotieven bevatten, die karakteristieke plaatsen zijn van calciumgemedieerde polypeptiden. Wanneer calmodulin geactiveerd is, herbergt het 4 Ca2 + – ionen die de vorm van het eiwit drastisch veranderen. Wanneer calmodulin met de calciumionen bindt, opent de proteã ne van zijn apo vorm aan zijn halovorm, die een alpha helix blootstelt die als linker of centrale Tether gebied wordt genoemd geworden. Bedacht voor zijn flexibiliteit, is het centrale tether-gebied de plaats van de proteã ne waarop partnerproteã nen binden en tot de cascade bijdragen die het secundaire berichtenverkeer van calcium is. Op basis van zijn structuur en zijn behoefte aan calciumionen om te functioneren, moet calmoduline in staat zijn om voor calciumionen in het cytoplasma te selecteren, en de interacties tussen het ion en de liganden in de EF handdomeinen ondersteunen dit idee van selectiviteit (Bertini et. al., 635-638).
deze afbeelding toont hoe een EF-handmotief op een hand lijkt. Het lintdiagram links toont een van de vier karakteristieke helix-turn-helix EF handmotieven van calmodulin. (PDB-code 3CLN)
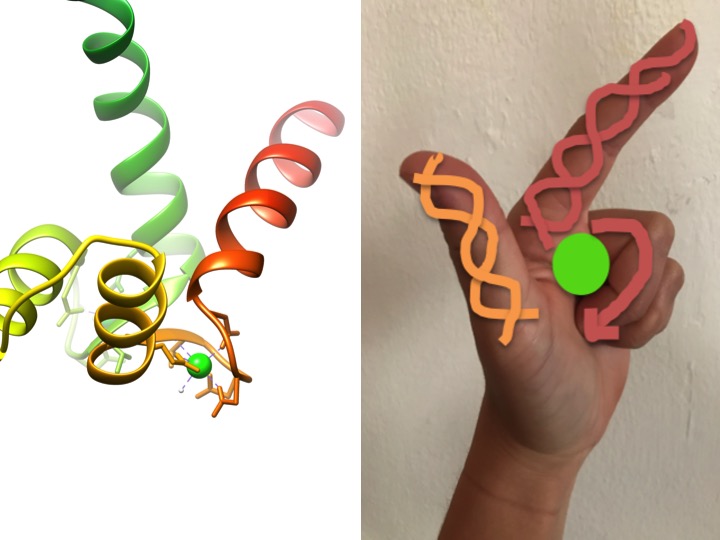
EF-handmotieven zijn sterk behouden structuurgebieden van eiwitten die betrokken zijn bij de binding van calcium. Deze gebieden staan bekend als “hand” motieven omdat ze lijken op een hand die is gemaakt in de vorm van een L, waar het metaal ion is gelegen in het midden van de vuist, de Alfa helices worden aangegeven door de naar boven gerichte wijsvinger en naar binnen gerichte duim, en de gekrulde vingers vertegenwoordigen de draai of lus regio. Dit wordt aangetoond in de figuur hierboven. In een karakteristiek EF-handmotief binden aminozuren waaronder glutamaten, asparagines, asparaginezuur en glutaminezuur aan Ca, evenals aan water (Bertini et. al. 639). De typische EF-hand domein bonding sequentie wordt weergegeven in de afbeelding hieronder.
deze cartoon illustreert de gecoördineerde aminozuren in een typisch EF handdomein (de exacte aminozuursamenstelling varieert!). De gestreepte lijn vertegenwoordigt de coördinatie van Ca met de zuurstof van een backbone carbonyl, terwijl vaste lijnen de coördinatie met zijketens of water aangeven.
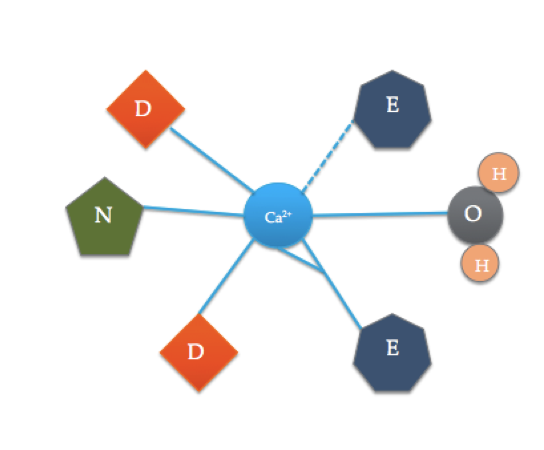
de bindingsplaats van calmoduline verschilt enigszins van het meest typische EF-handdomein hierboven. De 6 liganden van calmodulin omvatten de zijketens van drie asparatische zuren (D), 1 glutaminezuur (E) die twee covalente banden met het ion coördineert, 1 watermolecuul van oplossing, en 1 carbonylmolecuul van de ruggengraat vormt. De bindingsplaats van calmoduline bestaat uit een Ca2+ – ion dat door 6 liganden wordt omgeven en 7 bindingen vormt.
het EF-motief in calmodulin bevat veel van dezelfde liganden, alleen op verschillende plaatsen. Deze bouw kan een idee van waarom calmodulin selectief is voor calcium en hoe slechts de aanwezigheid van een calciumion de bindende plaats kan tevredenstellen die de proteã ne veroorzaakt om te activeren. Dit is gerelateerd aan de thermodynamica van calmoduline binnen de cel en hoe het reageert op de aanwezigheid van calciumionen.
om de thermodynamica te begrijpen die de activering van calmoduline combineert, moet men eerst de concentratie van ionen zoals calcium en magnesium in een eukaryotische cel begrijpen, met inbegrip van die van een mens. De concentratie van deze ionen moet nauwkeurig worden geregeld. Binnen in de cel, calcium signalering gaat gepaard met een tijdelijke verhoging van de concentratie van calciumionen, die wordt waargenomen door eiwitten zoals calmoduline (Bertini et. al., 636). Deze calciumstoot kan te wijten zijn aan intracellulaire g-eiwitten die het ruwe en gladde reticulum veroorzaken om calcium vrij te geven, of de calciumionen kunnen vanuit de extracellulaire ruimte worden gebracht. In het geval van calmoduline reageert het meestal op calcium dat van buitenaf in de cel wordt gebracht, wat optreedt tijdens processen zoals zenuwsignalen (Bertini et. al. 637). Voordat de concentratie van calcium tijdelijk wordt opgeheven, is de concentratie binnen de cel gewoonlijk tussen 10-100 nm, terwijl tijdens de korte instroom van ionen, de concentratie tot 1.000-100.000 nm toeneemt. De verandering in concentratie zorgt ervoor dat de calmoduline de calciumionen aanvoelt, bindt en verdere signaaltransductie in gang zet (Bertini et. al., 635).
hoe bindt calmoduline dan definitief calciumionen en niet bijvoorbeeld magnesiumionen? Mg2 + ionen zijn eigenlijk vrij vergelijkbaar met calciumionen: zij zouden in elektrostatische interactie eerder dan covalent deelnemen, en zij worden beschouwd als harde atomen. De reden dat calmoduline calciumionen lijkt te verkiezen boven magnesiumionen is gerelateerd aan de bindingsconstanten van elk ion. Calmoduline kan bestaan terwijl gebonden aan andere ionen, zoals magnesium, maar als er een hogere concentratie van calcium is, zullen de calciumionen onmiddellijk concurreren met de magnesiumionen om calciumbindingsplaatsen te bezetten. Dit komt omdat de bindingsconstante van CaM en Ca2+ (Ka) groter is dan die van CaM en Mg2+, zoals weergegeven in Figuur 7. Dit geeft aan dat calmoduline, wanneer het aan calciumionen wordt gebonden, meer producten zou produceren. Men moet al deze ideeën overwegen rekening houdend met het feit dat dit proces ontelbare keren per seconde gebeurt, en de omzet van dit eiwit verandert om te reageren op de steeds gemoduleerde calciumconcentratie van de cel.
Waarom is calmodulinebinding met calciumionen gunstiger dan met andere metalen? Het kan vanwege de grootte van de ionen in relatie tot de sterische hinder veroorzaakt door de liganden. De bindingsplaats wordt gekenmerkt door 6 liganden Die 7 coördinaatbindingen vormen. Omdat calciumionen groter zijn dan magnesiumionen, zoals blijkt uit Figuur 8, is het mogelijk dat calcium wordt begunstigd omdat het de afstand van de liganden van elkaar verhoogt, waardoor de sterische interacties tussen de liganden afnemen. De structuur van het eiwit zelf kan ook een reden vormen voor de selectiviteit van calciumionen. Over het algemeen is het bekend dat als gevolg van thermodynamica op basis van variërende cellulaire concentratie van calciumionen, calmoduline de toename van ionen zal voelen, hen zal binden en zal helpen om zijn functie uit te voeren.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + Mg2+
omdat KCaM-Ca > KCaM-Mg
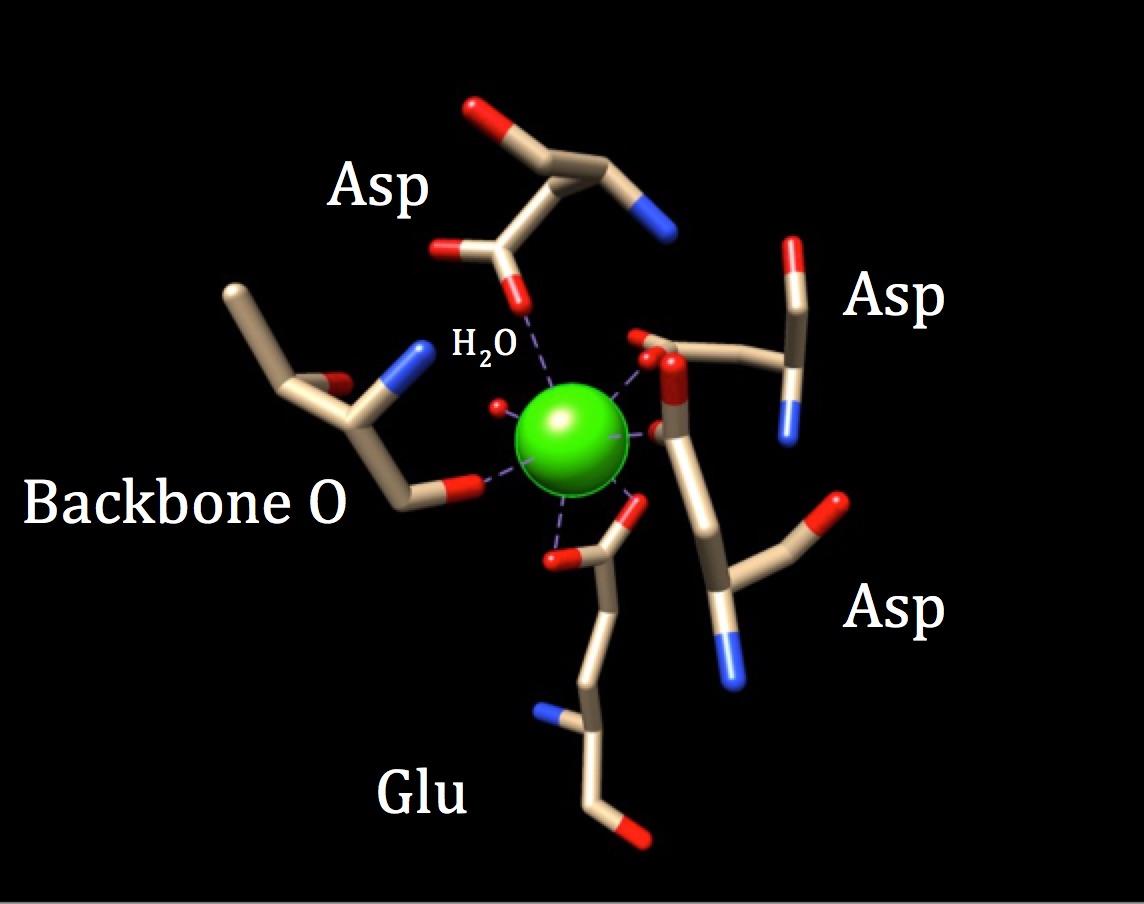
In een verdere bespreking van de chemie van de bindingsplaats van calmodulin, de coördinatie van de geometrie, moeten worden onderzocht. Omdat het calciumion met zeven donoratomen samenwerkt, staat het systeem bekend als een heptadentaatsysteem. Omdat calmodulin omgeven is door zes liganden, zou men een octaëdrische coördinatiemeetkunde aannemen. Maar, omdat een van de liganden op een bidentate manier met het ion interageert-wat betekent dat het twee coördinaat covalente bindingen heeft die van verschillende atomen in één aminozuur komen—neemt het coördinatiecomplex een vervormde octaëdrale vorm aan. De specifieke coördinatie wordt in onderstaande figuur beschreven.
de coördinatiegeometrie van de calciumbindingsplaats van calmoduline. Het centrum calcium metaal ion is omgeven door drie asparagines (Asp), een backbone zuurstof, een gluatmic zuur (Glu) en een watermolecuul. (PDB-code 3CLN)
We kunnen ook verwijzen naar de theorie van het chelaateffect om de capaciteit van calmoduline beter te begrijpen om aan metaalionen met hoge affiniteit te binden. Een chelator is een atoom dat met meer dan één donoratoom kan binden. Polydentaatbinding is gerelateerd aan het chelaateffect, dat stelt dat wanneer een ligand bindt met veel donorgroepen (poly), de coördinaatcovalente bindingen veel sterker zijn, of strakker worden vastgehouden. Deze theorie wordt ondersteund door thermodynamica, met name dat polydentaatbinding de entropie van een systeem verhoogt, waardoor het positiever (meer wanorde) wordt, wat thermodynamisch gunstig is. Het toepassen van deze theorie op calmoduline helpt niet alleen het belang van de polydendaatbinding binnen de sites zelf te verklaren, maar ook de noodzaak voor het eiwit om 4 verschillende calciumionen te binden om zijn functie te activeren. Door hoofdzakelijk de binding van vier Ca2+ – ionen binnen de sites te vereisen, stimuleert het systeem een toename van entropie door meer substraten/reagentia te introduceren om een groter aantal producten te vormen. Dit komt wegens het hogere aantal band binnen de ligandinteracties van elke bindingsplaats voor. Al met al, wordt de band van het calciumion in de plaatsen van het polypeptide gesteund door de theorie van het chelaateffect en werpen licht op calmodulin ‘ s efficiency in het binden van calcium.
EF – handmotieven hebben een bepaalde structuur gebaseerd op het feit dat calcium het centrale metaal is. Dit geldt ook voor de calmodulinebindingsplaatsen. Het Ca2 + – ion bindt met dezelfde atomen in de structuren van bepaalde aminozuren op basis van een theorie die Hard/zacht zuur-Base theorie wordt genoemd. Deze theorie scheidt metalen en liganden in twee categorieën die op de polariseerbaarheid en hun lading aan straalverhouding worden gebaseerd. Harde zuren en basen zijn kleinere ionen die een grotere last aan grootteverhouding hebben, en dit leidt hen om op elektrostatische manieren in wisselwerking te staan (betekenend aantrekkingen tussen + en – ladingen), terwijl zachte zuren en basen groter in grootte zijn en daarom een kleinere Last aan straalverhouding hebben, die hen ertoe leiden om banden met covalent karakter te maken. De uitdrukking “als bindt met als” verwijst naar het feit dat harde zuren en basen de neiging hebben om te interageren met andere harde atomen, en hetzelfde geldt voor zachte zuren en basen. Ca2+ wordt gekarakteriseerd als een hard zuur omdat, hoewel het een grote straal heeft, het in wisselwerking staat met liganden op een meestal elektrostatische manier. Wanneer men kijkt naar de calcium-bindende plaats van calmoduline, kan men zien dat het calciumion aan zuurstofatomen van de 3 asparaginezuur, glutaminezuur, water, en backbone carbonyl bindt. Deze band is in lijn met “als bindt met als” omdat het water en de aminozuren ligands, glutamic zuur en asparatisch zuur, door zuurstofdonors binden die als harde basissen worden gekenmerkt. Figuur 10 herbekijkt de bindingsplaatsen van calmodulin terwijl ook de negatieve zijkanten van de aminozuren worden getoond die met de calciumionen zouden interageren die in blauw worden aangeduid.
wat betreft de donoratomen van de gebonden liganden en hun vermogen om elektronenparen te doneren aan het coördinatiecomplex, legt de spectrochemische reeks uit hoe de atomen interageren met het centrale metaal. In het geval van de calciumbindingsplaats worden de zuurstofhoudende stoffen die interageren met het Ca2+-ion beschouwd als σ-En π-donoren omdat de zuurstofhoudende stoffen 2 of meer paren elektronen bezitten. De categorieën van de spectrochemische seires die elektronenbeschikbaarheid en-donatie specificeren hebben implicaties voor spin-aanduiding (laag of hoog), die aangeeft hoe d-elektronen hun orbitalen vullen, en delta (Δ) Grootte tussen de d-orbitalen van het metaal, maar dit maakt geen verschil voor calcium omdat de d-orbitalen van calcium niet bezet zijn door een afwezigheid van valentie d-elektronen. Dit maakt de d orbitalen hoofdzakelijk verwaarloosbaar in de meeste gesprekken betreffende de proteã ne. Een uitzondering is gerelateerd aan het overwegen van de labiliteit van het calciumion in het systeem.
het gebrek aan elektronen in de d-orbitalen van Ca levert nul ligandveldstabilisatieenergie op en verklaart de hoge labiliteit van het calciumion. Labiliteit verwijst naar de snelheid waarmee liganden kunnen worden vervangen in coördinatiecomplexen, en beschrijft daarom de kinetiek van een systeem. Atomen zijn labiel als ze snel liganden uitwisselen. Vanwege zijn pertinente functie in alle eukaryotische cellen, calmoduline wordt verwacht om calciumionen miljoenen keren per seconde te binden en vrij te geven om berichten van omringende cellen door de overdracht van calciumionen te verzenden en te ontvangen. Bij calmodulin ‘ s vermogen om Ca2+ snel te binden en vrij te geven, is het belangrijk om de bezetting van valentie d elektron orbitalen te overwegen. Zoals gezegd, calcium bezit lege valentie d orbitalen. Deze onbezette orbitalen kunnen een verklaring geven voor de labiliteit van een Ca2+ ion. Omdat alle d-orbitalen van het calciumion leeg zijn, bezit het een ligand-veldstabilisatieenergie (LFSE) van 0. Dit wijst erop dat het calcium onstabiel is wanneer het overwegen LFSE toe te schrijven aan het feit dat stabiele molecules gewoonlijk een negatieve waarde voor LFSE hebben. Instabiliteit vertaalt zich in dit geval in een bereidheid om snel te reageren en op en af complexen te bewegen, wat de bewering ondersteunt dat Ca2+ – ionen snelle reacties aanmoedigen en als labiel kunnen worden gekarakteriseerd. Hoewel dit contra-intuïtief lijkt te zijn voor de discussie over het chelaateffect, is het duidelijk dat deze twee theorieën elkaar niet tegenspreken. De stabiliteit van de strak gehouden coördinatiebanden die door het chelaateffect wordt voorgesteld moedigt calmoduline aan om lang genoeg stabiel te blijven om supplementeiwitten te binden. Zodra dat is voltooid en de concentratie van calcium keert terug naar normaal, is het efficiënt in het strippen van de plaats van de calciumionen.
Calmoduline, gebaseerd op de structuur en de samenstelling van de vitale bindingsplaats, speelt een integraal onderdeel van talloze processen die door eukaryotische cellen worden uitgevoerd. Door het accepteren en binden van calciumionen in signaaltransductie, calmoduline fungeert als een centrale component van het basis-en hoog-niveau functioneren in organismen zoals mensen. Door bio-anorganische theorie toe te passen en inzicht te krijgen in de subtiel gemonitord omgeving van een eukaryotische cel, kan men het vermogen van calmoduline goed begrijpen om voor calciumionen te selecteren en verdere werking aan te moedigen waarbij meer dan 100 partnereiwitten betrokken zijn.