dit bericht werd bijgedragen door Kurt Thorn van het Nikon Imaging Center aan de UCSF.
een veelvoorkomende vereiste voor experimenten met levende cellen is het vermogen om meerdere fluorescent gelabelde soorten gelijktijdig te volgen. Om dit met fluorescente eiwitetiketten te doen vereist veelvoudige fluorescente proteã nen waarvan opwinding en emissiespectra voldoende voor hen verschillen om in verschillende fluorescente kanalen op de microscoop te worden imaged. Met de proliferatie van fluorescente proteã nen in recente jaren, zijn er vele fluorescente eiwitcombinaties die samen kunnen worden imaged, maar dit betekent ook dat de keus van fluorescente proteã nen één of andere gedachte vereist.

de eerste stap bij het kiezen van fluorescente eiwitten voor uw multi-color imaging experiment is om zich bewust te zijn van welke fluorescente eiwitten beschikbaar zijn. Met nieuwe fluorescente proteã nen die elke maand worden gepubliceerd, is het beslissen over de beste proteã Ne voor een bepaalde toepassing een uitdaging. Om u op de hoogte te houden van de nieuwste fluorescerende eiwitten, houd ik een interactieve grafiek en tabel bij van de beste fluorescerende eiwitten die momenteel beschikbaar zijn.
compatibele fluorescente eiwitten
om een set fluorescente eiwitten te kiezen die samen worden afgebeeld, moet u rekening houden met dezelfde factoren als bij het kiezen van een individueel fluorescerend eiwit (helderheid, fotostabiliteit, enzovoort; zie de vorige blogpost voor meer discussie over deze factoren). Daarnaast moet u ook fluorescente eiwitten kiezen die van elkaar kunnen worden onderscheiden en die kunnen worden afgebeeld met de optica op de microscoop(s) die u wilt gebruiken. Een nauwkeurige bepaling van of twee fluorescente proteã nen van elkaar kunnen worden gescheiden vereist kennis van hun opwinding en emissiespectra, maar een goede vuistregel is dat zowel de piekopwekkingsgolflengten als de piekemissiegolflengte van de twee proteã nen door 50-60 nm zouden moeten worden gescheiden. Bijvoorbeeld, CFP (ex 430 nm / em 474 nm) en YFP (ex 514 nm / em 527 nm) kunnen samen worden imaged maar CFP en GFP (ex 488 nm / em 507 nm) tonen sommige kruisverwijzing tussen de twee fluorescente proteã nen. Als u de fluorescente proteã nen moet weergeven waarvan de spectra overlappen, zijn er technieken, zoals spectral unmixing, die kunnen worden gebruikt om de fluorescente proteã nen te scheiden, maar deze zijn buiten het toepassingsgebied van deze post.
zijn uw fluorescerende eiwitten compatibel met de optica van uw microscoop?
om te bepalen of de fluorescerende eiwitten waarin u geïnteresseerd bent compatibel zijn met de optica van uw microscoop, wilt u de excitatie-en emissiespectra van uw eiwit vergelijken met de filtersets of lasers op uw microscoop. Idealiter, zou u wezenlijke overlapping tussen de opwinding en emissiefilters en de opwinding en emissiespectra van de proteã ne willen hebben, zodat de proteã ne goed door uw microscoop wordt opgewekt en de fluorescentieemissie van de proteã ne efficiënt door de microscoop wordt verzameld. Om de match tussen een fluorescerend eiwit en een filterset te vergelijken, bieden veel leveranciers van filterset hulpmiddelen om de fluorescentiespectra van eiwitten en kleurstoffen en hun filters te plotten (zie Chroma ‘s, Semrock’ s, of Omega ‘ s). Terwijl deze niet alle fluorescente proteã nen in gemeenschappelijk gebruik (in het bijzonder niet recent gepubliceerde degenen) bevatten, kunnen zij een goed uitgangspunt zijn. In veel gevallen is het voldoende om een spectrum te gebruiken voor een nauw verwant eiwit, als je weet dat je eiwit van belang een vergelijkbaar spectrum heeft. Bijvoorbeeld, hier is een screenshot van de chroma Spectra Viewer vergelijken van een standaard Cy3 of Rhodamine filter set (Chroma # 49004) aan de spectra van zowel mCherry en TagRFP.
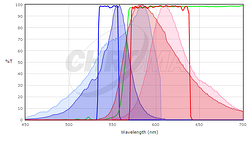
hier wordt het TagRFP-spectrum weergegeven in de donkere kleuren en het mcherry-spectrum in de lichtere kleuren; excitatiespectra zijn blauw en emissiespectra zijn rood. Evenmin is een perfecte overeenkomst met de filterreeks maar het opwindingsfilter wekt meer van de piek van de excitatie van TagRFP op en het emissiefilter verzamelt een grotere fractie van de emissie van TagRFP dan de mcherry-emissie. Voor deze filterset zouden we verwachten dat TagRFP een helderder signaal geeft dan mCherry. In het algemeen, zullen de filterreeksen die voor Rhodamine / Cy3 worden ontworpen beter met kortere golflengterode fluorescente proteã nen zoals TagRFP of mRuby2 dan langere golflengteproteã nen zoals mCherry werken. Voor achtergrondinformatie over fluorescentie en filtersets, zie de inleiding tot fluorescentiemicroscopie lezing op iBiology.
veelgebruikte filtersets & relevante fluorescente eiwitten
veelgebruikte filtersets voor multicolor beeldvorming zijn onder andere ontworpen voor CFP, YFP en RFP of de Sedat Quad-filterset, ontworpen voor DAPI / fluoresceïne / Rhodamine / Cy5 (bv. Semrock ‘ s) en de vergelijkbare 4-lasercombinatie op een confocale (405 / 488 / 561 / 640 nm). In onze handen zijn de beste fluorescente proteã nen voor weergave met deze reeks mTagBFP2, EGFP of één van de betere varianten van GFP, mRuby2 of TagRFP-T, en een infrarood fluorescente proteã ne zoals iFP1.4 of iFP2.0. Pas op dat deze infrarood fluorescente proteã nen biliverdin als cofactor vereisen en Zo kan u uw cellen met biliverdin voor maximale helderheid moeten aanvullen. In zoogdiercellen, is één van de betere vouwvarianten van EGFP zoals mEmerald of Klaver waarschijnlijk het beste; mNeonGreen is een nog nieuwere groene fluorescente proteã ne die uiterst helder wordt verondersteld te zijn. In S. cerevisiae, we hebben een aantal groene en rode fluorescerende eiwitten Getest met deze filterset en hebben helderheidsmetingen gerapporteerd. Hier presteert EGFP beter dan de verbeterde vouwvarianten, vermoedelijk door de lagere groeitemperatuur. Dit suggereert echter ook dat er geen enkel fluorescerend eiwit optimaal is voor alle organismen en dat als u het helderste signaal wilt, u mogelijk verschillende eiwitten in uw systeem van belang moet proberen. Tenslotte, in deze reeks proteã nen zijn de groene en rode proteã nen over het algemeen het meest opspoorbaar en zo zouden moeten worden gebruikt om uw minst overvloedige proteã nen, met de blauwe en infrarode kanalen te markeren die voor overvloediger proteã nen of het merken compartimenten worden gebruikt.
ik hoop dat dit licht werpt op multicolor beeldvorming met fluorescerende eiwitten. Met de juiste microscoop en de juiste keuze van fluorescerende eiwitten, zou Vier Kleuren tegelijkertijd vrij eenvoudig moeten zijn.
Hartelijk dank aan onze gastblogger!Kurt Thorn is universitair hoofddocent aan de UCSF, waar hij het Nikon Imaging Center leidt. Hij promoveerde in de biofysica aan de UCSF in het laboratorium van Ronald Vale, waarna hij fellow was aan het Bauer Center for Genomics Research aan de Harvard University. Meer informatie op zijn lab webpagina of zijn microscopie blog.