Streszczenie
Tło
wrodzony pionowy talus jest zdefiniowany jako deformacja stopy, w której kość piętowa znajduje się w równiku, kość skokowa jest zgięta podeszwowo i występuje sztywne i nieredukowalne zwichnięcie kompleksu stawu szponowo-grudkowego, z przegubowe na grzbietowo-bocznej stronie szyi Talara. Często wiąże się to z zaangażowaniem systemowym.
ma na celu
zidentyfikowanie najczęstszych anomalii towarzyszących CVT (wrodzony pionowy kości skokowej). W przeglądzie literatury nie znaleziono literatury opisującej podobne dane kliniczne.
projekt badania
CVT ma działanie ogólnoustrojowe i towarzyszy mu wiele anomalii. W tym samym czasie, w którym przeprowadzono badanie, często stwierdzano anomalie towarzyszące CVT. Celem pracy jest ocena prenatalnych, urodzeniowych i pourodzeniowych wyników klinicznych związanych z wrodzonym skokiem pionowym.
metody
w latach 2012-2018 do badania włączono łącznie 20 pacjentów z CVT (12 mężczyzn, 8 kobiet). Uwzględniono dzieci w wieku od 0 do 18 lat, które zgłosiły się do kliniki dysmorfologii na badanie.
wyniki
w tym badaniu wykryto pięć parametrów związanych z CVT. Należą do nich wewnątrzmaciczne opóźnienie wzrostu, niedotlenienie w wywiadzie urodzeniowym, hipotonia, małogłowie i wnętrostwo.
wniosek
wymagane jest szczegółowe i multidyscyplinarne podejście do CVT.
słowa kluczowe
Microcephaly, Vertical talus, Intrauterine Growth retardation
wprowadzenie
wrodzone pionowe talus is rare. Pierwsze kliniczne, anatomiczne, patologiczne i roentgenograficzne badanie tego schorzenia zostało opublikowane przez Henkena w 1914 roku. Wrodzony pionowy kości skokowej, znany również jako wrodzony wypukły koślawość kości skokowej, jest rzadką deformacją stopy charakteryzującą się stałym zwichnięciem grzbietowym w talarze głowy i szyi. Częstość występowania szacuje się na 1 na 10 000. Około połowa wszystkich przypadków (idiopatycznych) wiąże się z deformacją, A 2-5 zaburzeniami nerwowo-mięśniowymi i genetycznymi w pozostałych przypadkach. Istnieją dowody na to, że niektóre odosobnione deformacje są przenoszone jako cecha autosomalna dominująca z niepełną penetracją . Deformacja jest również znana z wrodzonej” rocker-bottom ” flatfoot ze względu na sztywną deformację ze zgięciem grzbietowym przedniej stopy i zgięciem podeszwowym tylnej stopy. Często używa się także określenia „wrodzony wypukły koślawiec”. Aby postawić jednoznaczną diagnozę, ważne jest, aby wykazać, że przewód jest zwichnięty grzbietowo na szyi kości skokowej, gdy stopa jest utrzymywana w skrajnym zgięciu podeszwowym . Wrodzone pionowe kości skokowe charakteryzują się koślawością kończyn tylnych, koślawością kończyn tylnych, uprowadzeniem przodostopia i zgięciem grzbietowym w stawie śródstopia. Jest to zwykle rozpoznawane w okresie noworodkowym przez sztywność deformacji, ale musi być odróżniony od bardziej typowej stopy kości piętowej, tylnego przyśrodkowego pochylenia piszczeli i elastycznego płaskostopia. W wrodzonym pionowym kości skokowej powierzchnia podeszwowa stopy jest wypukła, tworząc wygląd rocker-bottom .
Dysmorfologia pozwala na identyfikację pojawiających się przed i po porodzie nienormatywnych form ludzkich, które umożliwiają identyfikację i klasyfikację różnych wad wrodzonych. Termin ten zapewnia porównywalny opis wszystkich cech ciała (wzrostu, stóp, dłoni, szyi) i twarzy (takich jak kształt głowy, długość nosa, położenie uszu, grubość cynobru itp.) osób z tej samej grupy wiekowej i tego samego pochodzenia etnicznego. Należy podejrzewać etiologię genetyczną, jeśli dziecko ma dysmorficzne widzenie z jedną z tych cech: (a) wadami wrodzonymi; (b) opóźnieniem wzrostu; (c) opóźnieniem rozwoju i niepełnosprawnością intelektualną lub regresją rozwojową; (d) nierozwiniętymi cechami płciowymi; (e) niejednoznacznymi narządami płciowymi .
dokładna etiologia pionowego kości skokowej w większości przypadków nie jest znana. Teorie obejmują zwiększone ciśnienie wewnątrzmaciczne i wynikające przykurcze ścięgien lub zatrzymanie rozwoju płodu występujące między 7 a 12 tygodniem ciąży .
nieprawidłowości genetyczne związane z pionowym talusem obejmują aneuploidię chromosomu 13, 15 i 18. Opisano również różne zespoły, w których pionowy kość skokowa jest objawem klinicznym. Zespół De Barsy ’ ego jest rzadkim zespołem genetycznym charakteryzującym się ciężką cutis laxa, nadmierną ruchliwością stawów, opóźnieniem wzrostu, opóźnieniem umysłowym i charakterystycznymi twarzami; objawy ortopedyczne obejmują zwichnięcie biodra, skoliozę i wrodzony pionowy kości skokowej .
wewnątrzmaciczne ograniczenie wzrostu (IUGR) ryzyko opóźnienia wzrostu. Wynika z faktu, że płód nie łapie potencjału wzrostu określonego z powodu zaburzeń anatomicznych i / lub funkcjonalnych .
obwód głowy dostarcza szorstkich informacji o objętości wewnątrzczaszkowej. Pomiar obwodu głowy jest pośrednią i prostą metodą obliczeniową stosowaną do określenia, czy wzrost mózgu postępuje normalnie. Wzrost wokół głowy jest bardzo ważny dla rozwoju mózgu .
hipotonia odnosi się do upośledzenia, które może być związane z wieloma różnymi schorzeniami, w tym schorzeniami nerwowo-mięśniowymi, genetycznymi, ośrodkowego układu nerwowego, tkanki łącznej i (lub) pochodzenia metabolicznego . Klinicznie napięcie mięśni jest oceniane poprzez ocenę odporności na bierne rozciąganie, podczas gdy hipotonia jest definiowana jako zmniejszenie napięcia mięśniowego. Uważa się, że skurcz mięśni i sztywność mięśni, ścięgien i tkanek miękkich przyczyniają się do napięcia mięśniowego. Jako fizjologiczną podstawę hipotonii zasugerowano patologię mechanizmu odruchu napięciowego i zmniejszenie pobudliwości segmentowej puli neuronów ruchowych .
wnętrostwo to brak przynajmniej jednego jądra w mosznie (ryc. 1). Częstość występowania wnętrostwa jest wysoka i prawie 3% chłopców w krajach zachodnich są operowane na tej choroby. Nieprawidłowości w osi podwzgórze-przysadka-jądro może prowadzić do wnętrostwa, a wnętrostwo jest prawie prawie obecne u osób z jądrem i nieprawidłowym różnicowaniem płciowym .
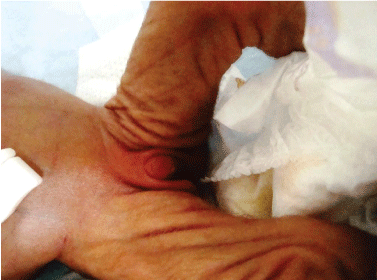 Rysunek 1: trisomia 18 (zespół Edwarda) dzieci z wnętrostwem. Zobacz Rysunek 1
Rysunek 1: trisomia 18 (zespół Edwarda) dzieci z wnętrostwem. Zobacz Rysunek 1
zbadano występowanie niedotlenienia w okresie poporodowym. W tym celu zbadano wynik Apgar urodzeniowy pacjentów. W tym samym czasie pacjenci ci byli obserwowani przez długi czas w klinice genetycznej medycznej. Zwłaszcza, czy hipotonina była obecna, czy nie. Badano czasy rozwoju motorycznego, rozwoju języka i stadia rozwoju społecznego.
wynik APGAR używany do dobrego samopoczucia płodu jest kolejnym parametrem, który zakwestionowaliśmy. Wynik ten obejmuje kolor, tętno, odruchy, napięcie mięśni i oddychanie. Istnieją 3 kategorie zgodnie z wynikami wyniku APGAR; niski (0-3); średni (4-6) i normalny (7-10). Niskie wyniki Apgar przy urodzeniu są konsekwentnie związane ze zwiększonym ryzykiem chorób neurologicznych, takich jak porażenie mózgowe, padaczka i zaburzenia funkcji poznawczych .
materiały i metody
w latach 2012-2018 do badania włączono łącznie 20 pacjentów z CVT (12 mężczyzn, 8 kobiet).
poddano szczegółowej analizie dokumentację szpitalną pacjentów i zidentyfikowano nieprawidłowości związane z CVT. Zeskanowano zapisy pacjentów z okresu prenatalnego. W okresie prenatalnym badano charakterystykę płodu. Ruchy płodu, małowodzie, wielowodzie, wewnątrzmaciczne opóźnienie wzrostu. Ponadto badano powikłania u matek, takie jak nadciśnienie tętnicze, cukrzyca, stan przedrzucawkowy.
badano trzy parametry dotyczące obrotu urodzeniowego pacjentów. Styl urodzenia, Waga urodzenia i czas urodzenia. Jeśli preferowano cesarskie cięcie, zbadano przyczynę tego.
zebrane dane zostały przeanalizowane przez pakiet statystyczny dla nauk społecznych w wersji 18.0 (SPSS Inc., SPSS IBM, Armonk, NY, USA). Dane ciągłe wyrażono jako średnie ± odchylenie standardowe (zakres: minimum-maksimum), natomiast dane kategoryczne oznaczono jako liczby lub, w stosownych przypadkach, procent. Do porównań statystycznych użyto testu chi-kwadrat. Przyjęto, że dwubiegunowe wartości p mniejsze niż 0,05 są istotne statystycznie.
wyniki
w badaniu najczęstsze choroby współistniejące stwierdzono u pacjentów z CVT.
IUGR (intrauterine Growth retardation) wykryto u 16 z 20 pacjentów (80%) w okresie prenatalnym. Otrzymali diagnozę IUGR w 20 tygodniu ciąży. Średnia masa urodzeniowa dzieci wynosi 1980 gr.
u wszystkich 12/20 pacjentów wynik APGAR w 5.minucie wynosił od 4 do 7 (łagodny niedotlenienie porodowe) wynik APGAR w 4/12 okazał się mniejszy niż 4. (Ciężki niedotlenienie niedokrwienny uraz porodowy.) Tych 4 pacjentów obserwowano przez długi czas na oddziale intensywnej terapii noworodków.
obwód głowy pacjentów był obserwowany przez 2 lata od urodzenia. W rezultacie mikrocefalia wykryto przy urodzeniu u 12/20 pacjentów. Średni obwód głowy tych pacjentów wynosił 33 cm. stwierdzono, że pacjenci, którzy mieli małogłowie przy urodzeniu, byli podobnie małogłowie w wieku 2 lat.
w przypadku badań przesiewowych zapisów tych pacjentów drugim stwierdzeniem jest hipotonia w połowie z tych wyników (10/20 pacjentów).
wnętrostwo wykryto u 8 z 12 mężczyzn. Wykryty wnętrostwo było obustronne.
ponadto analiza chromosomów u 20 pacjentów wykazała trisomię 18 U 6 pacjentów (fig. 2 i Fig.3). Wyniki chromosomów u pozostałych 14 pacjentów były prawidłowe.
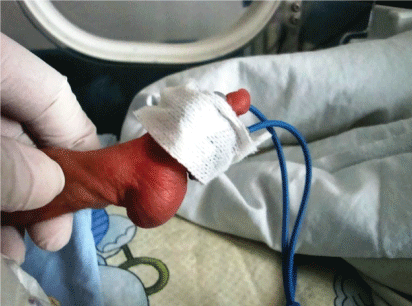 Rysunek 2: trisomia 18 (zespół Edwarda) dzieci z pionowym skokiem lewej stopy. Zobacz Rysunek 2
Rysunek 2: trisomia 18 (zespół Edwarda) dzieci z pionowym skokiem lewej stopy. Zobacz Rysunek 2
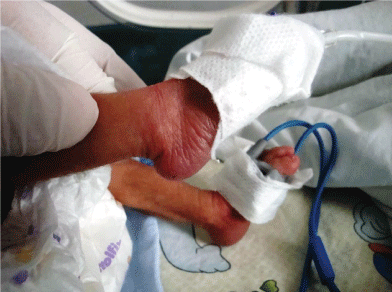 ryc. 3: trisomia 18 (zespół Edwarda) dzieci z pionowym skokiem prawej stopy. Zobacz Rysunek 3
ryc. 3: trisomia 18 (zespół Edwarda) dzieci z pionowym skokiem prawej stopy. Zobacz Rysunek 3
dyskusja
w literaturze nie znaleziono żadnego artykułu badającego podobne dane kliniczne. Dlatego trudno jest porównać dane naszych pacjentów z literaturą.
w literaturze nie znaleziono informacji na temat wewnątrzmacicznego opóźnienia wzrostu w przypadkach CVT. W badaniu przeprowadzonym przez Romo, et al. W 2009 r. częstość występowania IUGR w populacji ogólnej wynosiła od 3% do 7%. W porównaniu do populacji ogólnej i pacjentów z CVT, wskaźnik IUGR był znacznie wyższy (80%) u pacjentów z CVT.
zgodnie z naszymi wynikami w tym badaniu, anomalie neurologiczne u pacjentów z CVT można podzielić na 2 główne kategorie. Są to: choroby ośrodkowego układu nerwowego i choroby nerwowo-mięśniowe (częstość obu przypadków była jednakowa).
w literaturze istnieje bardzo niewiele publikacji opisujących związek wnętrostwa z CVT. Pionowy kości skokowej i wnętrostwo są powszechne w wielu przypadkach zespół pterygium.
w badaniu przeprowadzonym przez Merrilla i współpracowników, 36% pacjentów z CVT miało chorobę nerwowo-mięśniową (taką jak porażenie mózgowe, Mielomeningocel, zespół regresji ogonowej, wodogłowie) . Nieprawidłowości mózgu płodu są najczęstszym stwierdzeniem związanym z wrodzonym skokiem pionowym, występującym w 63% naszych przypadków. Nieprawidłowe warunki były zwykle ciężkie i obejmowały mikrocefalia,anomalie migracji, móżdżek, móżdżek i niedorozwój móżdżku, oprócz malformacji Chiariego II związanej z przepukliną szpikową. Podczas gdy przydatne w ocenie USG przy wzroście głowy, MRI znalazł ważną pomoc w identyfikacji nieprawidłowości mózgu, zwłaszcza migracji i sulcation anomalie .
46% pacjentów w tym badaniu ma nieprawidłowości w obrębie kręgosłupa, takie jak skolioza, przepuklina szpikowa i przewód na uwięzi. Chociaż wady rozwojowe kręgosłupa mogą być łatwo postrzegane przez USG, przewód i położenie stożka są lepiej oceniane z MRI .
był związany z CVT i trisomią 13, 15 i 18. 25% pacjentów w badaniu Rubio i wsp. miał nieprawidłowości chromosomowe, które są trisomią 18 (najczęstszą anomalią chromosomową w tym badaniu.). Jest to zgodne z wcześniejszymi badaniami opisującymi skojarzenie stopy dolnej z aneuploidią trisomii 13, 15 i 18 . W naszych badaniach anomalie chromosomowe były trisomią 18, którą wykryliśmy najczęściej. U 6 z 20 chorych (30%) stwierdzono trisomię 18.
wnioski
w tym badaniu stwierdzono, że 5 parametrów często wiąże się z przypadkami CVT. Te parametry; wewnątrzmaciczne opóźnienie wzrostu, niedotlenienie, hipotonia, małogłowie i wnętrostwo. Kość skokowa pionowa jest chorobą wielowymiarową i potrzebne jest wielodyscyplinarne podejście. Pionowe przypadki kości skokowej należy szczegółowo zbadać pod kątem badań prenatalnych, urodzeniowych i pourodzeniowych.
- Ogata K, Schoenecker PL, Sheridan J (1979) Congenital vertical talus and its family occurrence: an analysis of 36 patients. Clin Orthop Relat Res 128-132.
- Hack M, Breslau N, Weissman B, Aram D, Klein N, et al. (1991) Effect of very low birth weight and subnormal head size on cognitive abilities at school age. N Engl J Med 325: 231-237.
- Lloyd Roberts GC, Spence AJ (1958) Congenital vertical talus. J Bone Joint Surg Br 40: 33-41.
- Dobbs MB, Purcell DB, Nunley R, Morcuende ja (2006) Early results of a new method of treatment for idiopathic congenital vertical talus. J Bone Joint Surg Am 88: 1192-1200.
- Coleman SS, Stelling III FH, Jarrett J (1970) Pathomechanics and treatment of congenital vertical talus. Clin Orthop Relat Res 70: 62-72.
- Hamanishi C (1984) Congenital vertical talus: Classification with 69 cases and new measurement system. J Pediatr Orthop 4: 318-326.
- Alaee F, Boehm s, Dobbs MB (2007) a new approach to the treatment of congenital vertical talus. J Ortopeda Dziecięca 1: 165-174.
- Hunter AGW (2002) genetyka medyczna: 2 podejście diagnostyczne do dziecka z objawami dysmorficznymi. CMAJ 167: 367-372.
- Featherstone K, Latimer J, Atkinson P, Pilz DT, Clarke a (2005) Dysmorfologia i spektakl kliniki. Sociol Heal Illn 27: 551-574.
- Wallenstein MB, Harper LM, Odibo AO, Roehl KA, Longman RE, et al. (2012 fetal congenital heart disease and intrauterine Growth restriction: a retrospektywne badanie kohortowe. J Matern Neonatal Med 25: 662-665.
- Salam RA, Das JK, Bhutta ZA (2014) wpływ wewnątrzmacicznego ograniczenia wzrostu na długoterminowe zdrowie. Curr Opin Clin Nutr Metab Care 17: 249-254.
- GravesAB, Mortimer JA, Larson EB, Wenzlow a, Bowen JD, et al. (1996) obwód głowy jako miara rezerwy poznawczej. Związek z ciężkością upośledzenia w chorobie Alzheimera. Br J 169: 86-92.
- Sacco R, militarni R, Frolli a, Bravaccio C, Gritti A, et al. (2007) kliniczne, morfologiczne i biochemiczne korelaty obwodu głowy w autyzmie. Biol Psychiatry 62: 1038-1047.
- American Physical Therapy Association. Sekcja pediatrii. Pediatric physical therapy: The official journal of the Section on Pediatrics of the American Physical Therapy Association. Lippincott Williams & Wilkins.
- Cortes D (1998) wnętrostwo — aspekty patogenezy, histologii i leczenia. Scand J Urol Nephrol Suppl 196: 1-54.
- Tweed EJ, Mackay DF, Nelson SM, Cooper SA, Pell JP (2016) pięciominutowy wynik Apgar i wyniki edukacyjne: retrospektywne badanie kohortowe 751 369 dzieci. Arch Dis Child Fetal Neonatal Ed 101: 121-126.
- (2006) Wynik Apgar. Adv Neonatal Care 6: 220-223.
- Romo a, Carceller R, Tobajas J (2009) Intrauterine Growth retardation (IUGR): Epidemiology and etiology. Pediatr Endocrinol Rev 3: 332-336.
- Konya mn, Elmas m, Özdemir Ç (2017) Analiza zaburzeń dysmorficznych układu mięśniowo-szkieletowego 20 płodów. Eklem Hastalik Cerrahisi 28: 114-120.
- Chen H, Chang CH, Misra RP, Peters HA, Grijalva NS, et al. (1980) Multiple pterygium syndrome. Am J Med Genet 7: 91-102.
- Merrill LJ, Gurnett CA, Connolly AM, Pestronk a, Dobbs MB (2011) Zaburzenia mięśni szkieletowych i czynniki genetyczne związane z pionowym talusem. Clin Orthop Relat Res 469: 1167-1174.
- Rubio EI, Mehta N, Blask AR, Bulas DI (2017) Prenatal congenital vertical talus (rocker bottom foot): marker dla anomalii wielosystemowych. Pediatr Radiol 47: 1793-1799.
Cytowanie
Muhsin E (2018) Wspólne Anomalie Związane Z Wrodzonym Talusem Pionowym: Doświadczenie Pojedynczego Ośrodka. „Int J Foot Ankle” – 2: 013 doi.org/10.23937/ijfa-2017/1710013