26 de outubro de 2020, pelo NCI Pessoal
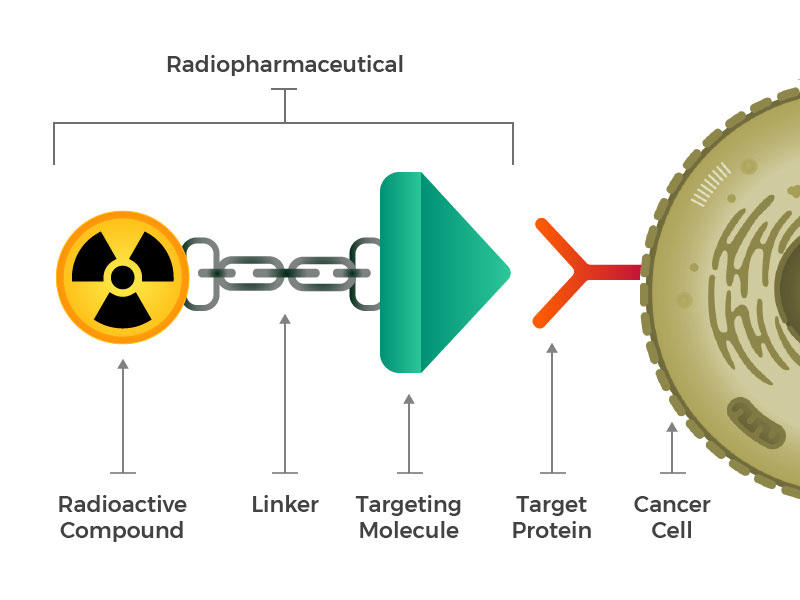
os radiofármacos consistem de uma molécula radioativa, uma molécula de alvo, e um linker que une os dois.
As duas últimas décadas trouxeram uma mudança radical na forma como muitos tipos de câncer são tratados. Terapias específicas desligam proteínas específicas em células cancerosas que os ajudam a crescer, dividir e espalhar. Imunoterapias estimulam ou suprimem o sistema imunológico do organismo para ajudar a combater o câncer. Mas tratamentos de longa duração-cirurgia, quimioterapia e radioterapia — continuam a ser a espinha dorsal do tratamento para a maioria dos cancros. A radioterapia foi utilizada pela primeira vez para tratar o cancro há mais de 100 anos. Cerca de metade de todos os doentes com cancro ainda a recebem em algum momento durante o tratamento. E até recentemente, a maioria da terapia de radiação foi dada tanto quanto era 100 anos atrás, entregando feixes de radiação de fora do corpo para matar tumores dentro do corpo.
embora eficaz, a radiação externa também pode causar danos colaterais. Mesmo com equipamentos modernos de radioterapia, “você tem que tecido normal para chegar a um tumor”, disse Charles Kunos, M. D., Ph. D., do programa de Avaliação da terapia do câncer do NCI (CTEP). Os efeitos colaterais resultantes da terapia de radiação dependem da área do corpo tratado, mas pode incluir perda de gosto, alterações da pele, perda de cabelo, diarréia e problemas sexuais.
actualmente, os investigadores estão a desenvolver uma nova classe de medicamentos denominados radiofármacos, que fornecem radioterapia directa e especificamente para as células cancerígenas. Nos últimos anos, assistiu-se a uma explosão de estudos e ensaios clínicos que testaram novos radiofármacos. Estes estudos sugeriram que a terapia de radiação dirigida a nível celular tem potencial para reduzir o risco tanto de efeitos secundários a curto como a longo prazo do tratamento, ao mesmo tempo que permite que mesmo pequenos depósitos de células cancerígenas sejam mortos em todo o corpo. “Eu acho que eles vão transformar a oncologia da radiação nos próximos 10 a 15 anos”, disse o Dr. Kuno.Desenvolver uma afinidade Natural com as células não é uma nova abordagem. Uma dessas terapias, chamado iodo radioativo, tem sido usado para tratar alguns tipos de câncer da tiróide desde os anos 40. iodo naturalmente se acumula em células da tiróide. Uma versão radioativa do elemento pode ser produzida no laboratório. Quando ingerido (como um comprimido ou um líquido), acumula-se e mata as células cancerígenas deixadas após a cirurgia da tiróide.
uma afinidade natural semelhante foi mais tarde explorada para desenvolver medicamentos para o tratamento do câncer que se espalhou para os ossos, como o dicloreto de rádio 223 (Xofigo), que foi aprovado em 2013 para o tratamento do câncer de próstata metastático. Quando as células cancerosas crescem no osso, fazem com que o tecido ósseo que invadem se quebre. O corpo então tenta reparar este dano substituindo aquele osso-um processo chamado rotatividade óssea.
o rádio do elemento radioactivo “parece uma molécula de cálcio, por isso é incorporado em áreas do corpo onde a rotação óssea é mais elevada”, tais como áreas onde o cancro está a crescer, explicou o Dr. Kuno. O rádio é então capaz de matar as células cancerosas próximas.Estes compostos radioactivos viajam para as células cancerígenas sem qualquer ajuda. Os investigadores questionaram-se se seria possível criar novas moléculas radioactivas que visassem especificamente outros cancros.
eles imaginaram produtos radiofarmacêuticos projetados que consistem em três blocos de construção principais: uma molécula radioativa, uma molécula de alvo (que reconhece e Tranca especificamente em células cancerosas), e um linker que une os dois. Tais compostos podem ser injetados, perfundidos, inalados ou ingeridos, e então fazer o seu caminho para a corrente sanguínea.
a ideia de ligar uma molécula de alvo do cancro a uma molécula que mata as células cancerígenas também não é nova. Por exemplo, vários fármacos chamados conjugados anticorpos, nos quais um anticorpo que se liga a células cancerígenas específicas Está ligado a um fármaco tóxico, foram aprovados para o tratamento do cancro.
mas os esforços para criar essas drogas tiveram sucesso limitado, explicou o Dr. Kuno, porque não é suficiente que as toxinas sejam levadas para perto de uma célula cancerosa. As toxinas têm de ser levadas para dentro e permanecer dentro das células o tempo suficiente para causar danos. Muitas células cancerosas têm ou desenvolvem mecanismos para simplesmente bombear toxinas para fora antes que isso possa acontecer.
os radiofármacos também funcionam melhor quando as drogas podem entrar nas células. Mas isso não é necessário para serem eficazes. Uma vez que um radiofármaco se tenha agarrado a uma célula cancerosa, o composto radioactivo decompõe-se naturalmente. Este decaimento liberta energia que danifica o ADN das células próximas. E quando o ADN de uma célula está irreparavelmente danificado, essa célula morre. As células cancerígenas são particularmente sensíveis a danos de ADN induzidos pela radiação.
dependendo do tipo de composto radioactivo utilizado, a energia resultante pode penetrar na célula ligada ao radiofármaco, bem como cerca de 10 a 30 células circundantes dessa célula. Isto aumenta o número de células cancerígenas que podem ser mortas com uma única molécula radiofarmacêutica.
em meados da década de 2010, a Food and Drug Administration (FDA) aprovou dois radiofármacos que visam moléculas em certas células B para tratar algumas pessoas com linfoma não-Hodgkin, um tipo de cancro do sangue. Mas estas drogas nunca foram amplamente adotadas. Poucos médicos que tratavam pacientes com linfoma foram treinados para administrar estes tipos de compostos radioativos. E os radiofármacos enfrentavam a concorrência de drogas mais recentes e não radioativas.
O divisor de águas para o campo veio em 2018, disse Jacek Capala, Ph. D., do NCI Radiação Programa de Pesquisa, quando a FDA aprovou lutetium Lu 177-dotatate (Lutathera) para o tratamento de certos cancerosas tumores neuroendócrinos (Redes) que afetam o sistema digestivo.
” isso mostrou que tumores sólidos também podem ser direcionados desta forma”, com um radiofármaco construído a partir do zero, disse ele. Neste caso, os alvos são certos receptores hormonais encontrados em abundância na superfície das células líquidas.
Lutetium Lu 177-dotatate foi melhor retardando o crescimento LÍQUIDO do que qualquer outra droga testada, explicou Aman Chauhan, M. D., da Universidade de Kentucky, que está levando vários novos ensaios clínicos da droga. “Este foi um grande passo em frente para o nosso campo”, disse ele.
adaptar medicamentos a partir de compostos imagiológicos
os investigadores estão agora a conceber e testar radiofármacos para uma gama de cancros tão diversos como melanoma, cancro do pulmão, cancro colorectal e leucemia, disse o Dr. Capala. Qualquer tumor que tenha uma molécula targetable na superfície de suas células e um suprimento de sangue bom—suficiente para entregar drogas—poderia potencialmente ser tratado com radiofármacos, acrescentou o Dr. Chauhan.
muitas destas drogas mais recentes são versões re-projetadas de compostos existentes usados para imagiologia nuclear. Testes de imagem Nuclear, como tomografia de emissão de positrões (PET), às vezes usam compostos fracamente radioativos ligados a moléculas que se ligam a alvos específicos na superfície das células cancerosas. Câmeras especializadas podem então revelar até mesmo pequenos depósitos de células cancerosas, ajudando a medir a propagação do câncer através do corpo.Os pesquisadores agora reajustaram essas moléculas de alvo para transportar compostos radioativos mais potentes, ou isótopos, em vez de que poderiam matar células cancerosas em vez de simplesmente ajudar a visualizá—las.
o cancro da próstata tem sido um campo de testes precoce para esta reprogramação. Uma proteína chamada PSMA é encontrada em grandes quantidades—e quase exclusivamente—nas células da próstata. Ao fundir uma molécula que se liga a PSMA a um composto radioativo usado na tomografia de tomografia, os cientistas têm sido capazes de visualizar pequenos depósitos de câncer de próstata que são muito pequenos para serem detectados por imagens convencionais.
vários tratamentos radiofarmacêuticos que o PSMA alvo está agora a ser testado em ensaios clínicos.
Maioria dos cancros da próstata são muito sensíveis à radiação e a radiação externa é comumente usado para tratar a doença, explicou Frank Lin, M. D., do NCI Centro para a Pesquisa do Câncer, que está conduzindo um estudo clínico de um PSMA-segmentação radiopharmaceutical no NIH do Centro Clínico.
a maioria dos homens que recebem radiação como seu tratamento inicial não experimentará uma recorrência de seu câncer. Mas se o fizerem, às vezes se espalha por todo o corpo, com muitos pequenos depósitos de células cancerosas em muitos órgãos, explicou.
“quando o tumor se espalhou assim, você realmente não pode fazer mais radiação de feixe externo, porque a radiação externa só pode ser focada e tratar uma pequena parte do seu corpo de cada vez”, disse Dr. Lin.
ter um radiofármaco que visa PSMA é uma melhor maneira de dar radiação nestes casos, porque pode ser infundida diretamente na corrente sanguínea e circular amplamente, anexando-se às células cancerígenas da próstata que se espalharam por todo o corpo, explicou.
E uma grande vantagem de ter moléculas de imagem e tratamento que usam o mesmo alvo é que a imagem pode, em seguida, dar aos médicos uma prévia esgueirada de se o tratamento é provável de funcionar, acrescentou Dr. Lin. Por exemplo, no ensaio do Dr. Lin, os homens devem fazer uma tomografia com a versão imagiológica do composto antes do tratamento. Se o composto de imagem Encontrar o seu caminho para as células cancerosas e for detectado na tomografia PET, então os investigadores podem assumir que o tratamento radiofarmacêutico correspondente atingirá o seu alvo.
“este desenvolvimento complementar de diagnósticos lado a lado com terapias de drogas torna este campo muito mais emocionante”, disse o Dr. Chauhan. “Desta forma podemos saber que estamos entregando a terapia diretamente para as células tumorais.”
movendo-se para terapias combinadas
enquanto os radiofármacos têm mostrado promessa em estudos iniciais, eles também são, como é o caso de outros tipos de drogas cancerígenas, improvável de eliminar um tumor por conta própria.
por exemplo, o lutécio Lu 177-dotatato mais do que duplicou o número de pessoas que tiveram seus tumores neuroendócrinos encolher após o tratamento, mas esse número ainda era modesto: cerca de 17%, acima de 7% sem a droga, explicou o Dr. Chauhan. “Ainda há espaço significativo para melhorias”, disse ele.A utilização de radiofármacos em combinação com outras terapêuticas pode ser uma forma de conduzir essa melhoria. Alguns pesquisadores estão agora testando radiofármacos combinados com sensibilizadores de radiação—drogas que tornam as células cancerígenas ainda mais vulneráveis à radiação. Por exemplo, o Dr. Chauhan está a conduzir um ensaio clínico de lutécio Lu 177-dotatato combinado com um sensibilizador de radiação chamado triapina, que impede as células de produzir os compostos necessários para a reparação do ADN após danos causados pela radiação.
noutro ensaio, O Dr. Lin está a testar o lutécio lu 177-dotatato com um tipo de medicamento chamado inibidor da PARP. Estes medicamentos, que já são aprovados para tratar alguns tipos de câncer de mama, ovário e outros, bloqueiam o próprio processo de reparação do DNA. “Assim, a radiação causaria os danos ao DNA, e o inibidor de PARP impediria as células do tumor de curar seu DNA após a radiação”, explicou.
outros investigadores estão a combinar radiofármacos com imunoterapias para tentar aumentar a eficácia destes medicamentos. “Estudos recentes mostraram que os radiofármacos podem tornar os tumores mais sensíveis à imunoterapia”, disse a Dra. Capala.
muitos tumores são tumores “frios”, explicou ele, em que as células imunitárias não os reconhecem, ou não funcionam corretamente no microambiente em torno de tumores, explicou.
mas quando a radiação mata as células cancerígenas, as proteínas e o ADN dessas células podem derramar-se na corrente sanguínea para as células imunitárias verem, o que pode permitir que as células imunes para reconhecer e matar outras células cancerosas em todo o corpo. A radioterapia também pode tornar o microambiente do tumor mais hospitaleiro para as células imunitárias, acrescentou o Dr. Capala.Juntos, estes efeitos podem transformar um tumor frio em um tumor” quente”: um que tem uma abundância de células imunes e pode ser sensível às drogas de imunoterapia. Alguns estudos tentaram usar radiação externa para criar este tipo de resposta.Mas há dados que sugerem que funciona melhor se cada tumor, cada metástase, for exposto a radiação. Assim, a terapia radiofarmacêutica tem uma vantagem lá, na medida em que, uma vez que está no corpo, atinge todas as metástases”, explicou o Dr. Capala.Pode até fazer sentido combinar radiofármacos com radiação externa, desde que um planeamento cuidadoso do tratamento possa garantir uma dose global de radiação segura, acrescentou o Dr. Capala. “A radioterapia externa é muito boa em atingir grandes tumores, e então você pode combiná-la com terapia radiofarmacêutica para atingir metástases”, disse ele.
desafios e precauções
o domínio dos radiofármacos ainda está nos seus primeiros dias. Um dos desafios que a abordagem terá de superar antes de poder ser mais amplamente utilizada é a escassez de médicos treinados para administrar tais medicamentos.
“o número de médicos da medicina nuclear nos EUA é pequeno”, disse Dr. Lin, que tem treinamento em medicina nuclear e oncologia médica. “E acho que só treinamos 70 ou 80 pessoas novas por ano.”
até agora, esta escassez de mão-de-obra tem mantido os radiofármacos de viver até seu verdadeiro potencial como um tratamento personalizado, explicou Dr. Capala. Esse potencial reflete o fato de que, ao contrário de outros tipos de medicamentos cancerígenos, os médicos podem usar imagens para medir exatamente quanto de um radiofármaco atingiu um tumor, quase em tempo real, e ajustar a dose em conformidade.
mas este tipo de planeamento do tratamento requer uma experiência multidisciplinar que não está amplamente disponível e deixou as pessoas a utilizarem radiofármacos mais como “quimioterapia radioactiva”, com uma dose única para todos os tamanhos, acrescentou. “Isso significa que muitos pacientes não estão recebendo o tratamento ideal”, disse o Dr. Capala.São também necessários estudos de segurança a longo prazo, acrescentou o Dr. Chauhan. As pessoas tratadas com radioterapia externa podem sentir alguns efeitos colaterais, chamados efeitos tardios-tais como o desenvolvimento de segundo câncer—meses ou anos após o tratamento. Embora a pesquisa até agora não tenha mostrado uma alta taxa de efeitos tardios do tratamento radiofarmacêutico, “estes são agentes muito novos, e temos que continuar a ser cautelosos e monitorá-los”, disse ele.
colaborações de alisamento
porque estas drogas são relativamente novas, mesmo com os testes em curso, “estamos apenas coçando a superfície do desenvolvimento de drogas para radiofármacos”, disse o Dr. Chauhan.
em 2019, para aumentar ainda mais os ensaios de novos medicamentos radiofarmacêuticos promissores, o NCI lançou a iniciativa de desenvolvimento radiofarmacêutico (IDI) para acelerar os novos medicamentos prometedores para os ensaios clínicos.
Uma coisa NCI espera alcançar com a RDI é corretor de mais ensaios usando combinações de medicamentos produzidos por diferentes empresas farmacêuticas que podem não colaborar de outra forma, explicou o Dr. Kunos, que lidera a iniciativa. As preocupações sobre a propriedade intelectual e a falta de confiança podem parar esses projetos antes de começarem, explicou o Dr. Kuno.
“estes tipos de colaborações não aconteceria necessariamente a menos que o NCI fosse o corretor honesto no meio”, disse ele. Neste momento, apenas cerca de 2% dos ensaios de fase inicial apoiados pelo NCI estão testando radiofármacos, mas com a IDR isso pode crescer exponencialmente nos próximos anos, acrescentou.”Não vamos eliminar máquinas ou outras técnicas que usamos na radioterapia”, disse o Dr. Kuno. “Mas com a sua natureza específica, pensamos que os radiofármacos vão transformar a forma como usamos a radiação.”