Figura 4: Estrutura do olho.Esta imagem é tirada de Chirstie (ref. 4) e é restrita a direitos de autor de acordo com a fonte dada (isto é, não é o próprio trabalho dos autores).
a estrutura do olho: a área dentro do olho (ver Figura 4) que detecta a luz e a cor é a chamada Retina. Os twotipos de células de detecção presentes, varas e cones, processam informação através da lente e enviam-na pelo nervo óptico para o cérebro. As células Rod (das quais existem cerca de 100 milhões) detectam o grau de leveza que entra no olho e a sua sensibilidade depende da quantidade de Rodopsin presente que é ela própria gerada dentro das células. No entanto, a rodopsina é destruída devido à exposição à luz e, por conseguinte, as células-máquina só funcionam com uma luz baixa, à medida que a iluminação elevada reduz o nível deste pigmento fotossensível conduz a uma sensibilidade muito baixa. As células cones (das quais existem cerca de 3 milhões) também são sensíveis aos níveis de luz, mas mantêm a sua função até alta iluminação através do uso da Iodopsina pigmentada.A detecção da cor é uma função dos três tipos de células cones presentes na retina: entre elas cobrem o espectro visível. Isto porque cada tipo é sensível a uma gama diferente de comprimentos de onda com o máximo correspondente ao vermelho (longo), verde (médio) ou azul (curto).
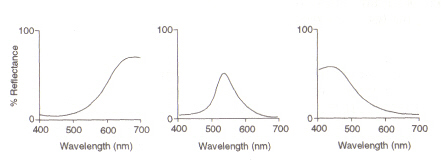
Figura 5: Maximums of (fromleft) red, green and blue cone cells, respectively. Esta imagem é tirada de Chirstie (ref. 4) e é restrito de acordo com a fonte dada (ou seja, não é o próprio trabalho dos autores).
O mecanismo de Rhodopsin dentro do Rodcells: A proteína Rhodopsin contém o protonatedretinal-Schiff base do complexo que, naturalmente, está em inter-membrana bolso formado pela sete trans-membrana de uma helicalreceptors. Há muitos discos planos de rodopsina dentro do segmento exterior da célula de arod que, após detecção de luz, passam por uma mudança fotossomérica de Rhodopsin (11-cis) para toda retina trans. Após a cascata de fotoisomerização que ocorre através de 5 intermedios de curta duração (fluxograma 1), A Retina trans difunde-se e é convertida de volta em 11-cisretinal antes da reentrada no ciclo. Este processo ocorre através da redução do retinol toall-trans seguido de oxidação/isomerização no escuro. A fotoexcitedrhodopsina (4.º dos 5 produtos intermédios) desencadeia um processo de cascata enzimático que resulta na hidrólise de GMP. Isto, por sua vez, fecha canais específicos da catião com a membrana da célula rod, que estão naturalmente abertos ao influxo de Na+no escuro, e devido ao efeito da hiperpolarização, o corpo sinático interno emite um sinal nervoso para outros neurônios na Retina. Finalmente, a iluminação dos níveis de cálcio induzidos pela luz ajuda a recuperação dos neurônios excitados para um estado passivo, “escuro”e o ciclo começa novamente após a detecção da luz. Os fotorreceptores das células cones também são sete a-helicalreceptores com 11-cis-retinal como seu cromóforo. A gama de detecção varia de verde a vermelho, uma vez que os três resíduos que contêm hidroxilo não-polares são substituídos sequencialmente com os polares.

Figura 6 da esquerda: posição da retina 11-cis dentro da Rhodopsina. Esta imagem é tirada de Stryer (ref. 6) e é restrito de acordo com a fonte dada (ou seja, não é o próprio trabalho dos autores).
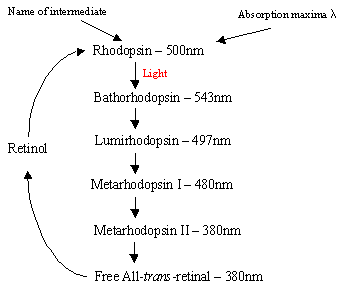
Clique Com O Botão Direito Flowchart1: The 5 intermediates of the Rhodopsin cycle.
Wheredoes Rhodopsin vem?
os seres Humanos não podem makeRhodopsin, em vez disso, eles usam e fonte externa, b-caroteno,que é encontrado em alimentos, a fim de síntese que:
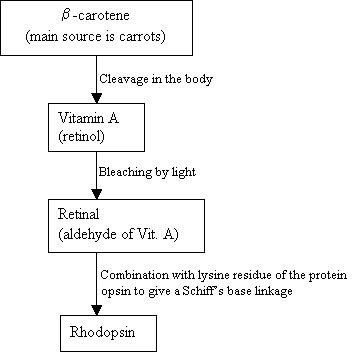 |
Fluxograma 2: Thesynthesis de Rhodopsin Nova imagem =Figura 7: estruturas de b-caroteno (em cima), VitaminA (médio)e 11-cis retinal (parte inferior). |
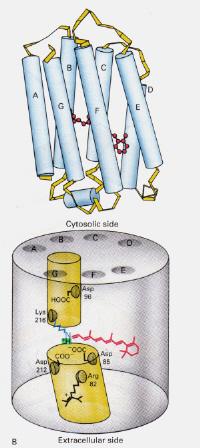
Como funciona o mecanismo de ofBacteriorhodopsin encontrado em Halobacteria diferem de Rhodopsin encontrado inRod células do olho humano?: This time the protonated retinal-schiff’s basecomplex naturally blocks a channel through the membrane otherwise formed by twoadjacent chambers. O complexo trans protonado doa um próton a Asp-85, o que permite a saída desse mesmo próton para o lado extracelular. A fotoisomerização da estrutura 13-cis permite que a base de Schiff pegue um próton do resíduo Asp-96 no lado citosólico. Após reorientação da forma cis para o trans, o ciclo de isomerização e de bombagem de protões continua.