electroliți ionici
apa și alte molecule polare sunt atrase de ioni, așa cum se arată în figura \(\PageIndex{2}\). Atracția electrostatică dintre un ion și o moleculă cu dipol se numește atracție ion-dipol. Aceste atracții joacă un rol important în dizolvarea compușilor ionici în apă.
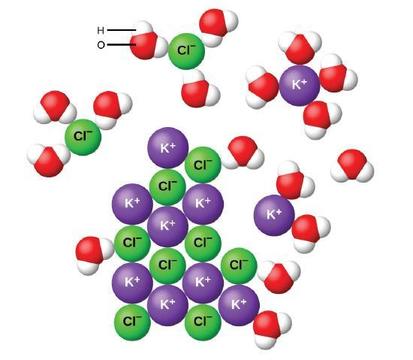
când compușii ionici se dizolvă în apă, ionii din solid se separă și se dispersează uniform în soluție, deoarece moleculele de apă înconjoară și solvează ionii, reducând forțele electrostatice puternice dintre ele. Acest proces reprezintă o schimbare fizică cunoscută sub numele de disociere. În majoritatea condițiilor, compușii ionici se vor disocia aproape complet atunci când sunt dizolvați și astfel sunt clasificați ca electroliți puternici.
Să analizăm ce se întâmplă la nivel microscopic atunci când adăugăm KCL solid în apă. Forțele Ion-dipol atrag capătul pozitiv (hidrogen) al moleculelor de apă polară către ionii de clorură negativi de la suprafața solidului și atrag capetele negative (oxigen) către ionii de potasiu pozitivi. Moleculele de apă pătrund între ionii individuali K + și Cl-și îi înconjoară, reducând forțele interionice puternice care leagă ionii împreună și lăsându-i să se deplaseze în soluție ca ioni solvați, după cum arată figura. Reducerea atracției electrostatice permite mișcarea independentă a fiecărui ion hidratat într-o soluție diluată, rezultând o creștere a tulburării sistemului pe măsură ce ionii se schimbă de la pozițiile lor fixe și ordonate în Cristal la stări mobile și mult mai dezordonate în soluție. Această tulburare crescută este responsabilă pentru dizolvarea multor compuși ionici, inclusiv KCl, care se dizolvă cu absorbția căldurii.
în alte cazuri, atracțiile electrostatice dintre ionii dintr-un cristal sunt atât de mari, sau forțele de atracție Ion-dipol dintre ioni și moleculele de apă sunt atât de slabe, încât creșterea tulburării nu poate compensa energia necesară pentru separarea ionilor, iar cristalul este insolubil. Acesta este cazul compușilor precum carbonatul de calciu (calcar), fosfatul de calciu (componenta anorganică a osului) și oxidul de fier (rugina).