reacțiile în soluție care nu sunt catalizate sunt lente, deoarece dezvoltarea și separarea sarcinii are loc în starea de tranziție. Când legăturile sunt făcute sau rupte, se formează adesea intermediari Încărcați care au o energie mai mare decât reactanții. Deoarece intermediarul este mai mare în energie decât reactanții, starea de tranziție ar fi și mai mare în energie și, prin urmare, seamănă mai mult cu intermediarul încărcat. Orice lucru care poate stabiliza sarcinile intermediare și, prin urmare, sarcinile în curs de dezvoltare în stările de tranziție va reduce energia stării de tranziție și va cataliza reacția. În această secțiune vom investiga mecanismul care stă la baza catalizei prin molecule mici de reacții chimice. Probabil, catalizatorul macromolecular biologic (cum ar fi enzimele proteice) va folosi mecanisme similare în efectele lor catalitice (care vor fi discutate în secțiunea următoare).
catalizatorii, inclusiv enzimele, pot folosi cel puțin 5 moduri diferite de a stabiliza stările de tranziție.
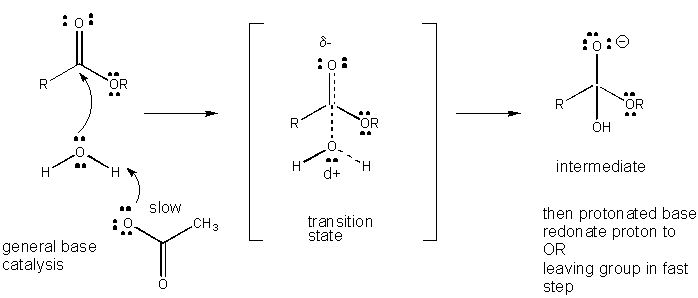
dezvoltarea sarcinii în TS poate fi scăzută fie prin donarea unui proton din acizi generali (cum ar fi acidul acetic sau un inel indol protonat) la un atom precum un carbonil o care dezvoltă o sarcină negativă parțială în TS atunci când este atașat de un nucleofil. Donarea de protoni scade negativul în curs de dezvoltare în TS. Alternativ, un nucleofil precum apa care dezvoltă o sarcină pozitivă parțială în TS pe măsură ce începe să formeze o legătură cu un c electrofil într-un carbonil poate fi stabilizat prin prezența unei baze generale (cum ar fi acetat sau inelul indol deprotonat). Abstractizarea protonilor scade sarcina pozitivă în curs de dezvoltare
figura: dezvoltarea sarcinii în starea de tranziție pentru hidroliza esterului
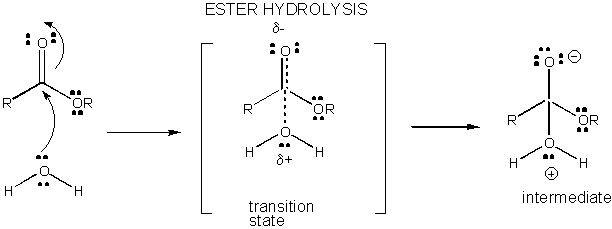
figura: mecanismul de cataliză generală a acidului
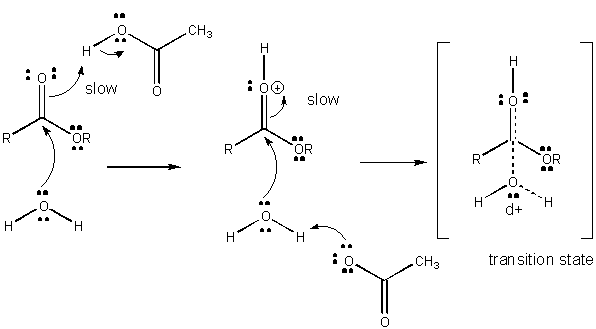
figura: mecanismul de cataliză generală a bazei
colaboratori și atribuții
- Prof. Henry Jakubowski (Colegiul Sf. Benedict / Universitatea Sf. Ioan)