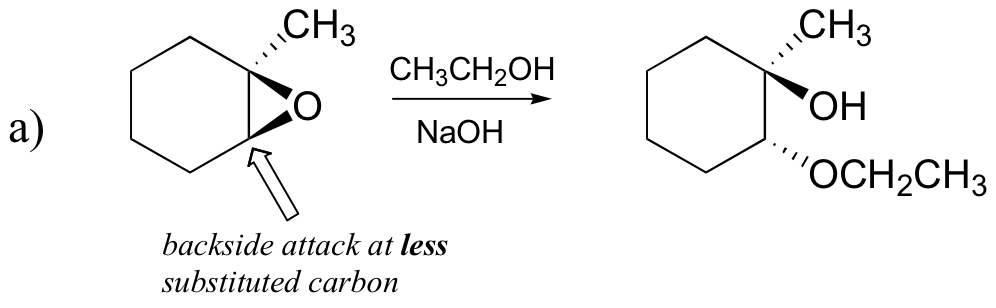
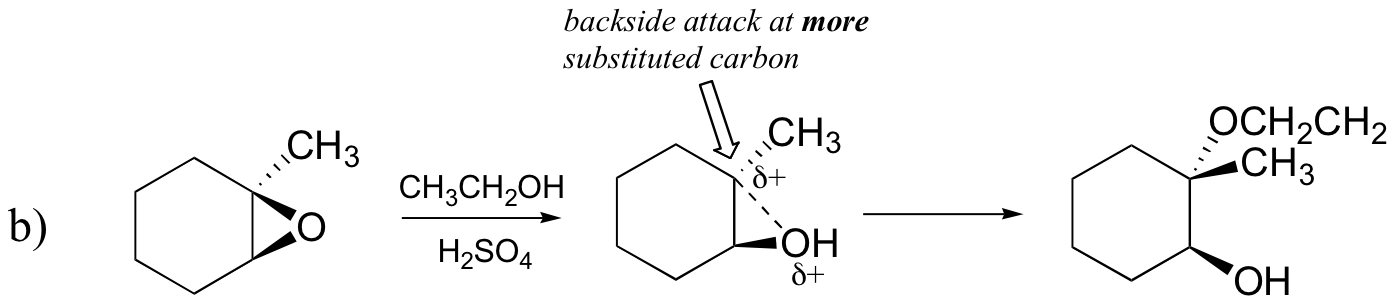
reacții de deschidere a inelului epoxidic-SN1 vs.SN2, regioselectivitate și stereoselectivitate
reacțiile neenzimatice de deschidere a inelului epoxizilor oferă o imagine de ansamblu frumoasă a multor concepte pe care le – am văzut deja în acest capitol. Reacțiile de deschidere a inelului pot continua fie prin mecanisme SN2, fie SN1, în funcție de natura epoxidului și de condițiile de reacție. Dacă epoxidul este asimetric, structura produsului va varia în funcție de mecanismul care domină. Când un epoxid asimetric suferă solvoliză în metanol bazic, deschiderea inelului are loc printr-un SN2 mecanism, iar carbonul mai puțin substituit este locul atacului nucleofil, ducând la ceea ce ne vom referi ca produs B:

invers, atunci când solvoliza are loc în metanolul acid, reacția are loc printr-un mecanism cu caracter substanțial SN1, iar carbonul mai substituit este locul atacului. Ca urmare, produsul a predomină.

ambele sunt exemple bune de reacții regioselective. Într-o reacție regioselectivă, doi (sau mai mulți) izomeri constituționali diferiți sunt posibili ca produse, dar unul este format preferențial (sau uneori exclusiv).
să examinăm mai întâi cazul de bază, SN2. Grupul de plecare este un anion alcoxid, deoarece nu există acid disponibil pentru a protona oxigenul înainte de deschiderea inelului. Un alcoxid este un grup slab părăsit și, prin urmare, este puțin probabil ca inelul să se deschidă fără o ‘împingere’ de la nucleofil.

nucleofilul în sine este puternic: un ion metoxid deprotonat, încărcat negativ. Atunci când o reacție de substituție nucleofilă implică un grup de părăsire slabă și un nucleofil puternic, este foarte probabil să se desfășoare printr-un mecanism SN2.
cum rămâne cu electrofilul? Există doi atomi de carbon electrofili în epoxid, dar cea mai bună țintă pentru nucleofil într-o reacție SN2 este carbonul care este cel mai puțin împiedicat. Aceasta explică rezultatul regiochimic observat. Ca și în alte reacții SN2, atacul nucleofil are loc din spate, rezultând inversarea la carbonul electrofil.
probabil cel mai bun mod de a descrie reacția de deschidere a inelului epoxidic catalizat de acid este ca hibrid sau încrucișat între un mecanism SN2 și SN1. În primul rând, oxigenul este protonat, creând un grup bun de plecare (pasul 1 de mai jos) . Apoi, legătura carbon-oxigen începe să se rupă (pasul 2) și sarcina pozitivă începe să se acumuleze pe carbonul mai substituit (reamintim discuția din secțiunea 8.4 B despre stabilitatea carbocației).

spre deosebire de o reacție SN1, nucleofilul atacă carbonul electrofil (Pasul 3) înainte ca un intermediar complet de carbocație să aibă șansa de a se forma.

atacul are loc preferențial din spate (ca într-o reacție SN2), deoarece legătura carbon-oxigen este încă într-o oarecare măsură, iar oxigenul blochează atacul din partea din față. Observați, totuși, modul în care rezultatul regiochimic este diferit de reacția catalizată de bază: în procesul catalizat de acid, nucleofilul atacă carbonul mai substituit, deoarece acest carbon deține un grad mai mare de sarcină pozitivă.
exercițiul 8.17:
preziceți produsul(produsele) major (e) al (ale) reacției de deschidere a inelului care apare atunci când epoxidul prezentat mai jos este tratat cu:
a) etanol și o cantitate mică de hidroxid de sodiu
B) etanol și o cantitate mică de acid sulfuric

sugestie: asigurați-vă că luați în considerare atât regiochimia, cât și stereochimia!
Khan academy videos

deschiderea inelului în condiții acide: