- protocoale
- producția de Hibridomă
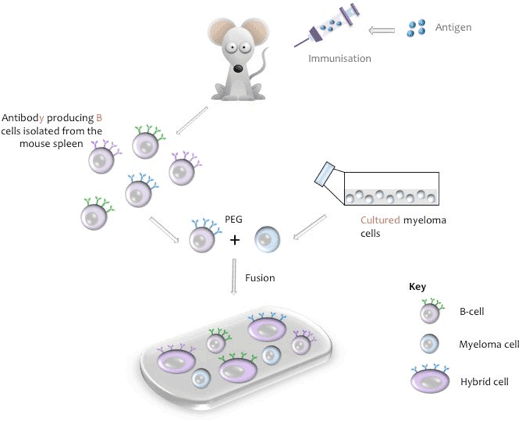
- Reprezentarea schematică a fuziunii celulare
- echipamente necesare
- mediu și alți reactivi (a se vedea apendicele A Pentru mai multe detalii)
- înainte de a începe (consultați Anexa A Pentru mai multe detalii)
- decongelarea și creșterea celulelor mielomului
- procesul de fuziune
- cu trei zile înainte – pregătiți celulele mielomului pentru fuziune
- cu o zi înainte – pregătiți mediul
- ziua fuziunii
- zi după fuziune
- apendicele I
protocoale
producția de Hibridomă
un hibridom este o linie celulară care provine dintr-o celulă hibridă capabilă să secrete un anticorp monoclonal specific unui epitop al antigenului dumneavoastră permanent în cultură. Celula hibridă este produsă prin fuziunea anticorpilor specifici care produc celule B de la un animal imunizat (de obicei un șoarece, șobolan sau iepure) și care are o durată de viață finită, cu o celulă dintr-o linie celulară de mielom cultivată „nemuritoare” (de exemplu, șoarece NS-1 sau ns-0).
producerea unei celule hibride de șoarece
în timpul procesului de fuziune, celulele B sunt izolate din splina de șoarece, amestecate cu linia celulară de mielom de șoarece și fuziunea este indusă cu polietilen glicol (PEG, vezi apendicele I). (Linia de mielom relevantă este utilizată atunci când se utilizează celule B de la alte specii de animale). Hibridele rezultate sunt apoi cultivate în mediu de cultură tisulară care conține Hipoxatină, Aminopterină, timidină (HAT), o etapă care ucide orice celule de mielom nefuzate care ar putea depăși celelalte celule hibridomice mai slabe. Celulele B nefuzate au puteri limitate de diviziune și vor muri în mod natural în cultură. La zece zile după procesul de fuziune, supernatantul de cultură este colectat și testat pentru prezența anticorpului dorit.
Reprezentarea schematică a fuziunii celulare
echipamente necesare
- un mediu steril, în care să se pregătească și să se ocupe de celule (flux laminar sau cabinet de clasa II)
- un incubator setat la 37 UNKTICTC, cu 5% CO2 și umiditate de 95%
- un microscop inversat
- o baie de apă 37 UNKTICTC care poate fi plasat în dulap
- o centrifugă cu un rotor oscilant
- instrumente sterile de disecție-în mod ideal două seturi-fiecare constând din două perechi foarfece și forceps (unul curbat și un capăt contondent).
- 75 ml flacoane de Cultură Corning de țesut – Ref. 15430641
- 24 Plăci de șoim bine-Ref. 353047
- pipete Sterile
- umplutură pentru pipete
- pipete Sterile pasteur
- un temporizator
mediu și alți reactivi (a se vedea apendicele A Pentru mai multe detalii)
- RPMI 1640 bicarbonat tamponat, cu L-glutamină(LONZA Ref. BE12-702F)
- RPMI 1640 Hepes tamponat, fără L-glutamină
- ser fetal bovin de bună calitate (testat pe loturi) (Genycell Ref. GCS0101-500)
- penicilină/streptomicină (Gibco Ref. 15070-063)
- Ultroser G (Pall Ref. 15950-017)
- HAT (Hipoxatină, Aminopterină, timidină) (Gibco Ref. 21060-017)
- PEG 1500 (Ref. 10783641001)
înainte de a începe (consultați Anexa A Pentru mai multe detalii)
- Faceți 500 ml de A
- Faceți 500 ml de mediu a+
- Faceți 100 ml de mediu B
- Faceți 100 ml de mediu C
- Faceți 500 ml de mediu D
decongelarea și creșterea celulelor mielomului
dezghețați linia celulară a mielomului și creșteți în mediul A. Utilizați următoarea metodă pentru a dezgheța și cultiva linia celulară a mielomului.
- scoateți flaconul congelat de celule de mielom din depozitul LN2.
- așezați celulele într-o baie de apă de 37 de CENTICLI.
- țineți capacul flaconului de congelare deasupra suprafeței apei pentru a reduce șansele de contaminare.
- când celulele sunt aproape dezghețate (doar o mică bucată de gheață rămâne) treceți la capota de cultură a țesuturilor.
- ștergeți exteriorul flaconului cu etanol 70% și îndepărtați partea superioară.
- îndepărtați cu grijă suspensia celulară folosind o pipetă Pasteur sterilă.
- se transferă conținutul într-un tub de centrifugă care conține 10 ml de mediu a (Vezi apendicele a)
- se rotește ușor suspensia celulară la 300g timp de 5 min.
- se îndepărtează supernatantul și se omogenizează celulele în 10 ml mediu proaspăt a și se introduc într-un balon mic (25cm2).
- se ia 1 ml de suspensie din balonul original și se adaugă la cel de-al doilea flacon cu 9 ml de mediu A. Acest lucru asigură faptul că, dacă concentrația din primul flacon este prea mare, este disponibilă o a doua concentrație (mai mică) de celule.
- puneți baloanele în incubatorul de CO2. Nu uitați să lăsați capacele balonului ușor deschise pentru a permite schimbul gazos.
procesul de fuziune
cu trei zile înainte – pregătiți celulele mielomului pentru fuziune
celulele mielomului trebuie să fie în faza de creștere exponențială atunci când le utilizați și acest lucru necesită experiență. Cu toate acestea, dacă configurați două baloane de 75 cm2 din celulele mielomului, unul la o diluție de 1:40 și unul la 1:60 (vezi mai jos), cu 3 zile înainte de fuziune, unul dintre baloane ar trebui să fie ideal în ziua fuziunii. (Configurarea inițială a baloanelor suplimentare la diluții deasupra și dedesubtul celor date aici ar trebui să vă ofere experiența necesară judecați rata de creștere a celulelor mielomului pentru fuziunile ulterioare).
cu o zi înainte – pregătiți mediul
următoarele trebuie să fie făcute și preîncălzite la 37 UNKTC (le puteți pune în incubator peste noapte).
- două X 200ml de mediu a+ în două baloane de 75cm2
- 100ml de mediu B
- 100ml de mediu C
- 1X4ML PEG 1500 transferat într-o folie învelită (PEG este sensibil la lumină) steril universal
- un mini baie de apă, realizată dintr-un pahar de 200 ml care conține aproximativ 100 ml apă distilată și încrucișată cu bandă suficient de largă, astfel încât să existe o deschidere pentru a ține un tub Falcon de 50 ml în poziție verticală
ziua fuziunii
- ucideți șoarecele (urmând liniile directoare instituționale), extrageți splina și puneți-l într-un recipient steril care conține 5 ml mediu C.
- toate etapele ulterioare trebuie efectuate într-o capotă cu flux laminar.
- puneți splina și mediul într-un vas petri.
- mutați splina cu forceps steril pentru a o spăla. Îndepărtați aderențele și transferați splina într-un al doilea vas petri
- tăiați splina în două. Țineți o jumătate cu forceps contondent și folosind o altă pereche de forceps curbat, tachinați ușor celulele din capsula splinei, având grijă să îndepărtați cât mai multe celule posibil. Repetați cu a doua jumătate a splinei
- îndepărtați resturile capsulei splinei și, folosind o pipetă Pasteur sterilă, amestecați bine celulele, dar foarte ușor.
- transferați suspensia celulară într-un tub de 15 ml și utilizați încă 5 ml de mediu C pentru a clăti vasul petri și a adăuga la celulele splinei din tub.
- numără celulele mielomului și splinei.
- aveți nevoie de un raport de 1 celulă de mielom la fiecare 10 celule de splină
- adăugați celulele mielomului la un tub conic de 50 ml.
- centrifugați atât celulele splinei (tubul de 15 ml), cât și celulele mielomului în (tubul de 50 ml) pentru 300g timp de 10 minute.
- se toarnă foarte atent supernatantul ambelor tuburi și se omogenizează ușor peletele fiecare în 10 ml de mediu B. absența FBS până la finalizarea procesului de fuziune este extrem de importantă, deoarece celulele nu vor fuziona dacă există FBS prezent)
- combinați celulele splinei resuspendate și peletele de mielom într-un tub de centrifugă de 50 ml.
- centrifugați timp de 5 minute la 300g.
- se toarnă foarte atent cât mai mult supernatant posibil.
- omogenizați peleta atingând ușor tubul de pe bancă. Nu scuturați peleta sau pipetați-o, deoarece aceasta va distribui celulele în jurul tubului, reducând numărul de celule disponibile pentru fuziune.
- așezați tubul în baia de apă de casă.
- se adaugă 1,2 ml de PEG picătură cu picătură timp de un minut, amestecând ușor la fiecare câteva picături.
- adăugați 1 ml de mediu B, picătură cu picătură peste un minut, amestecând ușor la fiecare câteva picături.
- adăugați încă 2 ml de mediu B, picătură cu picătură peste două minute, amestecând ușor la fiecare câteva picături.
- adăugați încă 4 ml de mediu B, picătură cu picătură peste patru minute, amestecând ușor la fiecare câteva picături.
- la sfârșitul timpului, se adaugă 8 ml de mediu C.
- se centrifughează tubul de celule timp de 5 minute 300g.
- se decantează foarte atent supernatantul și se omogenizează peleta celulară timp de 1 minut cu 10 ml de mediu A+. Pentru a face acest lucru, adăugați câteva ml de mediu pentru a începe să spargeți peleta. Aspirați aceste aglomerări de celule foarte ușor și deplasați-vă în sus și în jos în pipetă. Expulzați aceste celule și repetați procesul. Fiți foarte blând, nu forțați peleta în afară, este posibil să aveți mici aglomerări de celule când ați terminat. Celulele sunt extrem de fragile în acest stadiu.
- puneți 10 ml de amestec de fuziune omogenizat în 190 ml de mediu cald A+
- volumul final este de 200 ml
- puneți 1 ml din această suspensie în fiecare godeu de 8 x 24 plăci de godeu (2 ml). (192 godeuri în total)
- lăsați plăcile în incubator peste noapte (aproximativ 24 de ore).
zi după fuziune
- adăugați 8 ml de pălărie în 200 ml de mediu a+.
- puneți 1 ml din acest mediu selectiv în fiecare godeu din cele 8 plăci.
- lăsați plăcile în incubator. Coloniile vor apărea între 7 și 10 zile

apendicele I
mediu de Cultură A:
mediu RPMI 1640 cu L-glutamină (bicarbonat tamponat) (LONZA Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ penicilină (100U/ml)/streptomicină (100 mg/l) (Gibco Ref. 15070-063)
Mediu De Cultură A+:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
Culture Medium B (no FBS):
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium C:
RPMI 1640 Medium with L-Glutamine (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
Culture Medium D:
RPMI 1640 medium with L-Glutamine (bicarbonate buffered) (Lonza Ref. BE12-702F)
+ 10% FBS (Genycell Ref. GCS0101-500)
+ Penicillin (100U/ml)/Streptomycin (100mg/l) (Gibco Ref. 15070-063)
+ Ultroser G (1%) (Pall Ref. 15950-017)
+ HAT (Hypoxathine, Aminopterin, Thymidine) supplement which is usually 50X (dilute 10ml in 500mls of medium) (Gibco Ref. 21060-017)