- plasticitatea VSMCs în fiziologie și boală
- Vsmc afectează răspunsurile imune Adventitia la șoarecii Hiperlipidemici
- îmbătrânirea sau cronicitatea sau ambele?
- structurile Adventiției nou formate participă la funcția atlo prin promovarea recirculării limfocitelor
- formarea Atlo este foarte Teritorializată, indicând faptul că semnalele sunt transmise de la Plăci la Adventitia prin intermediul Vsmc-urilor de tip organizator de țesut limfoid
- Vsmc contribuie direct la imunitatea Adventiției în ateroscleroza
- concluzie
- contribuții autor
- finanțare
- Declarație privind conflictul de interese
plasticitatea VSMCs în fiziologie și boală
celulele musculare netede vasculare (VSMCs) sunt constituenții majori ai arterelor de dimensiuni medii și mari. Deși mecanismele de aterogeneză rămân în mare măsură definite, studiile au demonstrat că progresia bolii implică o încrucișare între celulele imune atât cu ECs, cât și cu Vsmc. Unele dintre aceste interacțiuni promovează creșterea plăcii, în timp ce altele atenuează dimensiunea, compoziția celulară și stabilitatea plăcilor aterosclerotice (1, 2) (Figura 1, Tabelul 1). Vsmc-urile prezintă o plasticitate remarcabilă ca răspuns la leziunile vasculare, inflamația și acumularea lipoproteinelor în timpul progresiei bolii prin reprogramarea expresiei genelor și trecerea la un fenotip proliferativ, Pro-migrator și activat, adică comutarea fenotipului (5). În Figura 1, prezentăm comutatoare moleculare critice care au fost propuse a fi regulatori importanți ai progresiei bolii(3, 6, 8, 11). În timpul inițierii aterosclerozei, monocitele derivate din sânge, care au fost recrutate în intima, acumulează lipide, oferindu-le un aspect spumos. Aceste celule de spumă contribuie la formarea dungilor grase, care constituie cea mai timpurie și posibil reversibilă etapă a plăcilor aterosclerotice. Dungile grase se dezvoltă treptat în ateroame / plăci, ducând în cele din urmă la plăci extinse care conțin Vsmc, celule T și celule mieloide (Figura 1) (33). În mod intrigant, compoziția unei plăci aterosclerotice, mai degrabă decât dimensiunea acesteia, determină stabilitatea acesteia, deoarece grosimea capacului fibros și dimensiunea miezului necrotic sunt potențiale semne distinctive ale unei plăci stabile față de o placă instabilă (4, 9). Vsmc-urile din stratul intim sunt considerate în mod tradițional ca fiind benefice în timpul aterogenezei, deoarece produc componente ale matricei extracelulare, promovând astfel formarea de capace fibroase mai puternice, rezultând protecție împotriva rupturii plăcii (4, 9). Este din ce în ce mai evident că Vsmc suferă o multitudine de transformări fenotipice structurale și funcționale și chiar își pot pierde complet caracteristicile native pentru a dobândi caracteristici ale altor tipuri de celule, inclusiv macrofage. Datele indică faptul că Vsmc pot dobândi fenotipuri dihotomice cu un tip de cap Janus, adică proprietăți pro-vs.anti – aterogene, în funcție de mediul tisular și de acțiunea factorilor de risc (3). Vsmc eliberează citokine pentru a stimula ECs adiacente pentru a exprima moleculele de adeziune și pentru a elibera citokine și/sau pentru a spori chemotaxia monocitelor/macrofagelor în placă (3, 34, 35) (Tabelul 1). Aceste date indică faptul că acumularea de Vsmc în capacul fibros sau intima este benefică, în timp ce pierderea sau tranziția lor într-un fenotip inflamator sunt dăunătoare și că echilibrul dintre proliferarea/migrația Vsmc vs.moarte/senescență determină ateroprogresia vs. stabilitatea plăcii (3). Diverse aspecte suplimentare ale biologiei VSMC în sănătate și boli au fost recent acoperite de o serie de recenzii excelente (https://academic.oup.com/cardiovascres/issue/114/4) și nu vor fi acoperite aici. Mai jos, prin urmare, ne concentrăm atenția asupra rolului adventitia și impactul potențial al Vsmc în formarea ATLO.

Figura 1. Fenotipurile Vsmc în timpul progresiei aterosclerozei dezvăluie o plasticitate extraordinară. ECs și Vsmc în plăcile aterosclerotice prezintă fenotipuri activate (IMM) (3, 4). Unele dintre Vsmc provin din mass-media în urma recrutării în intima; alte Cmvv pot fi derivate din măduva osoasă sau pot proveni din celule mieloide aflate în circulație (tevi) (3). O fracție de Vsmc proliferează (x) (3, 5). Vsmc-urile secretă componente ale matricei extracelulare; factorul de transcripție pluripotent, adică Klf4, poate juca roluri majore într-un proces denumit comutare fenotipică (treisprezece) (6, 7). În încercările de a proteja placa aterosclerotică de ruptura letală, Oct4 poate controla un proces care a fost numit remigrare pentru a forma un capac fibros (ace) (4, 8-10). Senescența și apoptoza declanșează generarea de citokine inflamatorii suplimentare pentru a forma un nucleu necrotic care inițiază un ciclu vicios cu consecințe clinice letale în stadiile tardive ale bolii (3, 4, 11).
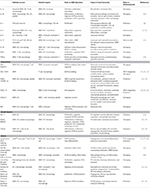
Tabelul 1. Mediatori inflamatori cheie implicați în imunitatea aterosclerozei mediată de VSMC.
Vsmc afectează răspunsurile imune Adventitia la șoarecii Hiperlipidemici
în ultimele două decenii, a devenit din ce în ce mai evident că adventitia este un țesut extrem de complex și imunologic activ care adăpostește celule la fel de diverse ca celulele stromale, nervii, vasele limfatice, vasa vasora și leucocitele/celulele progenitoare rezidente, toate având capacitatea de a afecta progresul bolii (36, 37). Am observat că adventitia șoarecilor ApoE – / – suferă evenimente majore de restructurare în toate etapele aterosclerozei: Atât celulele imune înnăscute, cât și cele adaptive se acumulează adiacente plăcilor aterosclerotice vecine (Figura 2). Mai mult, studiile noastre pe șoareci experimentali au fost coroborate în arterele bolnave umane: noi și alții am observat structuri ATLO-asemănătoare în adventitia pacienților care prezintă anevrisme aortice aterosclerotice (38, 39) și, mai recent, Akhavanpoor și colab. a observat ATLOs bine dezvoltat în adventitia unui procent considerabil de pacienți afectați de boală cardiacă ischemică (40). În ateroscleroza murină, vasele limfatice, venulele endoteliale ridicate (HEV) și neogeneza vaselor de sânge sunt caracteristici proeminente ale acestui proces de restructurare (16, 41).
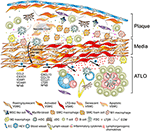
Figura 2. Celulele musculare netede vasculare (VSMC) participă la imunitatea adventiției în timpul formării plăcii. Vsmc-urile intercalate între plăcile aterosclerotice și adventitia adoptă un fenotip asemănător organizatorului țesutului limfoid după activare prin indicii derivate din placă (IMM-uri) și ulterior transdiferențiază în celule asemănătoare LTo (4). Prin intermediul fenotipului lor proliferativ și care exprimă citokine, acestea afectează restructurarea și sculptarea adventiției, inclusiv angiogeneza, formarea HEV și neogeneza vaselor limfatice (Hi). Comutarea fenotipului are ca rezultat, de asemenea, exprimarea și secreția de chemokine limforganogene, adică CXCL13 și CCL21, promovând astfel formarea ATLO descrisă schematic în partea inferioară a graficului (XP).
îmbătrânirea sau cronicitatea sau ambele?
important, îmbătrânirea s-a dovedit a fi un factor determinant major al restructurării și sculptării adventiției. Forma ATLOs complet dezvoltată în stadiile avansate ale aterosclerozei, dar stadiile lor timpurii, adică agregatele de celule T/B, apar în paralel cu formarea plăcilor aterosclerotice(16, 27, 41, 42). Într-adevăr, aceste ATLOs timpurii se formează la vârsta de ~30 de săptămâni și ajung la stadii mai avansate la aproximativ 52 de săptămâni până la vârf la 78 de săptămâni (16, 41). Stadii similare de dezvoltare dependente de vârstă ale TLOs au fost observate în alte boli cronice nerezolvabile (1, 42). Aceste date indică faptul că dezvoltarea ATLO este dependentă de vârstă, iar îmbătrânirea este asociată pozitiv cu sculptura adventițială (Figura 2). Cu toate acestea, relația dintre îmbătrânire și cronicitate este dificil de studiat în ateroscleroza murină, deoarece dezvoltarea plăcii aterosclerotice începe în arcul aortic, apoi călătorește semănat aorta pentru a ajunge la aorta abdominală în stadiile ulterioare ale bolii, luând astfel perioade lungi de timp. Sunt necesare mai multe eforturi pentru a clarifica problema importantă dacă celulele imune și/sau senescența VSMC contribuie la formarea ATLO și ce tipuri de celule, adică., VSMCs, ECs și/sau celulele imune sunt implicate. Studiile privind alte forme de formare a TLO, cum ar fi cele care apar în plămâni și în tractul gastro-intestinal, ar indica faptul că cronicitatea unei reacții tisulare inflamatorii persistente, mai degrabă decât evenimentele de îmbătrânire bona fide ale sistemului imunitar, contribuie în mod crucial la formarea ATLOs (43, 44).
structurile Adventiției nou formate participă la funcția atlo prin promovarea recirculării limfocitelor
etapele ATLO avansate includ agregate de celule T/B, centre germinale în foliculii celulelor B activate, vase limfatice, HEV în zonele celulelor T și rețele de conducte extracelulare (16). Aceste schimbări majore se aseamănă cu structurile care amintesc de cele găsite în organele limfoide secundare, unde promovează aspecte fundamentale ale răspunsurilor imune față de antigen, inclusiv recircularea limfocitelor na Olive pentru a-și găsi antigenele/autoantigenii cognitivi și organizarea maturării afinității celulelor B către potențiali autoantigeni. Utilizând studii de transfer de limfocite adoptive, am observat că ATLOs sporește considerabil recrutarea limfocitelor în peretele arterial atât prin promovarea imigrației, cât și prin atenuarea concomitentă a emigrării limfocitelor neexperimentate cu antigen (27). Ulterior recrutării lor, celulele T devin activate, încep să prolifereze, iar unele dintre celulele CD4 T helper sunt transformate în celule T reglatoare induse. Aceste date arată că sistemul imunitar din adventitia este foarte receptiv la reacția țesutului inflamator care stă la baza peretelui arterial. Mai mult, Celulele B care formează centre germinale în foliculii de celule B activate par să sufere o reacție centrală germinală în prezența celulelor dendritice foliculare, unde unele sunt transformate în celule B de memorie, în timp ce altele părăsesc centrele germinale pentru a deveni celule plasmatice (45). Atunci când sunt luate împreună, aceste date indică faptul că ATLOs, mai degrabă decât organele limfoide secundare (așa cum se credea anterior), organizează imunitatea aterosclerozei.
formarea Atlo este foarte Teritorializată, indicând faptul că semnalele sunt transmise de la Plăci la Adventitia prin intermediul Vsmc-urilor de tip organizator de țesut limfoid
un alt aspect al restructurării adventiției în timpul aterogenezei este că formarea ATLO este foarte teritorializată, fiind în mare parte limitată la segmentele adventitia adiacente plăcilor aterosclerotice din aorta abdominală la șoareci (16, 45). ATLOs se găsesc doar ocazional în adventitia arterei innominate sau a arcului aortic unde ateroscleroza este cea mai proeminentă. Celulele imune din segmentele toracice ale aortei sunt compuse în principal din agregate de celule T comparativ cu ATLOs în aorta abdominală (16, 41). Mecanismul exact pentru teritorialitatea formării ATLOs în aorta abdominală este încă necunoscut. TLOs par a fi o caracteristică a multor boli inflamatorii cronice nerezolvabile și sunt semne distinctive proeminente ale bolilor autoimune (42). Celularitatea și structurile TLOs în ateroscleroză sunt similare cu TLOs în multe alte boli cronice, inclusiv formarea TLO asociată cancerului (46, 47). Domeniul biologiei TLO s-a extins dramatic în ultimii ani, ridicând posibilitatea importantă ca noi ținte terapeutice să poată fi identificate prin înțelegerea funcției TLO în fiecare dintre bolile asociate TLO. Cu toate acestea, diferitele tipuri de TLOs dezvăluie unele caracteristici specifice bolii, care pot determina în cele din urmă dacă răspunsurile imune asociate sunt dăunătoare sau protectoare. Astfel de caracteristici specifice bolii pot apărea printr-unul din mai multe mecanisme, inclusiv specificitatea organelor și natura leziunilor tisulare (1, 42). Dezvoltarea organelor limfoide este un proces complex care implică celule inductoare de țesut limfoid hematopoietic (LTi), celule Organizatoare de țesut limfoid stromal non-hematopoietic (LTo) și semnalizare Lt. Studiile noastre in vitro asupra Vsmc-urilor aortei de șoarece au indicat că, la stimularea adecvată, acestea pot servi ca celule asemănătoare LTo (20), identificate inițial în timpul dezvoltării embrionare în timpul formării țesuturilor limfoide secundare, inclusiv ganglionii limfatici și splina (48, 49) (vezi mai jos). Este important de menționat că ATLOs par să implice Vsmc ca participanți importanți, în timp ce alte TLOs implică alte celule mezenchimale asemănătoare LTo (50). Cu toate acestea, numitorul comun al tuturor formelor de TLOs pare a fi–spre deosebire de organele limfoide secundare–o reacție cronică inflamatorie a țesutului care determină sistemul imunitar să formeze aceste structuri limfoide aproape sau, în unele cazuri, în țesutul bolnav (42, 43).
Vsmc contribuie direct la imunitatea Adventiției în ateroscleroza
având în vedere natura extrem de teritorializată a ATLOs adiacent plăcilor aterosclerotice, am motivat că Vsmc pot fi implicate în formarea ATLO și, în același timp, pot adopta un rol funcțional în progresia aterosclerozei. Vsmc exprimă foarte mult Ltctr în mod constitutiv (16), în timp ce ligandul său Lta1 CT2 este exprimat pe diferite celule imune denumite celule LTi (51). Se presupune că vsmc-urile sunt activate prin calea de semnalizare lt-lt de către celulele LTi implicate în neogeneza țesutului limfoid secundar. Originea celulei LTi nu a fost încă clar determinată, deși macrofagele activate și alte celule imune din placa intimă sunt candidați pentru această activitate în NEOGENEZA LTO. Ca răspuns la mediatorii celulari și solubili, Vsmc par să sufere un tip distinct de fenotip care trece la un fenotip asemănător LTo prin secreția paracrină a chemokinelor limforganogene, adică CXCL13 și CCL21, atrăgând astfel celulele imune, de exemplu macrofage/celule dendritice, celule T și celule B la mediul local adventitia conducând la formarea ATLO în adventitia (27, 41, 45) (Tabelul 1). Deficiența globală sau specifică Vsmc a Ltctr la șoarecii APOE−/− hiperlipidemici în vârstă a demonstrat formarea crescută a plăcii aterosclerotice indicând faptul că Vsmc Ltctr are capacitatea de a atenua dezvoltarea aterosclerozei în anumite condiții experimentale (27). Cu toate acestea, alte studii au arătat că șoarecii tineri APOE−/− LTbR−/−la nivel mondial menținuți sub o dietă bogată în grăsimi (HFD) au evidențiat o povară mai mică a plăcii aortice decât omologii lor APOE-/− alimentați cu dietă normală (52). Aceste date aparente contradictorii indică faptul că rolurile Ltctr la șoareci tineri și în condiții de hiperlipidemie excesivă pot fi diferite în cele două modele. Alternativ, dieta bogată în grăsimi, care duce la niveluri dramatice și, eventual, intoxicante ale lipidelor plasmatice, poate fi responsabilă pentru aceste diferențe. Deoarece nu folosim în mod regulat o dietă bogată în grăsimi la ApoE−/− șoareci, aceste discrepanțe rămân probleme nerezolvate, deși s-a demonstrat că sistemul imunitar poate fi copleșit de niveluri extreme de lipide plasmatice . Aceste date necesită studii suplimentare pentru a examina baza moleculară a dihotomiei aparente a Ltctr în progresia aterosclerozei la șoareci tineri vs.vârstnici și/sau ateroscleroză timpurie vs. avansată. În plus, macrofagele derivate din măduva osoasă pot funcționa ca celule LTi independente de Ltctr și pot declanșa expresia CCL19, CCL20 și CXCL16 de către Vsmc (53) (Tabelul 1). Astfel, Vsmc-urile pot participa la formarea TLOs în ateroscleroză prin reglarea în sus a chemokinelor limforganogene pentru a promova agregatele celulare imune în adventitia. După cum sa menționat mai sus, ATLOs sunt frecvente la om împovărat de boala coronariană ischemică (40) și în anevrismele aortice aterosclerotice umane (38, 39). Atunci când sunt luate împreună, apariția ATLOs la șoareci experimentali și în ateroscleroza umană ridică întrebări importante cu privire la natura aterosclerozei ca boală autoimună: este posibil ca în timpul aterogenezei să se genereze celule T autoimune și celule B autoimune îndreptate împotriva autoantigenilor încă identificați. Izolarea unor astfel de limfocite autoimune, inclusiv secvențierea receptorilor celulelor T și/sau a receptorilor celulelor B, ar permite testarea ipotezelor majore în ateroscleroză. Într-adevăr, cercetarea aterosclerozei ar suferi o schimbare majoră și testarea clonelor limfocitare autoimune individuale în sistemele funcționale in vitro și in vivo ar deveni posibilă.
concluzie
ateroscleroza este o boală inflamatorie a arterelor. Vsmc comunică atât cu ECs, cât și cu celulele imune din plăcile aterosclerotice și cu celulele rezidente din adventitia. Această abilitate permite Vsmc să afecteze imunitatea aterosclerozei în moduri majore, inclusiv formarea ATLOs. Sunt necesare lucrări suplimentare pentru a delimita rolul Vsmc în diferite stadii ale aterosclerozei, pentru a determina rolul lor în arterele tinere vs.îmbătrânire și pentru a elucida în continuare rolurile lor dihotomice în progresia bolii. O mai bună înțelegere a acestor procese poate deschide calea dezvoltării strategiilor terapeutice pentru intervenția viitoare în stadiile tardive importante din punct de vedere clinic ale bolii.
contribuții autor
toți autorii au contribuit la proiectarea, scrierea și editarea manuscrisului trimis și l-au aprobat pentru publicare.
finanțare
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
4. Clarke MC, Figg N, Maguire JJ, Davenport AP, Goddard M, Littlewood TD și colab. Apoptoza celulelor musculare netede vasculare induce caracteristici ale Vulnerabilității plăcii în ateroscleroză. Nat Med. (2006) 12:1075–80. doi: 10.1038 / nm1459
PubMed rezumat / CrossRef text integral / Google Scholar
5. Owens GK, Kumar MS, Wamhoff BR. Reglarea moleculară a diferențierii celulelor musculare netede vasculare în dezvoltare și boală. Physiol Rev. (2004) 84:767-801. doi: 10.1152 / physrev.00041.2003
PubMed Rezumat / CrossRef Text Integral / Google Scholar
6. Shankman LS, Gomez D, Cherepanova OA, Salmon M, Alencar GF, Haskins RM și colab. Modulația fenotipică dependentă de KLF4 a celulelor musculare netede are un rol cheie în patogeneza plăcii aterosclerotice. Nat Med. (2015) 21:628–37. doi: 10.1038 / nm.3866
Rezumat PubMed / CrossRef Text Complet / Google Scholar
7. Gomez D, Owens GK. Comutarea fenotipică a celulelor musculare netede în ateroscleroză. Cardiovasc Res. (2012) 95:156-64. doi: 10.1093 / cvr / cvs115
PubMed rezumat / CrossRef Text Complet / Google Scholar
8. Cherepanova OA, Gomez D, Shankman LS, Swiatlowska P, Williams J, Sarmento de, și colab. Activarea factorului de pluripotență OCT4 în celulele musculare netede este ateroprotectoare. Nat Med. (2016) 22:657–65. doi: 10.1038 / nm.4109
Rezumat PubMed / CrossRef Text Complet / Google Scholar
10. Yla – Herttuala S, Bentzon JF, Daemen M, Falk e, Garcia-Garcia HM, Herrmann J, și colab. Stabilizarea plăcilor aterosclerotice. Document de poziție al Grupului de lucru al Societății Europene de Cardiologie (ESC) privind ateroscleroza și biologia vasculară. Tromb Haemost. (2011) 106:1–19. doi: 10.1160 / TH10-12-0784
PubMed rezumat / CrossRef Text Complet / Google Scholar
11. Grootaert MOJ, Moulis M, Roth L, Martinet W, Vindis C, Bennett MR, și colab. Moartea celulelor musculare netede vasculare, autofagia și senescența în ateroscleroză. Cardiovasc Res. (2018) 114:622-34. doi: 10.1093 / cvr / cvy007
PubMed rezumat / CrossRef Text Complet / Google Scholar
14. Akhavanpoor M, Akhavanpoor H, Gleissner CA, Wangler S, Doesch AO, Katus HA, și colab. Cele două fețe ale interleukinei-17a în ateroscleroză. Ținte De Droguri Curr. (2017) 18:863–73. doi: 10.2174/1389450117666161229142155
PubMed rezumat / CrossRef Text Complet / Google Scholar
15. Jia G, Cheng G, Gangahar DM, Agrawal DK. Factorul de creștere asemănător insulinei-1 și TNF-alfa reglează autofagia prin C-jun n-terminal kinază și Akt căi în celulele netede vasculare aterosclerotice umane. Imunol Cell Biol. (2006) 84:448–54. doi: 10.1111 / j. 1440-1711.2006.01454.x
rezumat PubMed / CrossRef Text Complet / Google Scholar
16. Grabner R, Lotzer K, Dopping S, Hildner M, Radke D, bere M, și colab. Semnalizarea receptorului beta al limfotoxinei promovează organogeneza limfoidă terțiară în adventiția aortică a șoarecilor APOE−/− în vârstă. J Exp Med. (2009) 206:233–48. doi: 10.1084 / jem.20080752
CrossRef Text Complet / Google Scholar
17. Damas JK, Smith C, Oie E, Fevang B, Halvorsen B, Waehre T și colab. Expresia îmbunătățită a chemokinelor homeostatice CCL19 și CCL21 în ateroscleroza clinică și experimentală: posibil rol patogen în destabilizarea plăcii. Arterioscler Tromb Vasc Biol. (2007) 27:614–20. doi: 10.1161 / 01.ATV.0000255581.38523.7c
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doring Y, Noels H, van der Vorst EPC, Neideck C, Egea V, Drechsler M, et al. Vascular CXCR4 limits atherosclerosis by maintaining arterial integrity: evidence from mouse and human studies. Circulation. (2017) 136:388–403. doi: 10.1161/CIRCULATIONAHA.117.027646
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Akhtar S, Gremse F, Kiessling F, Weber C, Schober A. CXCL12 promotes the stabilization of atherosclerotic lesions mediated by smooth muscle progenitor cells in Apoe-deficient mice. Arterioscler Thromb Vasc Biol. (2013) 33:679–86. doi: 10.1161/ATVBAHA.112.301162
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Lotzer K, Dopping S, Connert S, Grabner R, Spanbroek R, Lemser B, et al. Mouse aorta smooth muscle cells differentiate into lymphoid tissue organizer-like cells on combined tumor necrosis factor receptor-1/lymphotoxin beta-receptor NF-kappaB signaling. Arterioscler Thromb Vasc Biol. (2010) 30:395–402. doi: 10.1161 / ATVBAHA.109.191395
PubMed Rezumat / CrossRef Text Integral / Google Scholar
21. Smedbakken LM, Halvorsen B, Daissormont I, Ranheim T, Michelsen ae, Skjelland M, și colab. Niveluri crescute ale chemokinei homeostatice CXCL13 în ateroscleroza umană – rol potențial în stabilizarea plăcii. Ateroscleroza. (2012) 224:266–73. doi: 10.1016 / j.ateroscleroza.2012.06.071
CrossRef Text Integral / Google Scholar
22. Higashi Y, Sukhanov S, Shai SY, Danchuk s, Tang R, Snarski P, și colab. Deficitul receptorului factorului de creștere asemănător insulinei-1 în macrofage accelerează ateroscleroza și induce un fenotip de placă instabil la șoarecii cu deficit de apolipoproteină E. Circulație. (2016) 133:2263–78. doi: 10.1161 / CIRCULATIONAHA.116.021805
PubMed Rezumat / CrossRef Text Complet / Google Scholar
23. Alexander dl, Owens GK. Controlul Epigenetic al diferențierii celulelor musculare netede și comutarea fenotipică în dezvoltarea vasculară și boala. Annu Rev Physiol. (2012) 74:13–40. doi: 10.1146 / annurev-physiol-012110-142315
PubMed rezumat / CrossRef Text Complet / Google Scholar
24. He C, Medley SC, Hu T, Hinsdale ME, Lupu F, Virmani R și colab. Semnalizarea PDGFRbeta reglează inflamația locală și se sinergizează cu hipercolesterolemia pentru a promova ateroscleroza. Nat Comun. (2015) 6:7770. doi: 10.1038 / ncomms8770
PubMed rezumat / CrossRef Text Complet / Google Scholar
26. Da Ros F, Carnevale R, Cifelli G, Bizzotto D, Casaburo M, Perrotta M și colab. Direcționarea interleukinei-1beta protejează de anevrismele aortice induse de semnalizarea beta a factorului de creștere transformator perturbat. Imunitate. (2017) 47:959-73 e9. doi: 10.1016 / j. imuni.2017.10.016
CrossRef Text Complet / Google Scholar
27. Hu D, Mohanta SK, Yin C, Peng L, Ma Z, Srikakulapu P, și colab. Organele limfoide terțiare ale arterei controlează imunitatea aortei și protejează împotriva aterosclerozei prin receptorii beta ai limfotoxinei celulelor musculare netede vasculare. Imunitate. (2015) 42:1100–15. doi: 10.1016 / j. imuni.2015.05.015
Rezumat PubMed / CrossRef Text Complet / Google Scholar
29. Paramel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, și colab. Nlrp3 inflammasome expresie și activare în ateroscleroza umană. J Am Inima Conf. (2016) 5:e003031. doi: 10.1161 / JAHA.115.003031
CrossRef Text Complet / Google Scholar
30. de Jong RJ, Paulin N, Lemnitzer P, Viola JR, iarna C, Ferraro B, și colab. Aptitudinea de protecție a anexinei A1 în formarea neointimei arteriale la șoarecii predispuși la ateroscleroză-raport scurt. Arterioscler Tromb Vasc Biol. (2017) 37:312–5. doi: 10.1161 / ATVBAHA.116.308744
CrossRef Text Complet / Google Scholar
32. van Gils JM, Derby MC, Fernandes LR, Ramkhelawon B, Ray TD, Rayner KJ și colab. Indicatorul de orientare neuroimună netrin-1 promovează ateroscleroza prin inhibarea emigrării macrofagelor din plăci. Nat Immunol. (2012) 13:136–43. doi: 10.1038 / ni.2205
CrossRef Text Complet / Google Scholar
35. Tchkonia T, Zhu Y, van Deursen J, Campisi J, Kirkland JL. Senescența celulară și fenotipul secretor senescent: oportunități terapeutice. J Clin Invest. (2013) 123:966–72. doi: 10.1172 / JCI64098
PubMed rezumat / CrossRef text integral / Google Scholar
37. Majesky MW, Horita H, Ostriker A, Lu s, Regan JN, Bagchi A, și colab. Celulele musculare netede diferențiate generează o subpopulație de celule progenitoare vasculare rezidente în adventitia reglementată de Klf4. Circ Res. (2017) 120:296-311. doi: 10.1161 / CIRCRESAHA.116.309322
PubMed Rezumat / CrossRef Text Complet / Google Scholar
40. Akhavanpoor M, Gleissner CA, Akhavanpoor H, Lasitschka F, Doesch AO, Katus HA, și colab. Clasificarea adventițială a organelor limfoide terțiare în ateroscleroza umană. Cardiovasc Pathol. (2018) 32:8–14. doi: 10.1016 / j. carpath.2017.08.002
PubMed Rezumat / CrossRef Text Integral / Google Scholar
41. Moos MP, John N, Grabner R, Nossmann S, Gunther B, Vollandt R, și colab. Lamina adventitia este locul major al acumulării celulelor imune la șoarecii cu deficit de apolipoproteină e alimentați cu chow standard. Arterioscler Tromb Vasc Biol. (2005) 25:2386–91. doi: 10.1161 / 01.ATV.0000187470.31662.fe
rezumat PubMed / CrossRef Text Complet / Google Scholar
42. Mohanta SK, Yin C, Peng L, Srikakulapu P, Bontha V, Hu D, și colab. Organele limfoide terțiare ale arterei contribuie la răspunsurile imune înnăscute și adaptive în ateroscleroza avansată a șoarecilor. Circ Res. (2014) 114:1772-87. doi: 10.1161 / CIRCRESAHA.114.301137
Rezumat PubMed / CrossRef Text Complet / Google Scholar
43. Buettner M, Lochner M. dezvoltarea și funcția organelor limfoide secundare și terțiare în intestinul subțire și colon. Imunol Frontal. (2016) 7:342. doi: 10.3389 / fimmu.2016.00342
PubMed Rezumat / CrossRef Text Integral / Google Scholar
45. Srikakulapu P, Hu D, Yin C, Mohanta SK, Bontha SV, Peng L, și colab. Organele limfoide terțiare ale arterei controlează ateroscleroza multistratificată territorializată răspunsurile celulelor B la șoarecii APOE–/– în vârstă. Arterioscler Tromb Vasc Biol. (2016) 36:1174–85. doi: 10.1161 / ATVBAHA.115.306983
CrossRef Text Complet / Google Scholar
48. van de Pavert SA, Mebius RE. Noi perspective asupra dezvoltării țesuturilor limfoide. Nat Rev Immunol. (2010) 10:664–74. doi: 10.1038 / nri2832
CrossRef Text Complet / Google Scholar
50. Barone F, Gardner DH, Nayar S, Steinthal N, Buckley CD, Luther SA. Fibroblastele stromale în structurile limfoide terțiare: o țintă nouă în inflamația cronică. Imunol Frontal. (2016) 7:477. doi: 10.3389 / fimmu.2016.00477
PubMed Rezumat / CrossRef Text Complet / Google Scholar
51. Scandella e, Bolinger B, Lattmann e, Miller s, Favre s, Littman DR, și colab. Restaurarea integrității organelor limfoide prin interacțiunea celulelor inductoare de țesut limfoid cu stroma zonei celulelor T. Nat Immunol. (2008) 9:667–75. doi: 10.1038 / ni.1605
Rezumat PubMed / CrossRef Text Complet / Google Scholar
52. Grandoch M, Feldmann K, Gothert JR, Dick LS, Homann s, Klatt C, și colab. Deficiency in lymphotoxin beta receptor protects from atherosclerosis in apoE-deficient mice. Circ Res. (2015) 116:e57–68. doi: 10.1161/CIRCRESAHA.116.305723
PubMed Abstract | CrossRef Full Text | Google Scholar
53. Guedj K, Khallou-Laschet J, Clement M, Morvan M, Gaston AT, Fornasa G, et al. M1 macrophages act as LTbetaR-independent lymphoid tissue inducer cells during atherosclerosis-related lymphoid neogenesis. Cardiovascular research. (2014) 101:434–43. doi: 10.1093/cvr/cvt263
PubMed Abstract | CrossRef Full Text | Google Scholar