26 octombrie 2020, de către personalul NCI
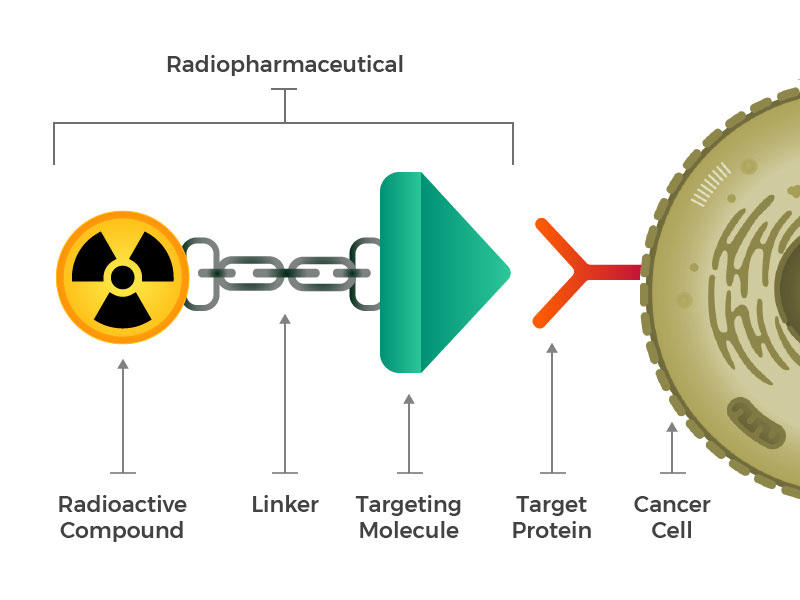
produsele radiofarmaceutice constau dintr-o moleculă radioactivă, o moleculă de direcționare și un linker care se alătură celor două.
ultimele două decenii au adus o schimbare mare în modul în care sunt tratate multe tipuri de cancer. Terapiile țintite închid proteinele specifice din celulele canceroase care le ajută să crească, să se dividă și să se răspândească. Imunoterapiile stimulează sau suprimă sistemul imunitar al organismului pentru a ajuta la combaterea cancerului. Dar tratamentele de lungă durată-chirurgia, chimioterapia și radioterapia — rămân coloana vertebrală a tratamentului pentru majoritatea cancerelor.
radioterapia a fost folosită pentru prima dată pentru a trata cancerul cu mai mult de 100 de ani în urmă. Aproximativ jumătate din toți pacienții cu cancer îl primesc încă la un moment dat în timpul tratamentului. Și până de curând, cea mai mare parte a radioterapiei a fost dată la fel ca acum 100 de ani, prin livrarea de fascicule de radiații din afara corpului pentru a ucide tumorile din interiorul corpului.
deși eficace, radiațiile externe pot provoca, de asemenea, daune colaterale. Chiar și cu echipamente moderne de radioterapie, „trebuie să aveți țesut normal pentru a ajunge la o tumoare”, a spus Charles Kunos, MD, Ph.D., al Programului de evaluare a terapiei cancerului (CTEP) al NCI. Efectele secundare rezultate ale radioterapiei depind de zona corpului tratată, dar pot include pierderea gustului, modificări ale pielii, căderea părului, diaree și probleme sexuale.
acum, cercetătorii dezvoltă o nouă clasă de medicamente numite radiofarmaceutice, care furnizează radioterapie direct și specific celulelor canceroase. În ultimii ani s-a înregistrat o explozie de cercetări și studii clinice care testează noi produse radiofarmaceutice.
aceste studii au sugerat că direcționarea radioterapiei la nivel celular are potențialul de a reduce riscul de efecte secundare atât pe termen scurt, cât și pe termen lung ale tratamentului, permițând în același timp chiar și depozite mici de celule canceroase să fie ucise în tot corpul.
„cred că vor transforma oncologia radiologică în următorii 10-15 ani”, a spus Dr.Kunos.
bazându-se pe o afinitate naturală
furnizarea de radiații direct la celule nu este ea însăși o nouă abordare. O astfel de terapie, numită iod radioactiv, a fost utilizată pentru a trata unele tipuri de cancer tiroidian încă din anii 1940. iodul se acumulează în mod natural în celulele tiroidiene. O versiune radioactivă a elementului poate fi produsă în laborator. Când este ingerat (sub formă de pastilă sau lichid), se acumulează și ucide celulele canceroase rămase după operația tiroidiană.
o afinitate naturală similară a fost exploatată ulterior pentru a dezvolta medicamente pentru tratarea cancerului care s-a răspândit în oase, cum ar fi diclorura de radiu 223 (Xofigo), care a fost aprobată în 2013 pentru tratarea cancerului de prostată metastatic. Când celulele canceroase cresc în os, ele determină descompunerea țesutului osos pe care îl invadează. Corpul încearcă apoi să repare această deteriorare prin înlocuirea acelui os-un proces numit turnover osos.
elementul radioactiv radiu „arată ca o moleculă de calciu, deci este încorporat în zone ale corpului în care cifra de afaceri osoasă este cea mai mare”, cum ar fi zonele în care cancerul crește, a explicat Dr.Kunos. Radiul este apoi capabil să omoare celulele canceroase din apropiere.
acești compuși radioactivi călătoresc în celulele canceroase fără niciun ajutor. Cercetătorii s-au întrebat dacă ar fi posibil să se creeze noi molecule radioactive care vizează în mod specific alte tipuri de cancer.
ei au imaginat produse radiofarmaceutice proiectate care constau din trei blocuri principale: o moleculă radioactivă, o moleculă de direcționare (care recunoaște și se fixează în mod specific pe celulele canceroase) și un linker care se alătură celor două. Astfel de compuși ar putea fi injectați, infuzați, inhalați sau ingerați și apoi să-și croiască drum în fluxul sanguin.
nici ideea de a lega o moleculă care vizează cancerul de o moleculă care ucide celulele canceroase nu este nouă. De exemplu, mai multe medicamente numite conjugate anticorp–medicament, în care un anticorp care se leagă de celulele canceroase specifice este legat de un medicament toxic, au fost aprobate pentru tratarea cancerului.
dar eforturile de a crea astfel de medicamente au avut un succes limitat, a explicat Dr.Kunos, deoarece nu este suficient ca toxinele să fie aduse aproape de o celulă canceroasă. Toxinele trebuie luate în interior și să rămână în interiorul celulelor suficient de mult pentru a provoca daune. Multe celule canceroase au sau dezvoltă mecanisme pentru a pompa pur și simplu toxinele înapoi înainte ca acest lucru să se întâmple.
produsele radiofarmaceutice funcționează cel mai bine atunci când medicamentele pot intra în celule. Dar acest lucru nu este necesar pentru ca ei să fie eficienți. Odată ce un produs radiofarmaceutic s-a lipit de o celulă canceroasă, compusul radioactiv se descompune în mod natural. Această descompunere eliberează energie care dăunează ADN-ului celulelor din apropiere. Și când ADN-ul unei celule este deteriorat iremediabil, acea celulă moare. Celulele canceroase sunt deosebit de sensibile la deteriorarea ADN-ului indusă de radiații.
în funcție de tipul de compus radioactiv utilizat, energia rezultată poate penetra celula legată de produsul radiofarmaceutic, precum și aproximativ 10 până la 30 de celule care înconjoară acea celulă. Acest lucru crește numărul de celule canceroase care pot fi ucise cu o singură moleculă radiofarmaceutică.
la mijlocul anilor 2010, Food and Drug Administration (FDA) a aprobat două radiofarmaceutice care vizează moleculele anumitor celule B pentru a trata unele persoane cu limfom non-Hodgkin, un tip de cancer de sânge. Dar aceste medicamente nu au fost niciodată adoptate pe scară largă. Puțini medici care tratează pacienții cu limfom au fost instruiți să administreze aceste tipuri de compuși radioactivi. Și produsele radiofarmaceutice s-au confruntat cu concurența medicamentelor mai noi, non-radioactive.
schimbarea jocului pentru domeniu a venit în 2018, a declarat Jacek Capala, Ph.D., al Programului de cercetare a radiațiilor NCI, când FDA a aprobat lutetium Lu 177-dotatat (Lutathera) pentru tratamentul anumitor tumori neuroendocrine canceroase (NETs) care afectează tractul digestiv.
„acest lucru a arătat că tumorile solide pot fi, de asemenea, vizate în acest fel”, cu un produs radiofarmaceutic construit de la zero, a spus el. În acest caz, țintele sunt anumiți receptori hormonali găsiți în abundență pe suprafața celulelor nete.
Lutetium Lu 177-dotatat a fost mai bun la încetinirea creșterii nete decât orice medicament testat anterior, a explicat Aman Chauhan, MD, de la Universitatea din Kentucky, care conduce mai multe noi studii clinice ale medicamentului. „Acesta a fost un pas uriaș înainte pentru domeniul nostru”, a spus el.
adaptarea medicamentelor din compușii imagistici
cercetătorii proiectează și testează radiofarmaceutice pentru o serie de tipuri de cancer la fel de diverse precum melanomul, cancerul pulmonar, cancerul colorectal și leucemia, a spus Dr.Capala. Orice tumoare care are o moleculă țintită pe suprafața celulelor sale și o bună aprovizionare cu sânge—suficientă pentru a furniza medicamente—ar putea fi tratată cu radiofarmaceutice, a adăugat dr.Chauhan.
multe dintre aceste medicamente mai noi sunt versiuni reproiectate ale compușilor existenți utilizați pentru imagistica nucleară. Testele de imagistică nucleară, cum ar fi tomografia cu emisie de pozitroni (PET), utilizează uneori compuși slab radioactivi legați de molecule care se leagă de ținte specifice de pe suprafața celulelor canceroase. Camerele specializate pot dezvălui apoi chiar și depozite minuscule de celule canceroase, ajutând la măsurarea răspândirii cancerului prin organism.
cercetătorii au refăcut acum aceste molecule de direcționare pentru a transporta compuși radioactivi mai puternici, sau izotopi, în schimb—cei care ar putea ucide celulele canceroase în loc să le ajute pur și simplu să le vizualizeze.
cancerul de prostată a fost un teren de testare timpuriu pentru această repurposing. O proteină numită PSMA se găsește în cantități mari—și aproape exclusiv—pe celulele prostatei. Prin fuziunea unei molecule care se leagă de PSMA la un compus radioactiv utilizat în imagistica prin scanare PET, oamenii de știință au reușit să vizualizeze depozite minuscule de cancer de prostată care sunt prea mici pentru a fi detectate prin imagistica convențională.
mai multe tratamente radiofarmaceutice care vizează PSMA sunt acum testate în studiile clinice.
majoritatea cancerelor de prostată sunt foarte sensibile la radiații, iar radiațiile externe sunt utilizate în mod obișnuit pentru a trata boala, a explicat Frank Lin, MD, de la Centrul NCI pentru Cercetarea Cancerului, care conduce un studiu clinic al unui produs radiofarmaceutic care vizează PSMA la Centrul Clinic NIH.
majoritatea bărbaților care primesc radiații ca tratament inițial nu vor experimenta o reapariție a cancerului. Dar dacă o fac, uneori se răspândește în tot corpul, cu multe depozite mici de celule canceroase în multe organe, a explicat el.
„când tumoarea s-a răspândit așa, nu mai poți face cu adevărat radiații cu fascicul extern, deoarece radiațiile externe pot fi concentrate și tratate doar pe o mică parte a corpului tău la un moment dat”, a spus Dr.Lin.
a avea un medicament radiofarmaceutic care vizează PSMA este o modalitate mai bună de a da radiații în aceste cazuri, deoarece poate fi infuzat direct în fluxul sanguin și poate circula pe scară largă, atașându-se de celulele cancerului de prostată care s-au răspândit în tot corpul, a explicat el.
și un mare avantaj de a avea molecule de imagistică și tratament care utilizează aceeași țintă este că imagistica poate oferi medicilor o previzualizare rapidă a faptului dacă tratamentul este probabil să funcționeze, a adăugat dr.Lin.
de exemplu, în studiul Dr.Lin, bărbații trebuie să aibă o scanare PET cu versiunea imagistică a compusului înainte de tratament. Dacă compusul imagistic își găsește drumul către celulele canceroase și este detectat pe scanarea PET, atunci cercetătorii pot presupune că tratamentul radiofarmaceutic corespunzător își va atinge ținta.
„această dezvoltare complementară a diagnosticului mână în mână cu terapiile medicamentoase face acest domeniu mult mai interesant”, a spus Dr.Chauhan. „În acest fel putem ști că livrăm terapia direct celulelor tumorale.”
trecerea la terapii combinate
în timp ce radiofarmaceuticele au arătat promisiuni în studiile timpurii, ele sunt, de asemenea, ca și în cazul altor tipuri de medicamente pentru cancer, puțin probabil să șteargă o tumoare pe cont propriu.
de exemplu, lutețiul Lu 177-dotatate a dublat numărul persoanelor care au avut tumorile neuroendocrine după tratament, dar acest număr a fost încă modest: aproximativ 17%, în creștere de la 7% fără medicament, a explicat Dr.Chauhan.
„există încă loc semnificativ pentru îmbunătățiri”, a spus el.
utilizarea medicamentelor radiofarmaceutice în combinație cu alte terapii poate fi o modalitate de a determina această îmbunătățire. Unii cercetători testează acum produse radiofarmaceutice combinate cu sensibilizatori la radiații—medicamente care fac celulele canceroase și mai vulnerabile la radiații. De exemplu, Dr.Chauhan conduce un studiu clinic de lutetiu Lu 177-dotatat combinat cu un sensibilizator de radiații numit triapină, care blochează celulele să producă compușii necesari pentru repararea ADN-ului după deteriorarea indusă de radiații.
într-un alt studiu, Dr.Lin testează lutețiul Lu 177-dotatat cu un tip de medicament numit inhibitor PARP. Aceste medicamente, care sunt deja aprobate pentru a trata unele tipuri de cancer mamar, ovarian și alte tipuri de cancer, blochează procesul de reparare a ADN-ului în sine. „Deci radiația ar provoca deteriorarea ADN-ului, iar inhibitorul PARP ar împiedica celulele tumorale să-și vindece ADN-ul după radiație”, a explicat el.
alți cercetători combină produsele radiofarmaceutice cu imunoterapiile pentru a încerca să sporească eficacitatea acestor medicamente. „Studii recente au arătat că radiofarmaceuticele pot face tumorile mai receptive la imunoterapie”, a spus Dr.Capala.
multe tumori sunt tumori „reci”, a explicat el, prin faptul că celulele imune nu le recunosc sau nu funcționează corect în micromediul din jurul tumorilor, a explicat el.
dar când radiațiile ucid celulele canceroase, proteinele și ADN-ul din aceste celule se pot vărsa în sânge pentru ca celulele imune să vadă, ceea ce poate permite celulelor imune să recunoască și să omoare alte celule canceroase în tot corpul. Radioterapia poate face, de asemenea, micromediul tumoral mai ospitalier pentru celulele imune, a adăugat dr.Capala.
împreună, aceste efecte pot transforma o tumoare rece într-o tumoare „fierbinte”: una care are o abundență de celule imune și poate răspunde la medicamentele de imunoterapie. Unele studii au încercat să utilizeze radiații externe pentru a crea acest tip de răspuns.
„dar există date care sugerează că funcționează mai bine dacă fiecare tumoare, fiecare metastază, este expusă la radiații. Deci, terapia radiofarmaceutică are un avantaj acolo, prin faptul că, odată ajuns în organism, ajunge la toate metastazele”, a explicat Dr.Capala.
ar putea avea sens chiar combinarea radiofarmaceuticelor cu radiațiile externe, atâta timp cât planificarea atentă a tratamentului poate asigura o doză totală de radiații sigură, a adăugat dr.Capala. „Radioterapia externă este foarte bună în direcționarea tumorilor mari și apoi o puteți combina cu terapia radiofarmaceutică pentru a viza metastazele”, a spus el.
provocări și atenționări
domeniul radiofarmaceuticelor este încă în primele sale zile. O provocare pe care abordarea va trebui să o depășească înainte de a putea fi utilizată pe scară mai largă este lipsa medicilor instruiți să administreze astfel de medicamente.
„Numărul medicilor de medicină nucleară din SUA este mic”, a spus Dr.Lin, care are pregătire atât în medicina nucleară, cât și în oncologia medicală. „Și cred că antrenăm doar 70 sau 80 de oameni noi pe an.”
până în prezent, această lipsă de forță de muncă a împiedicat produsele radiofarmaceutice să-și atingă adevăratul potențial ca tratament personalizat, a explicat Dr.Capala. Acest potențial reflectă faptul că, spre deosebire de alte tipuri de medicamente pentru cancer, medicii pot folosi imagistica pentru a măsura exact cât de mult dintr-un produs radiofarmaceutic a ajuns la o tumoare, aproape în timp real, și ajusta doza în consecință.
dar acest tip de planificare a tratamentului necesită o expertiză multidisciplinară care nu este disponibilă pe scară largă și a lăsat oamenii să utilizeze radiofarmaceutice mai mult ca „chimioterapie radioactivă”, cu o doză unică, a adăugat el. „Acest lucru înseamnă că mulți pacienți nu primesc un tratament optim”, a spus Dr.Capala.
sunt necesare și studii de siguranță pe termen lung, a adăugat dr.Chauhan. Persoanele tratate cu radioterapie externă pot prezenta unele efecte secundare, numite efecte tardive—cum ar fi dezvoltarea celui de—al doilea cancer-luni sau ani după tratament. Deși cercetările până în prezent nu au arătat o rată ridicată a efectelor tardive ale tratamentului radiofarmaceutic, „aceștia sunt agenți foarte noi și trebuie să continuăm să fim precauți și să îi monitorizăm”, a spus el.
netezirea colaborărilor
deoarece aceste medicamente sunt relativ noi, chiar și cu studiile în curs de desfășurare, „doar zgâriem suprafața dezvoltării medicamentelor pentru radiofarmaceutice”, a spus Dr.Chauhan.
în 2019, pentru a stimula în continuare studiile de noi produse radiofarmaceutice promițătoare, NCI a lansat inițiativa de dezvoltare Radiofarmaceutică (CDI) pentru a accelera noile medicamente promițătoare în testarea clinică.
un lucru pe care NCI speră să-l realizeze cu CDI este să intermedieze mai multe studii folosind combinații de medicamente produse de diferite companii farmaceutice care ar putea să nu colaboreze altfel, a explicat Dr.Kunos, care conduce inițiativa. Preocupările legate de proprietatea intelectuală și lipsa de încredere pot opri astfel de proiecte înainte de a începe, a explicat Dr.Kunos.
„aceste tipuri de colaborări nu s-ar întâmpla neapărat dacă NCI nu ar fi brokerul onest la mijloc”, a spus el. În prezent, doar aproximativ 2% din studiile de fază timpurie susținute de NCI testează radiofarmaceutice, dar cu CDI acest lucru poate crește exponențial în următorii ani, a adăugat el.
„nu vom elimina mașinile sau alte tehnici pe care le folosim în radioterapie”, a spus Dr.Kunos. „Dar, cu natura lor vizată, credem că produsele radiofarmaceutice vor transforma modul în care folosim radiațiile.”