Calmodulin
aceasta este o introducere video a proteinei de semnalizare a calciului, calmodulin, din perspectiva unui chimist anorganic!
Calmodulina, sau CaM, este o polipeptidă care este omniprezentă în toate celulele eucariote. Această proteină este cunoscută sub numele de calmodulină, deoarece este o proteină modulată de calciu care joacă un rol vital în procesul de transducție a semnalului de calciu. Transducția semnalului de calciu este procesul prin care interacțiunile dintre ionii de calciu și numeroase proteine mediază comunicarea între celule. prin urmare, funcția calmodulinei este necesară în toate celulele eucariote, iar unele dintre sarcinile pe care le ajută să le îndeplinească sunt semnalizarea nervilor, mișcarea mușchilor scheletici și memoria. Prin detectarea ionilor de calciu în mediu, calmodulina se activează și ulterior acționează ca intermediar, inițiind legarea proteinelor importante, cum ar fi kinazele, asistând celulele noastre în funcția de bază și sofisticată („Calmodulină”).
videoclipul de mai jos demonstrează schimbarea structurală care are loc în CaM în timpul legării calciului (codurile PDB 3CLN și 1cfd).
proteina în sine are 148 de aminoacizi în lungime, cu două regiuni globulare care conțin 2 motive EF-mână fiecare, care sunt site-uri caracteristice ale polipeptidelor mediate de calciu. Când este activat, calmodulina găzduiește 4 ioni de Ca2 + care schimbă drastic forma proteinei. Când calmodulina se leagă de ionii de calciu, proteina se deschide de la forma sa apo la forma sa halo, expunând o helix alfa cunoscută sub numele de linker sau regiunea centrală tether. Inventat pentru flexibilitatea sa, regiunea centrală tether este locația proteinei pe care proteinele partenere se leagă și contribuie la cascada care este mesageria secundară a calciului. Pe baza structurii sale și a nevoii sale de funcționare a ionilor de calciu, calmodulina trebuie să poată selecta ionii de calciu din citoplasmă, iar interacțiunile dintre ion și liganzii din domeniile mâinii EF susțin această idee de selectivitate (Bertini et. al., 635-638).
această imagine este o descriere a modului în care un motiv EF-mână seamănă cu o mână. Diagrama panglicii din stânga prezintă unul dintre cele patru motive caracteristice helix-turn-helix EF de mână ale calmodulinei. (Cod PDB 3cln)
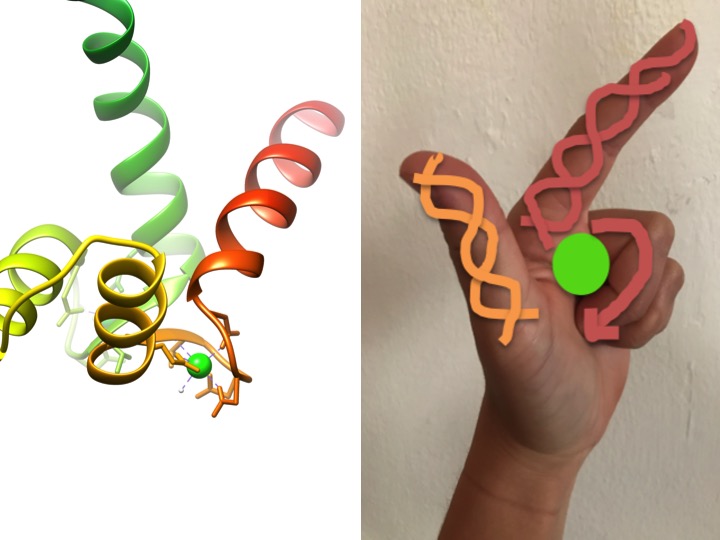
motivele EF-mână sunt regiuni structurale foarte conservate ale proteinelor implicate în legarea calciului. Aceste regiuni sunt cunoscute sub numele de motive” de mână”, deoarece seamănă cu o mână care este făcută în formă de l, unde ionul metalic este situat în mijlocul pumnului, spiralele alfa sunt indicate de degetul arătător îndreptat în sus și degetul mare orientat spre interior, iar degetele ondulate reprezintă regiunea de întoarcere sau buclă. Acest lucru este demonstrat în figura de mai sus. Într-un motiv caracteristic EF-mână, aminoacizii incluzând glutamații, asparaginele, acizii aspartici și acizii glutamici se leagă de Ca, precum și de apă (Bertini et. al. 639). Secvența tipică de legare a domeniului EF-hand este prezentată în figura de mai jos.
acest desen animat ilustrează aminoacizii coordonați într-un domeniu tipic de mână EF (compoziția exactă a aminoacizilor variază!). Linia punctată reprezintă coordonarea Ca la oxigenul unui carbonil al coloanei vertebrale, în timp ce liniile solide indică coordonarea lanțurilor laterale sau a apei.
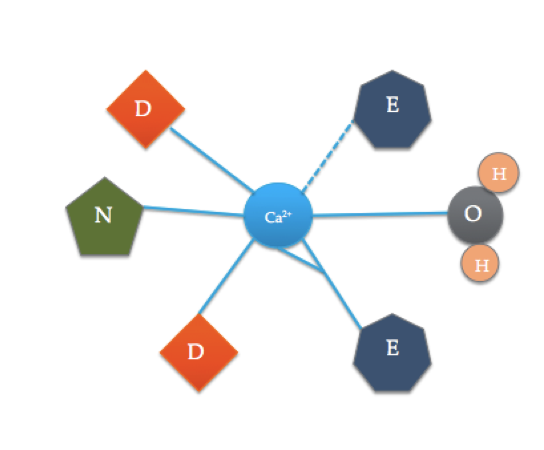
situsul de legare a calmodulinei este oarecum diferit de cel mai tipic domeniu de mână EF prezentat mai sus. Cei 6 liganzi ai calmodulinei includ lanțurile laterale ale trei acizi asparatici (D), 1 acid glutamic (E) care formează două legături covalente coordonate cu ionul, 1 moleculă de apă din soluție și 1 moleculă de carbonil din coloana vertebrală. Situsul de legare al calmodulinei constă dintr-un ion Ca2+ înconjurat de 6 liganzi în timp ce formează 7 legături.
se poate observa că motivul EF din calmodulină include mulți dintre aceiași liganzi, doar în locuri diferite. Această conformație poate da o idee de ce calmodulina este selectivă pentru calciu și cum numai prezența unui ion de calciu poate satisface locul de legare care determină activarea proteinei. Acest lucru este legat de termodinamica calmodulinei din interiorul celulei și de modul în care aceasta răspunde la prezența ionilor de calciu.
pentru a înțelege termodinamica care cuplează activarea calmodulinei, trebuie mai întâi să înțelegem concentrația de ioni precum calciu și magneziu într-o celulă eucariotă, inclusiv cea a unui om. Concentrația acestor ioni trebuie reglată îndeaproape. În interiorul celulei, semnalizarea calciului este însoțită de o creștere temporară a concentrației de ioni de calciu, care este simțită de proteine precum calmodulina (Bertini et. al., 636). Această creștere a calciului s-ar putea datora proteinelor g intracelulare care induc reticulul dur și neted să elibereze calciu sau ionii de calciu ar putea fi aduși din spațiul extracelular. În cazul calmodulinei, aceasta răspunde de obicei la introducerea calciului în celulă din exterior, care apare în timpul proceselor precum semnalizarea nervoasă (Bertini et. al. 637). Înainte ca concentrația de calciu să fie crescută momentan, concentrația din interiorul celulei este de obicei între 10-100 nm, în timp ce în timpul fluxului scurt de ioni, concentrația crește la 1.000-100.000 nm. Modificarea concentrației determină calmodulina să simtă ionii de calciu, să-i lege și să inițieze o transducție suplimentară a semnalului (Bertini et. al., 635).
cum, atunci, calmodulina leagă definitiv ionii de calciu și nu, de exemplu, ionii de magneziu? Ionii Mg2 + sunt de fapt destul de asemănători cu ionii de calciu: ei s-ar angaja în interacțiuni electrostatice mai degrabă decât covalente și sunt considerați atomi duri. Motivul pentru care calmodulina pare să favorizeze ionii de calciu mai degrabă decât ionii de magneziu este legat de constantele de legare ale fiecărui ion. Calmodulina poate exista în timp ce este legată de alți ioni, cum ar fi magneziul, dar dacă există o concentrație mai mare de calciu, ionii de calciu vor concura imediat ionii de magneziu pentru a ocupa locurile de legare a calciului. Acest lucru se datorează faptului că constanta de legare a CaM și Ca2+ (Ka) este mai mare decât cea a CaM și Mg2+, așa cum se arată în Figura 7. Acest lucru indică faptul că, atunci când este legat de ionii de calciu, calmodulina ar produce mai multe produse. Trebuie să luăm în considerare toate aceste idei ținând cont de faptul că acest proces se întâmplă de nenumărate ori pe secundă, iar cifra de afaceri a acestei proteine se schimbă pentru a răspunde la concentrația de calciu mereu modulată a celulei.
de ce legarea calmodulinei cu ionii de calciu este mai favorabilă decât cu alte metale? Ar putea fi din cauza dimensiunii ionilor în raport cu obstacolul steric indus de liganzi. Situl de legare este caracterizat de 6 liganzi care realizează 7 legături de coordonate. Deoarece ionii de calciu sunt mai mari decât ionii de magneziu, așa cum s-a demonstrat în Figura 8, este posibil ca calciul să fie favorizat deoarece crește distanța liganzilor unul față de celălalt, scăzând astfel interacțiunile sterice dintre liganzi. Însăși structura proteinei în sine ar putea reprezenta, de asemenea, un motiv pentru selectivitatea ionilor de calciu. În general, se știe că, datorită termodinamicii bazate pe variația concentrației celulare a ionilor de calciu, calmodulina va simți creșterea ionilor, îi va lega și va ajuta la îndeplinirea funcției sale.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (Kcam-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + Mg2+
deoarece kcam-ca > Kcam-mg
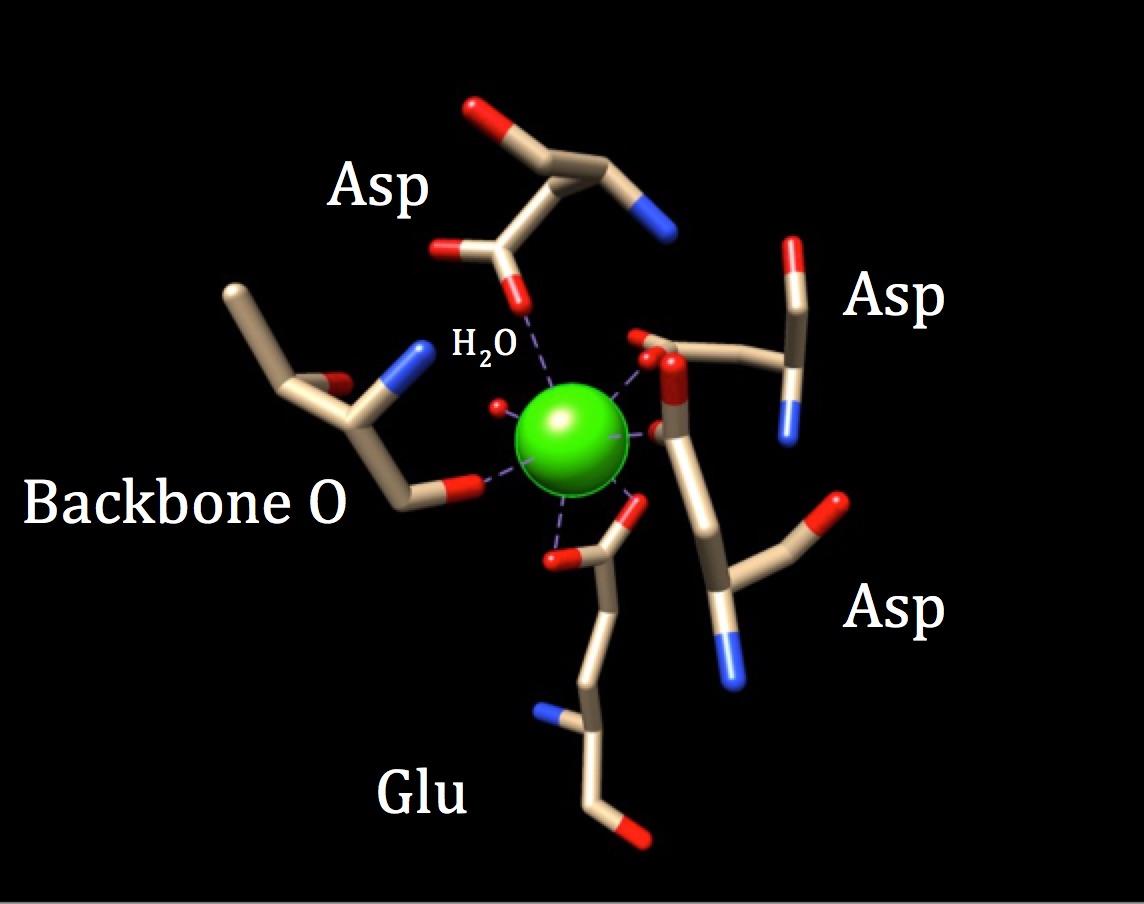
într-o discuție suplimentară a chimiei locului de legare a Calmodulinei, ar trebui explorată geometria coordonării. Deoarece ionul de calciu interacționează cu șapte atomi donatori, sistemul este cunoscut sub numele de sistem heptadentat. Deoarece calmodulina este înconjurată de șase liganzi, s-ar presupune o geometrie de coordonare octaedrică. Dar, deoarece unul dintre liganzi interacționează într—un mod bidentat cu ionul—ceea ce înseamnă că are două legături covalente coordonate provenind de la atomi diferiți într-un singur aminoacid-complexul de coordonare capătă o formă octaedrică distorsionată. Coordonarea specifică este prezentată în figura de mai jos.
geometria de coordonare a situsului de legare a calciului calmodulinei. Ionul metalic de calciu Central este înconjurat de trei asparagine (Asp), un oxigen din coloana vertebrală, un acid gluatmic (Glu) și o moleculă de apă. (Cod PDB 3cln)
de asemenea, ne putem referi la teoria efectului chelat pentru a înțelege mai bine capacitatea calmodulinei de a se lega de ionii metalelor cu afinitate ridicată. Un chelator este un atom care este capabil să se lege cu mai mult de un atom donator. Legarea polidentatului este legată de efectul chelat, care afirmă că atunci când un ligand se leagă de multe grupuri donatoare (poli), legăturile covalente coordonate sunt mult mai puternice sau mai strânse. Această teorie este susținută de termodinamică, în special că legarea polidentatului crește entropia unui sistem, făcându-l mai pozitiv (mai multă tulburare), care este favorabil termodinamic. Aplicarea acestei teorii la calmodulină ajută la explicarea nu numai a importanței legării polidendatului în interiorul siturilor în sine, ci și a necesității ca proteina să lege 4 ioni de calciu diferiți pentru a-și activa funcția. Prin necesitatea esențială a lipirii a patru ioni de Ca2 + în cadrul siturilor, sistemul încurajează o creștere a entropiei prin introducerea mai multor substraturi/reactanți pentru a forma un număr mai mare de produse. Acest lucru se datorează numărului mai mare de legături în interacțiunile ligandului fiecărui loc de legătură. În ansamblu, legarea ionului de calciu în locurile polipeptidei este susținută de teoria efectului chelat și aruncă o lumină asupra eficienței calmodulinei în legarea calciului.
motivele EF-hand au o anumită structură bazată pe faptul că calciul este metalul central. Acest lucru este valabil și pentru locurile de legare a calmodulinei. Ionul Ca2 + se leagă cu atomi asemănători în structurile anumitor aminoacizi pe baza unei teorii numite teoria acido-bazică tare/moale. Această teorie separă metalele și liganzii în două categorii pe baza polarizabilității și a raportului sarcină / rază. Acizii și bazele dure sunt ioni mai mici care au un raport sarcină / dimensiune mai mare, iar acest lucru îi determină să interacționeze în moduri electrostatice (adică atracții între + și – sarcini), în timp ce acizii și bazele moi au dimensiuni mai mari și, prin urmare, au un raport sarcină / rază mai mic, determinându-i să facă legături cu caracter covalent. Expresia „like se leagă cu like” se referă la faptul că acizii și bazele dure tind să interacționeze cu alți atomi duri și același lucru este valabil și pentru acizii și bazele moi. Ca2 + este caracterizat ca un acid dur deoarece, deși are o rază mare, interacționează cu liganzii într-un mod mai ales electrostatic. Când ne uităm la situsul de legare a calciului calmodulinei, se poate observa că ionul de calciu se leagă de atomii de oxigen ai celor 3 acizi aspartici, acid glutamic, apă și carbonil de coloană vertebrală. Această legare este în concordanță cu” like se leagă cu like”, deoarece apa și aminoacizii liganzi, acidul glutamic și acidul asparatic, se leagă prin donatorii de oxigen care sunt caracterizați ca baze dure. Figura 10 revizuiește locurile de legare ale calmodulinei, arătând, de asemenea, lanțurile laterale negative ale aminoacizilor care ar interacționa cu ionii de calciu notați în albastru.
în ceea ce privește atomii donatori ai liganzilor legați și capacitatea lor de a dona perechi de electroni complexului de coordonare, seria spectrochimică explică modul în care atomii interacționează cu metalul central. În cazul situsului de legare a calciului, oxigenii care interacționează cu ionul Ca2+ sunt considerați toți donatori de ca și donatori de Ca, deoarece oxigenii donatori posedă 2 sau mai multe perechi de electroni. Categoriile seirelor spectrochimice care specifică disponibilitatea și donarea electronilor au implicații asupra desemnării spinului (scăzut sau ridicat), care desemnează modul în care electronii d își completează orbitalii și dimensiunea delta (XV) între orbitalii d ai metalului, dar acest lucru nu face diferența pentru calciu, deoarece orbitalii d ai calciului sunt neocupați din cauza absenței electronilor D de valență. Acest lucru face ca orbitalii d să fie în esență neglijabili în majoritatea conversațiilor referitoare la proteină. O excepție este legată de luarea în considerare a labilității ionului de calciu din sistem.
lipsa electronilor în orbitalii D ai Ca produce energie de stabilizare a câmpului ligandului zero și explică labilitatea ridicată a ionului de calciu. Labilitatea se referă la rata la care liganzii pot fi înlocuiți în complexe de coordonare și, prin urmare, descrie cinetica unui sistem. Atomii sunt labili Dacă schimbă rapid liganzi. Datorită funcției sale pertinente în toate celulele eucariote, calmodulina este de așteptat să se lege și să elibereze ioni de calciu de milioane de ori pe secundă pentru a trimite și primi mesaje de la celulele înconjurătoare prin transferul ionilor de calciu. În ceea ce privește capacitatea calmodulinei de a lega și elibera rapid Ca2+, este important să se ia în considerare ocuparea orbitalilor electronilor de valență D. După cum sa menționat, calciul posedă orbitali de valență d goi. Acești orbitali neocupați pot da naștere unei explicații pentru labilitatea unui ion Ca2+. Deoarece toți orbitalii d ai ionului de calciu sunt goi, acesta posedă o energie de stabilizare a câmpului ligandului (LFSE) de 0. Acest lucru indică faptul că calciul este instabil atunci când se ia în considerare LFSE datorită faptului că moleculele stabile au de obicei o valoare negativă pentru LFSE. Instabilitatea în acest caz se traduce printr-o dorință de a reacționa rapid și de a trece mai departe și în afara complexelor, susținând afirmația că ionii de Ca2+ încurajează reacțiile rapide și pot fi caracterizați ca labili. Deși acest lucru pare a fi contraintuitiv la discuția care implică efectul chelat, se înțelege că aceste două teorii nu se contrazic reciproc. Stabilitatea legăturilor de coordonare strânse, sugerată de efectul chelat, încurajează calmodulina să rămână stabilă suficient de mult timp pentru a lega proteinele suplimentare. Odată ce acest lucru este finalizat și concentrația de calciu revine la normal, este eficient în îndepărtarea locului ionilor de calciu.
Calmodulina, bazată pe structura și compoziția locului său vital de legare, joacă o parte integrantă a nenumăratelor procese efectuate de celulele eucariote. Prin acceptarea și legarea ionilor de calciu în transducția semnalului, calmodulina acționează ca o componentă esențială a funcționării de bază și la nivel înalt în organisme precum oamenii. Prin aplicarea teoriei bioinorganice și înțelegerea mediului delicat monitorizat al unei celule eucariote, se poate înțelege în mod corespunzător capacitatea calmodulinei de a selecta ionii de calciu și de a încuraja funcționarea ulterioară care implică mai mult de 100 de proteine partenere.