Calmodulin
this is a video introduction to the calcium signaling protein, calmodulin, from an inorganic chemist’s perspective!
a calmodulina, ou CaM, é um polipéptido ubíquo em todas as células eucarióticas. Esta proteína é conhecida como calmodulina porque é uma proteína modulada pelo cálcio que desempenha um papel vital no processo de transdução do sinal de cálcio. Transdução de sinal de cálcio é o processo através do qual as interações entre iões de cálcio e numerosas proteínas mediam a comunicação entre as células. a função da calmodulina, portanto, é necessária em todas as células eucarióticas, e algumas das tarefas que ela ajuda a realizar São sinalização nervosa, movimento muscular esquelético, e memória. Ao sentir íons de cálcio no ambiente, a calmodulina activa-se e, subsequentemente, actua como um intermediário, iniciando a ligação de proteínas importantes como as cinases, ajudando as nossas células na função básica e sofisticada (“calmodulina”).
o vídeo abaixo demonstra a mudança estrutural que ocorre dentro da CaM durante a ligação ao cálcio (códigos PDB 3CLN e 1CFD).
a proteína em si é 148 aminoácidos de comprimento, com duas regiões globulares contendo 2 motivos EF-hand cada, que são locais característicos dos polipeptídeos mediados pelo cálcio. Quando ativada, a calmodulina abriga 4 Ca2 + iões que mudam drasticamente a forma da proteína. Quando a calmodulina se liga com os iões de cálcio, a proteína abre-se da sua forma apo para a sua forma halo, expondo uma hélice alfa que é conhecida como a região do linker ou da ligação central. Cunhada pela sua flexibilidade, a região central do tirante é a localização da proteína na qual as proteínas parceiras se ligam e contribuem para a cascata que é a mensagem secundária do cálcio. Com base na sua estrutura e na sua necessidade de funcionamento dos iões de cálcio, a calmodulina deve ser capaz de seleccionar iões de cálcio no citoplasma, e as interacções entre o ião e os ligantes nos domínios da EF apoiam esta ideia de selectividade (Bertini et. al., 635-638).
esta imagem é uma representação de como um motivo EF-hand se assemelha a uma mão. O diagrama da fita à esquerda mostra um dos quatro motivos de mão helix-turn-helix EF característicos da calmodulina. (Código PDB 3CLN)
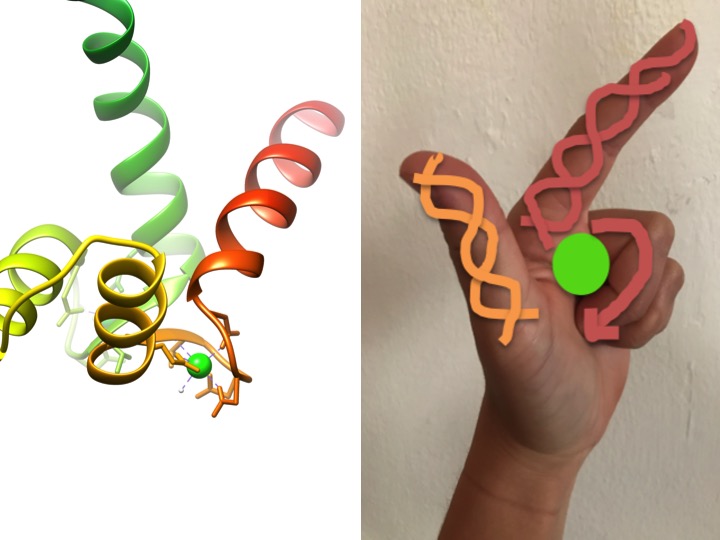
os motivos da EF-hand são regiões estruturais altamente conservadas de proteínas envolvidas na ligação do cálcio. Estas regiões são conhecidas como motivos” mão ” porque se assemelham a uma mão que é feita na forma de um L, onde o íon metálico está localizado no meio do punho, as hélices alfa são indicadas pelo dedo indicador apontando para cima e polegar virado para dentro, e os dedos enrolados representam a região de giro ou loop. Isto é demonstrado na figura acima. Num motivo característico da EF-hand, os aminoácidos incluindo glutamatos, espargos, ácidos aspárticos e ácidos glutâmicos ligam-se a Ca, bem como à água (Bertini et. al. 639). A sequência típica de ligação de domínio EF-hand é mostrada na figura abaixo.
este desenho ilustra os aminoácidos coordenados num domínio típico da EF hand (a composição exacta dos aminoácidos varia!). A linha tracejada representa a coordenação de Ca para o oxigênio de uma carbonila dorsal, enquanto linhas sólidas indicam coordenação para cadeias laterais ou água.
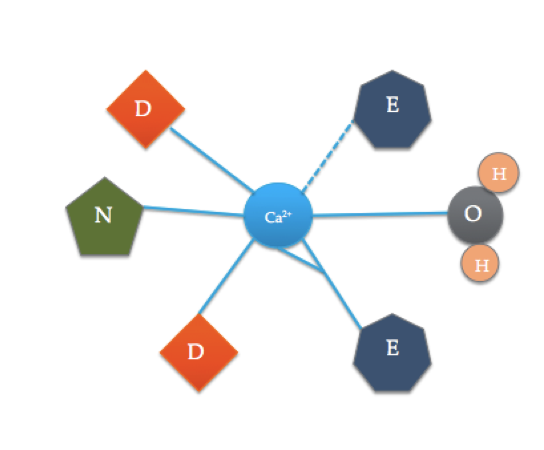
o local de ligação da calmodulina é um pouco diferente do mais típico domínio da EF hand mostrado acima. Os 6 ligantes da calmodulina incluem as cadeias laterais de três ácidos asparáticos (D), 1 ácido glutâmico (e) que forma duas ligações covalentes coordenadas com o íon, 1 molécula de água da solução, e 1 molécula de carbonila da espinha dorsal. O local de ligação da calmodulina consiste num ião Ca2+ rodeado por 6 ligantes, formando 7 ligações.
pode-se notar que o motivo da EF dentro da calmodulina inclui muitos dos mesmos ligandos, apenas em lugares diferentes. Esta conformação pode dar uma idéia de por que a calmodulina é seletiva para o cálcio e como apenas a presença de um íon de cálcio pode satisfazer o local de ligação que faz com que a proteína seja ativada. Isto está relacionado com a termodinâmica da calmodulina dentro da célula e como ela responde à presença de iões de cálcio.
para compreender a termodinâmica que associa a activação da calmodulina, é necessário compreender primeiro a concentração de iões, como o cálcio e o magnésio, numa célula eucariótica, incluindo a de um ser humano. A concentração destes íons deve ser regulada de perto. Dentro da célula, a sinalização do cálcio é acompanhada por um aumento temporário da concentração de iões de cálcio, que é sentido por proteínas como a calmodulina (Bertini et. al., 636). Este pico de cálcio pode ser devido a proteínas G intracelulares que induzem o retículo áspero e liso a libertar cálcio, ou os iões de cálcio podem ser trazidos do espaço extracelular. No caso da calmodulina, ela está geralmente respondendo ao cálcio sendo trazido para a célula a partir do exterior, o que ocorre durante processos como a sinalização nervosa (Bertini et. al. 637). Antes que a concentração de cálcio seja momentaneamente elevada, a concentração dentro da célula é geralmente entre 10-100 nm, enquanto que durante o breve influxo de íons, a concentração aumenta para 1.000-100.000 nm. A mudança de concentração faz com que a calmodulina sinta os iões de cálcio, os Ligue e inicie a transdução de sinais (Bertini et. al., 635).
como, então, a calmodulina liga definitivamente iões de cálcio e não, por exemplo, iões de magnésio? Os iões Mg2+ são, na verdade, bastante semelhantes aos iões de cálcio.: eles se envolveriam em interações eletrostáticas ao invés de covalentes, e eles são considerados átomos duros. A razão pela qual a calmodulina parece favorecer iões de cálcio em vez de iões de magnésio está relacionada com as constantes de ligação de cada íon. A calmodulina pode existir quando ligada a outros íons, como o magnésio, mas se houver uma maior concentração de cálcio, os iões cálcio competirão imediatamente os iões de magnésio para ocupar locais de ligação ao cálcio. Isto porque a constante de ligação de CaM e Ca2+ (Ka) é maior que a de CaM e Mg2+, como mostrado na Figura 7. Isto indica que, quando ligado a iões de cálcio, a calmodulina produziria mais produtos. Deve-se considerar todas estas idéias tendo em mente que este processo acontece inúmeras vezes por segundo, e o turnover desta proteína muda para responder à concentração de cálcio sempre modulada da célula.
porque é que a calmodulina se liga com iões de cálcio mais favorável do que com outros metais? Pode ser devido ao tamanho dos íons em relação ao obstáculo estérico induzido pelos ligantes. O local de ligação é caracterizado por 6 ligandos fazendo 7 ligações coordenadas. Como os íons de cálcio são maiores que os íons de magnésio, como demonstrado na Figura 8, é possível que o cálcio seja favorecido porque aumenta a distância entre os ligantes, diminuindo assim as interações estéricas entre os ligantes. A própria estrutura da proteína poderia também constituir uma razão para a selectividade dos iões de cálcio. No geral, sabe-se que devido à termodinâmica baseada na variação da concentração celular de íons de cálcio, a calmodulina sentirá o aumento de íons, ligá-los, e ajudar a desempenhar a sua função.
CaM + Ca2+ <–> Ca2+CaM (KCaM-Ca)
CaM + Mg2+ <–> Mg2+CaM (KCaM-Mg)
Mg2+-CaM + Ca2+ <–> Ca2+CaM + Mg2+
porque kcam-ca > kcam-mg
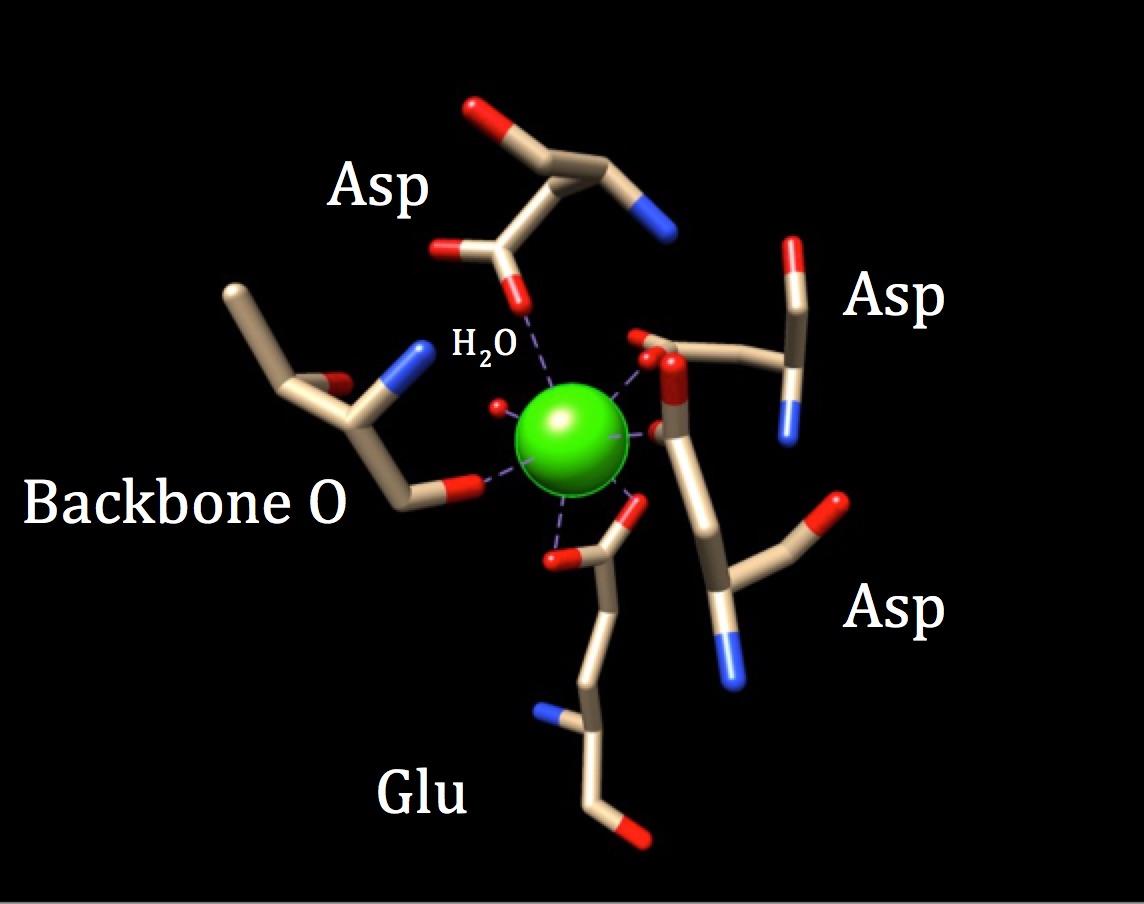
numa outra discussão sobre a química do local de ligação da calmodulina, a geometria de coordenação deve ser explorada. Como o íon de cálcio interage com sete átomos doadores, o sistema é conhecido como um sistema heptadentato. Como a calmodulina está rodeada por seis ligandos, assumiria-se uma geometria de coordenação octaédrica. Mas, porque um dos ligandos interage de forma bidentada com o íon—o que significa que ele tem duas ligações covalentes coordenadas provenientes de átomos diferentes em um aminoácido—o complexo de coordenação assume uma forma octaédrica distorcida. A coordenação específica é descrita na figura abaixo.
a geometria de coordenação do local de ligação da calmodulina ao cálcio. O íon metálico de cálcio central é rodeado por três espargos (Asp), uma coluna vertebral de oxigênio, uma Glu (ácido Glu) e uma molécula de água. (Código PDB 3CLN)
podemos também referir-nos à teoria do efeito quelato para compreender melhor a capacidade da calmodulina de se ligar a iões metálicos com elevada afinidade. Um quelante é um átomo que é capaz de se ligar com mais de um átomo doador. A ligação polidentato está relacionada ao efeito quelato, que afirma que quando um ligando se liga com muitos grupos doadores (poli), as ligações covalentes coordenadas são muito mais fortes, ou mais firmemente mantidos. Esta teoria é apoiada pela termodinâmica, especificamente que a ligação polidentada aumenta a entropia de um sistema, tornando-o mais positivo (mais desordem), que é termodinamicamente favorável. Aplicar esta teoria à calmodulina ajuda a explicar não só a importância da ligação polidendato dentro dos próprios locais, mas também a necessidade da proteína ligar 4 diferentes iões de cálcio para ativar a sua função. Ao exigir essencialmente a ligação de quatro Ca2+ ions dentro dos locais, o sistema incentiva um aumento na entropia, introduzindo mais substratos/reagentes para formar um maior número de produtos. Isto ocorre devido ao maior número de ligações dentro das interações ligando de cada local de ligação. Ao todo, a ligação do ião cálcio nos locais do polipéptido é apoiada pela teoria do efeito quelato e esclarece a eficiência da calmodulina na ligação do cálcio.Os motivos EF-hand têm uma certa estrutura baseada no fato de que o cálcio é o metal central. Isto também se aplica aos locais de ligação da calmodulina. O íon Ca2 + liga-se com átomos semelhantes nas estruturas de certos aminoácidos com base numa teoria chamada Teoria da Base de ácido Duro/Macio. Esta teoria separa metais e ligantes em duas categorias baseadas na polarizabilidade e sua relação carga / raio. Ácidos duros e bases são íons menores que têm uma maior carga em relação ao tamanho, e isso leva – os a interagir de forma eletrostática (significando atrações entre + e-cargas), enquanto ácidos e bases moles são maiores em tamanho e, portanto, têm uma menor carga em relação raio, levando-os a fazer ligações com caráter covalente. A frase “like binds with like” refere-se ao fato de que ácidos e bases duros tendem a interagir com outros átomos duros, e o mesmo vale para ácidos e bases moles. Ca2+ é caracterizado como um ácido duro porque, embora tenha um grande raio, interage com ligantes de uma forma principalmente eletrostática. Ao olhar para o local de ligação de cálcio da calmodulina, pode-se ver que o íon de cálcio se liga aos átomos de oxigênio dos 3 ácidos aspárticos, ácido glutâmico, água e carbonila dorsal. Esta ligação está em linha com” ligações semelhantes com semelhantes ” porque a água e os aminoácidos ligantes, ácido glutâmico e ácido asparático, ligam-se através de dadores de oxigénio que são caracterizados como bases duras. A figura 10 revisita os locais de ligação da calmodulina, mostrando também os traços negativos dos aminoácidos que interagem com os iões de cálcio denotados em azul.
Concerning the door atoms of the bound ligands and their ability to donate electron pairs to the coordination complex, the spectrochemical series explains how the atoms interact with the central metal. No caso do local de ligação ao cálcio, os oxígenos que interagem com o íon Ca2+ são considerados todos dadores σ e dadores π porque os oxigênios dadores possuem 2 ou mais pares de electrões. As Categorias das redes espectroquímicas que especificam disponibilidade de elétrons e doação têm implicações na designação de spin (baixa ou alta), que designa como elétrons d preenchem seus orbitais, e tamanho delta (Δ) entre os orbitais d do metal, mas isso não faz diferença para o cálcio porque os orbitais d do cálcio estão desocupados devido à ausência de elétrons de Valência. Isto faz com que os orbitais d sejam essencialmente insignificantes na maioria das conversas sobre a proteína. Uma exceção está relacionada a considerar a labilidade do íon de cálcio no sistema.
the lack of electrons in Ca’s d orbitals yields zero ligand field stabilization energy, and explains the high lability of the calcium ion. Labilidade refere-se à taxa a que ligandos podem ser substituídos em complexos de coordenação, e portanto descreve a cinética de um sistema. Os átomos são frágeis se trocam ligandos rapidamente. Devido à sua função pertinente em todas as células eucarióticas, espera-se que a calmodulina se ligue e liberte iões de cálcio milhões de vezes por segundo, a fim de enviar e receber mensagens das células circundantes através da transferência de iões de cálcio. Quando se trata da capacidade da calmodulina de se ligar e libertar Ca2+ rapidamente, é importante considerar a ocupação dos orbitais de elétrons de Valência D. Como indicado, o cálcio possui orbitais de Valência d vazios. Estes orbitais desocupados podem dar origem a uma explicação para a labilidade de um íon Ca2+. Como todos os orbitais d do íon de cálcio estão vazios, ele possui uma energia de estabilização de campo ligando (LFSE) de 0. Isto indica que o cálcio é instável quando se considera LFSE devido ao fato de que moléculas estáveis geralmente têm um valor negativo para LFSE. A instabilidade neste caso traduz-se em uma vontade de reagir rapidamente e seguir em frente e para fora dos complexos, apoiando a alegação de que os íons Ca2+ encorajam reações rápidas e podem ser caracterizados como labiais. Embora isto pareça ser contraintuitivo para a discussão envolvendo efeito quelato, entende-se que estas duas teorias não se contradizem. A estabilidade das ligações de coordenação apertadas sugeridas pelo efeito quelato incentiva a calmodulina a permanecer estável o tempo suficiente para ligar as proteínas do suplemento. Uma vez completado e a concentração de cálcio voltar ao normal, é eficiente na remoção do local dos iões de cálcio.
a calmodulina, com base na sua estrutura e na composição do seu local de ligação vital, desempenha uma parte integrante de inúmeros processos realizados pelas células eucarióticas. Através da aceitação e ligação de iões de cálcio na transdução de sinais, a calmodulina actua como um componente essencial do funcionamento básico e de alto nível em organismos como o homem. Através da aplicação da teoria Bioinorgânica e da compreensão do ambiente cuidadosamente monitorizado de uma célula eucariótica, pode-se compreender adequadamente a capacidade da calmodulina para seleccionar iões de cálcio e incentivar o seu funcionamento envolvendo mais de 100 proteínas parceiras.