- 3-D strukturelle træk ved sehas
- Substrukturelle elementer (SSE) i klasse I har
- bindingssteder for UDP-substrater overlapper
- Lys-139 kan dispenseres i Seha ‘ er og har en rolle i substratbinding
- SSE5 binder til polymer og påvirker ha-produktion
- Gln-248 (SSE7) er kritisk med en plausibel rolle i konformationsovergang
- SSEs udviser koordineret bevægelse
- reducerende endepolymerforlængelse i SeHAS, en plausibel tretrinsmekanisme
- Glycosyltransferasereaktion forekommer sandsynligvis i flere trin
- foreslået tre-trins glycosyltransferasereaktion
3-D strukturelle træk ved sehas
en strukturel model af SeHAS-sekvensen blev genereret ved hjælp af Raptors sehas-sekvens26. Modellen blev opnået med cellulosesyntaseskabelon (FBF: 4p00).Skabelonen deler en høj funktionel lighed og en lav sekvens lighed (~15%) med SeHAS25. På trods af den dårlige sekvenslighed til skabelonen er den opnåede model af høj kvalitet som angivet af den globale (P-værdi: 10-8) og absolutte (GDT-score: 52) kvalitetsmålinger26. Stereokemisk kvalitetsvurdering af den strukturelle model indikerer, at 98,5% af restkoncentrationerne befinder sig i det tilladte/delvist tilladte område af Ramachandran-plottet.
Figur 1 viser den strukturelle model af SeHAS. HAS-strukturmodellen viser, at den enkelte kæde foldes ind i tre komponenter: (i) et funktionelt glycosyltransferasedomæne, (ii) fire transmembrane helices (TM1-TM4) og (iii) tre amfipatiske helices (AP1-AP3). Glycosyltransferasedomænet vedtager GT-en fold dannet af blandet 7-strenget kolli-ark omgivet af kolli-spiraler i kolli/kolli-arkitektur. Transmembrane spiraler (TM1-TM4) danner en fire spiralbundt og skaber en pore til polymertranslokation. 11 C-terminale rester af Seha ‘ er forudsiges at være uordnede og ikke vist i Fig. 1. Den oligomeriske karakter af SeHAS undersøges stadig. Indtil 2018 blev SeHAS karakteriseret til at fungere i sin monomere form9. Nylige rapporter viser, at SeHAS fungerer som en homodimer27. Omfanget af det nuværende arbejde er begrænset til vurderingen af funktioner i protomeren.

strukturelle model og funktioner i SeHAS. SSE: Substrukturel element, AP: Amfipatisk spiral, TM: Trans-membran spiral.
den 3-D strukturelle model af SeHAS er i overensstemmelse med tidligere bestemt topologi af HAS i Streptococcus pyogenes afledt ved hjælp af fusion, mærkning og protease tilgængelighedseksperimenter 12,16,19 med en lille forskel i antallet af amfipatiske helices. Vi foreslår tilstedeværelsen af tre amfipatiske helices i stedet for to amfipatiske helices tidligere rapporteret baseret på sammenlignende vurdering med cellulosesyntasestruktur. SeHAS-rester svarende til amfipatisk spiral AP2 er ikke blevet undersøgt specifikt for deres cellulære placering16. Som diskuteret senere i dette manuskript holder denne spiral rester af funktionel betydning.
strukturmodellen forklarer resultaterne af N-ethylmaleimid (NEM) inhibering i SeHAS19. NEM reagerer med thiolgrupper og bruges derfor til at undersøge rollen af cysteinrester i proteiner. SeHAS har fire Cys-rester: Cys-226, Cys-262 og Cys-281 og Cys-367. De første tre cysteinrester er placeret i cytosol og er derfor tilgængelige for NEM, hvilket fører til hæmning. Cys-367 er imidlertid placeret i transmembran spiral og er utilgængelig for NEM. Der indberettes derfor ingen hæmning for denne rest. I nærvær af substrat er NEM vist at binde kun til Cys-281. Vores strukturelle undersøgelser (beskrevet senere) indikerer, at Cys-226 og Cys-262 er placeret i nærheden af UDP-substratbindingsstedet, og tilstedeværelsen af substrat ville således blokere NEM ‘ s adgang til disse rester. Cys – 281 ligger væk fra UDP-bindingsstedet, og tilstedeværelsen af substrat blokerer ikke dette sted for NEM-hæmning.
Substrukturelle elementer (SSE) i klasse I har
der er lidt information om det funktionelle maskineri, der er specifikt for klasse I har. I mangel af 3D-struktur er en funktionel rolle af eksperimentelt studerede steder ikke kendt. For at få en forståelse af de funktionelle komponenter i SeHAS og deres relative disposition i 3-D identificerer vi derfor korte sammenhængende regioner med evolutionært konserverede sekvensfunktioner kaldet substrukturelle elementer (SSE). Vi sammenlignede 81 klasse I har sekvenser opnået gennem strenge udvælgelseskriterier uddybet i afsnittet metoder. Klasse I har forskellige i antallet af transmembrane spiraler. I mangel af strukturelle oplysninger er tilpasningen i denne region af ringe kvalitet. Derfor er sammenligningen af sekvenser begrænset til det cytosoliske område for at undgå steder med tvetydig rest-restkorrespondance. Tilpasningen af har klasse i-sekvenser er tilvejebragt som supplerende Fig. S1, oprettet med Jal. En bevaringsscore beregnes for hver rest-restkorrespondance med hensyn til SeHAS-sekvens. En sammenhængende strækning med gennemsnitlig score >=70 og mindst 2 steder, der scorer > =80, defineres som substrukturelt element (sse). Ved hjælp af disse kriterier identificerer vi 9 substrukturelle elementer, mærket SSE1-SSE9, af potentiel strukturel/funktionel betydning I HAS (Fig. 2). Sekundær struktur for de fleste sses kort til sløjfer undtagen SSE5, SSE8 og SSE9, som forekommer i helices. Disse elementer er også markeret i Fig. 1. Tabel 1 opsummerer sekvensdetaljerne samt SSE ‘ s strukturelle og funktionelle rolle.

et plot af bevarelse score med hensyn til SeHAS sekvensnummer. SSE angivet på toppen. Den sekundære struktur projektion af sekvens er angivet i bunden. Strengene er markeret som pile og spiraler repræsenteret som rektangler. Fyldte rektangler svarer til amfipatiske helices. Se tekst for detaljer.
vores undersøgelsesrapporter bevarede SSE’ er: SSE5 og SSE7, der er specifikke for HAS. Mutationer undersøgt hidtil, svarende til rester Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, har vist sig at påvirke aktiviteten. Mutationer svarende til rester Lys-48, Glu-327, Lys-414, Lys-415 påvirker reaktionshastigheden og/eller molekylvægten af Ha-polymeren18,19,20,21,23. De fleste af disse mutationssteder kortlægges til SSE1-4, 6, 8 og 9 (tabel 1).Andre steder er ikke et bevaret træk ved klasse I har familie. Bi et al. (2015) analyserede forskellige processive glycosyltransferaser og diskuterede tilstedeværelsen af tre variabelt fordelte Asp-rester i glycosyltransferasedomæne, som er afgørende for aktivitet25. Disse inkluderer Asp fra SSE1 i nukleotidbinding, Asp af SSE2 i binding til metal, Asp i SSE8 med en sandsynlig rolle som base. Derudover foreslås en sandsynlig rolle i polymerbinding for rester af SSE9. (2015) foreslog otte Asp / Glu indeholdende tripeptider som potentielle regioner involveret i UDP-sukkerbinding12. For at belyse SSE ‘ s rolle og identificere regioner, der er bindende for UDP-sukkerarter, gennemførte vi dockingsimuleringer.
forventes at have mindst to bindingssteder, det ene for UDP-sukkersubstrater og det andet for polymert sukker til katalysering af en glycosidbindingsdannelse12. For at identificere bindingsstederne i strukturen gennemførte vi docking undersøgelser af UDP-sukker substrater: UDP-N-acetylglucosamin og UDP-glucuronsyre. Bindingsområdet for UDP-substrater vurderes gennem et gitter med dets centrum i glycosyltransferasedomænet som defineret i metoder.
bindingssteder for UDP-substrater overlapper
Docking simuleringer udføres separat for UDP-N-acetylglucosamin og UDP-glucuronsyre. Lavenergikonformatorer (bedre end 5 kcal/mol) vælges. Figur 3a viser hyppigheden af kontakter på forskellige steder med energisk gunstige konformere på tværs af forskellige simuleringskørsler. Polære rester med mindst 10% frekvens til et af de to substrater er vist. Den bemærkelsesværdige observation fra figuren er, at bindingsstederne for de to sukkersubstrater overlapper hinanden.

(a) hyppigheden af ligandkontaktrester for energisk gunstige konformere af UDP-N acetylglucosamin (UDP-GlcNAc) og UDP – d glucuronsyre (UDP-GlcA). Frekvensen er afbildet på H-aksen og steder på Y-aksen. B) Sse1–4, SSE8 og SSE9 ‘ s rolle i UDP-sukkersubstrat-binding. C) Sse6 ‘ s rolle i ligandbinding. D) SSE ‘ ers rolle i polymerbinding. E) Sse7 ‘ s rolle. (i) sse7-sløjfe i hyaluronansyntase, (ii) ækvivalent sløjfe i cellulosesyntase, (iii) ækvivalent sløjfe i ikke-processiv glycosyltransferase. (F) energi minimeret har struktur viser UDP-N-acetylglucosamin og disaccharid af glucuronsyre og N-acetylglucosamin moeities.
de kontaktende restkoncentrationers rolle blev vurderet ved at undersøge bindingen med energisk mest gunstige biologisk relevante konforme. Udvælgelsen af konformeren styres af nærheden af nukleotidring af UDP til den evolutionære konserverede SSE1, der vides at være involveret i nukleotidbinding. De valgte konformere i bindelommen er vist i Fig. 3B. sse1-SSE4, SSE6, SSE8 og SSE9 er involveret i substratbinding (Fig. 3B). SSE1, SSE2 og SSE4 stabiliserer stort set uridindelen af substraterne, mens SSE3, SSE8 og SSE9 interagerer med sukkerringen. Initial binding af UDP-ringen af substratet kunne lettes ved (i) sidekæde af konserveret Asp-103 af SSE2 (blå, Fig. 3B) gennem hydrogenbindinger med polære grupper af nukleotid og (ii) ved aromatisk ring af Tyr-74 (grøn, Fig. 3B) fra SSE1 gennem Kristian-Kristian interaktioner med uridin ring af UDP. Sidekæde af Glu-76 (grøn, Fig. 3B) fra SSE1 danner hydrogenbindinger med polære grupper af ribosesukker af UDP. Rest Asp-161 fra SSE4 stabiliserer OH-gruppen af ribosering, mens Asp-159 stabiliserer metalionen. Gln – 295 og Arg-298 (blå) fra SSE9 kunne interagere og stabilisere pyrophosphatgruppen i UDP-nukleotidet. NE atom af Trp-299 er i h-bindingsafstand til sukkersubstratet og hjælper sandsynligvis med at orientere substratet. Asp – 260 er topologisk ækvivalent med den katalytiske base i cellulosesyntase25. SSE8 holder Asp-260. Sekventielt proksimal til denne Rest er Asp-259 og Arg-261, som begge interagerer med de polære grupper af sukkerringen (grøn). Rest Arg-140, ved siden af Lys-139, er delvist konserveret og erstattes kun med Lys i SeHAS homologer. Denne Rest er tæt på den N-terminale ende af spiralholdingen SSE8 (grøn). Denne ende indeholder negativt ladede Asp-rester, som kunne neutraliseres af Arg-140.
restkoncentrationer fra SSE6 (Fig. 3C) Opret et stillads til at understøtte ligander på bindingsstedet. Sløjfen er strategisk placeret og danner bunden af bindende lomme. Sløjfen sidder også tæt på katalytisk base (SSE8) og det bundne polymere sukker (diskuteret senere). Som diskuteret ovenfor placerer eksperimenter ved anvendelse af N-ethlymaleimid den konserverede Cys-226 af dette element nær UDP-sukkerbindende sted19. Dette er sandsynligvis involveret i at opretholde mikromiljøets PKA på det aktive sted. Selvom det ikke er nødvendigt for aktivitet, er mutation af denne Rest til Ala vist at påvirke aktiviteten i SeHAS19,28. Sidekæde af Ser-227 er sandsynligvis involveret i stabilisering af sløjfekonformationen gennem interaktioner med hovedkæden. Gly – 228 og Pro-229 giver den nødvendige fleksibilitet og stivhed til hovedkædekonformationen (Fig. 3C).
Lys-139 kan dispenseres i Seha ‘ er og har en rolle i substratbinding
Docking-vurderinger antyder en rolle af Lys-139 i ligandbinding. Tidligere undersøgelser har rapporteret en regulerende rolle for denne Rest i pattedyrsformer af HAS. I mus resulterer en mutation til Arg i fuldstændigt aktivitetstab24. I mangel af mutationsundersøgelser i SeHAS, for yderligere at belyse dens rolle, gennemførte vi mutationsundersøgelser af Lys-139. Detaljer om den eksperimentelle opsætning og analyse er beskrevet i metoder. Eksperimentelle resultater og pmbad vektorkort anvendt til undersøgelsen er vist i Fig. 4A, B, henholdsvis. Vi muterede Lys-139 til Arg (K139R) med det formål at bevare ladningen i den position. Mutation førte ikke til fuldstændigt tab af aktivitet, men havde indflydelse. Kun 34% aktivitet (HA-produktion) blev bevaret i sammenligning med kontrol, hvilket gentager en betydelig funktionel rolle af denne rest (Fig. 4A). For yderligere at undersøge den ladningsbaserede interaktion mellem denne Rest og substrat muterede vi positivt ladet Lys-139 til negativt ladet Asp (K139D). Negativ ladning på stedet fører til tilbageholdelse af 82% aktivitet (HA produktion) i sammenligning med kontrol. Denne analyse antyder en rolle for denne Rest i stabilisering af polære grupper af substratet. Udvælgelsen af substitutioner illustrerer yderligere, at både positive og negativt ladede grupper er indkvarteret på stedet. Vores undersøgelser viser, at denne rest direkte påvirker syntaseaktivitet i SeHAS. Mutationer på dette sted forringer syntasefunktionen til betydelige niveauer.

Mutationsstudier på SeHAS. (A) relativ aktivitet af sehas-mutanter udført i denne undersøgelse. Eksperimenter blev udført i triplicater, og standardfejlen for HA-titer lå i området fra kr.0,01 til kr. 0,05. (B) pmbad vektor konstruktion. hasA-og hasB-gener fra Streptococcus subsp. dyrepidemicus blev sekventielt klonet. Til mutationsundersøgelser blev hasA vildtype erstattet med tilsvarende mutant(er).
SSE5 binder til polymer og påvirker ha-produktion
hulrummet over UDP-substratbindingsområdet dannet af amfipatiske helices evalueres for binding af polymerenhed. Polymerbindingsundersøgelsen er begrænset til det terminale disaccharid involveret i glycosidisk bindingsdannelse. Docking-undersøgelser blev udført med HA-disaccharidenhed bestående af et Kurt 1-4-bundet N-acetylglucosamin og D-glucuronsyre i glycosyltransferasedomæne. Energisk gunstige konformere blev valgt. Figur 3D viser en HA disaccharid enhed docket nær bindingslommen. Sse5, SSE8 og SSE9 er involveret i binding (Fig. 3D). Rest Asp – 260 fra SSE8 er i h-bindingsafstand til terminal OH-gruppe af polymeren og er angivet med en stiplet linje i Fig. 3D. Arg-261 fra SSE8 ligger tæt på polymeren og kunne interagere med sukkerets polære OH-grupper. Rest Trp-299 fra SSE9 danner CH-kar-interaktioner med det terminale sukker.
så vidt vi ved, er dette den første rapport, der antager den funktionelle involvering af rester fra SSE5. Vigtige rester i SSE5 involveret i binding til polymeren er Arg-205, Tyr-206, Phe-210 og Arg-214. Arg-205 er tæt på det dokkede disaccharid og involveret i interaktioner med de negativt ladede polære grupper af sukkerdel. Tyr – 206 eller phenylalanin i sehas-homologer ses at stabilisere Arg-205-remanensen gennem kation-Relas-interaktioner. Arg-214 eller Lys i homologe sekvenser er tæt på polymeren og tæt på delvist konserveret Phe-210, med hvilken den danner kation-Relas-interaktioner. Konsekvensen af mutation af restkoncentrationerne fra SSE5 er ikke kendt. Her undersøger vi konsekvensen af mutering af Tyr-206 og Arg-214 på funktion gennem stedstyret mutagenese. Vores eksperimentelle resultater viser, at forstyrrelse af kation-kar-interaktioner ved at mutere det aromatiske tyrosin til alanin (Y206A) resulterer i 99% tab af HA-aktivitet (HA-produktion) (Fig. 4A). Tab af denne interaktion kunne indirekte have påvirket polymerbinding gennem tilstødende Arg-205. Tilsvarende fører mutation af basisk argininrest ved 214 til alanin (R214A) til fuldstændigt tab af funktion (Fig. 4A). Interessant nok fører indførelsen af negativ ladning (R214E) til 93% funktionstab (Fig. 4A). Disse resultater gentager behovet for en nettopositiv ladning på dette sted for at lette polymerbinding og translokation. Disse mutationer indikerer den indbyrdes afhængighed af polymerbinding / translokation og glycosyltransferaseaktiviteter.
endvidere blev energi minimeret ved hjælp af gule kraftfelter. Figur 3F viser bindingen til UDP-N-acetylglucosamin og disaccharid dannet af bundet glucuronsyre og N-acetylglucosamin med glucuronsyre i den polymere ende. Detaljerne om minimeringsprotokollen er beskrevet i metoder.
Gln-248 (SSE7) er kritisk med en plausibel rolle i konformationsovergang
Gln-248 er en konserveret rest I SSE7, en lang sløjfe væk fra bindingsstedet. Den ækvivalente sløjfe i både processive og ikke-processive homologer er sekventielt forskellige og viser forskellige konformationer i substratbundne og ubundne former (Fig. 3E (ii)) 29,30,31 og Fig. 3e (iii) galactosyltransferase 1-4, FBF-kode: 2FYD og 2FY7)32. Sløjfen i SeHAS vil sandsynligvis lette positionering af SSE8 til katalyse. Rest Gln-248 ligger væk fra bindingslommen; den nøjagtige rolle af denne rest kunne ikke forudsiges baseret på disse in-silico-undersøgelser. Interne mutationsundersøgelser viser, at denne Rest er vigtig. Udskiftning af remanensen med Ala resulterer i næsten fuldstændigt tab af HA-produktion (Fig. 4A).Denne rests rolle undersøges yderligere gennem grovkornede dynamiske undersøgelser og diskuteres i et senere afsnit.
SSEs udviser koordineret bevægelse
det nuværende paradigme er struktur-koder-dynamik-koder-funktion33,34,35. Det er i stigende grad blevet erkendt, at tilfældige udsving i atomer i deres oprindelige tilstand skjuler koordineret bevægelse, der disponerer proteinet for funktionelt relevante ændringer i strukturen. Disse bevægelser kan fanges af lavfrekvente tilstande i elastisk netværksmodellering. Disse tilstande er kendt for at være ufølsomme over for strukturelle og energiske detaljer. Derfor brugte vi anisotropisk Netværksmodellering (ANM), en ENM-baseret tilgang til at fange globalt billede af dynamik kodet af 3D-struktur af SeHAS. Vi brugte ProDy36 til ANM-beregninger. Yderligere detaljer er uddybet i afsnittet metoder. Koordineret bevægelse er repræsenteret som korrelationskoefficientværdier mellem knudepunkter i ANM-netværket. De gennemsnitlige korrelationskoefficientværdier blev beregnet ud fra de første 50 tilstande. Figur 5A viser korrelationskortet for SeHAS. Positive korrelationskoefficientværdier er tegn på atomer, der bevæger sig i samme retning. Klynge af rumligt proksimale rester med høj korrelationskoefficient anses for at være strukturelt og funktionelt vigtige. Restparene med store positive værdier svarer til substrukturelle elementer. Endvidere strækker korrelationen mellem restpar sig til regioner på tværs af forskellige SSE. SSE1 – 4 danner et tæt interagerende underdomæne (sort rektangel). Tilsvarende danner SSE5 – 9 et koordineret interagerende underdomæne (gråt rektangel). De to underdomæner er adskilt af en dårligt korreleret region. De iboende globale bevægelser illustrerer funktionel koordinering, der kræves med hensyn til substratbinding i den ene ende, ved SSE1-4 og polymerbinding i den anden ende (SSE5-9).

vurdering af global dynamik i SeHAS. A) gennemsnitlige korrelationskoefficientværdier for Seha ‘ er på tværs af restpar. Gennemsnitlige Korrelationskoefficientværdier for Gln-248 (B) og Thr-283 (C) med andre SEHA-rester.
vi undersøgte yderligere dynamikken i SeHAS med hensyn til Rest Gln-248. Fig. 5B viser fordelingen af korrelationskoefficientværdier i forhold til andre restkoncentrationer i SeHAS. Gln – 248 viser store positive værdier med SSE8, 9 og SSE3, som indeholder katalytiske og substratbindende rester. En koordineret bevægelse med disse SSE ‘ er vurderet gennem ANM illustrerer yderligere sin rolle i funktionelt relevant konformationsdynamik.
ANM-undersøgelsen udvides til at vurdere effekten af mutation på korrelationskoefficientværdierne. For hver af mutanten opnås en strukturel model ved anvendelse af Raptorks26. Mutanterne viser høj strukturel overlapning med en gennemsnitlig Rmsd på omkring 1 liter på tværs af alle atomer med hensyn til VÆGTPROTEINSTRUKTUREN. For hver mutantstruktur beregnes korrelationskoefficientværdier med hensyn til mutantrest og sammenlignes med vægt. Plottene er vist i Fig. S2. Mutationer på sted 214, 248 og 283 udviser væsentlig forskel i værdier i SSE-regioner.
reducerende endepolymerforlængelse i SeHAS, en plausibel tretrinsmekanisme
i prototypiske medlemmer af glycosyltransferasefamilie GT-2, såsom cellulosesyntase,forekommer polymerbiosyntesen fra den ikke-reducerende ende af voksende polymer25, 31. I sådanne systemer fungerer UDP-substrater som en donor, der overfører sukkeret til det polymere sukker, der fungerer som en acceptor24. En Krust-binding mellem sukkerarter er skabt fra Krust-bundne sukker-UDP forstadier gennem en direkte forskydning SN2 substitutionsreaktion. I denne reaktion funktionaliserer et deprotonationstrin af en katalytisk base acceptor24. Nukleofilt angreb fra denne acceptorsukkergruppe på donoren via en enkelt oksocarbeniumionlignende overgangstilstand resulterer i glycosyloverførselsreaktion med frigivelse af UDP fra donorsukkeret og nettoinversion af stereokemi ved anomer kulstof. Denne mekanisme er illustreret i Fig. 6A. SeHAS adskiller sig fra denne prototype. Det er kendt, at HA forlænger fra den reducerende ende12. Dette indebærer, at (i) UDP frigives fra polymerenden og ikke UDP-substrater under katalyse og (ii) reversering af donor og acceptorer med HA-UDP, der fungerer som donor og UDP-sukkersubstrat som acceptor. Baseret på ligandbindende landskab og opnået viden om aktiv stedarkitektur diskuterer vi ligandernes deltagelse som donor og acceptor og foreslår en katalytisk mekanisme til glycosyloverførsel i SeHAS (se Fig. 6B).
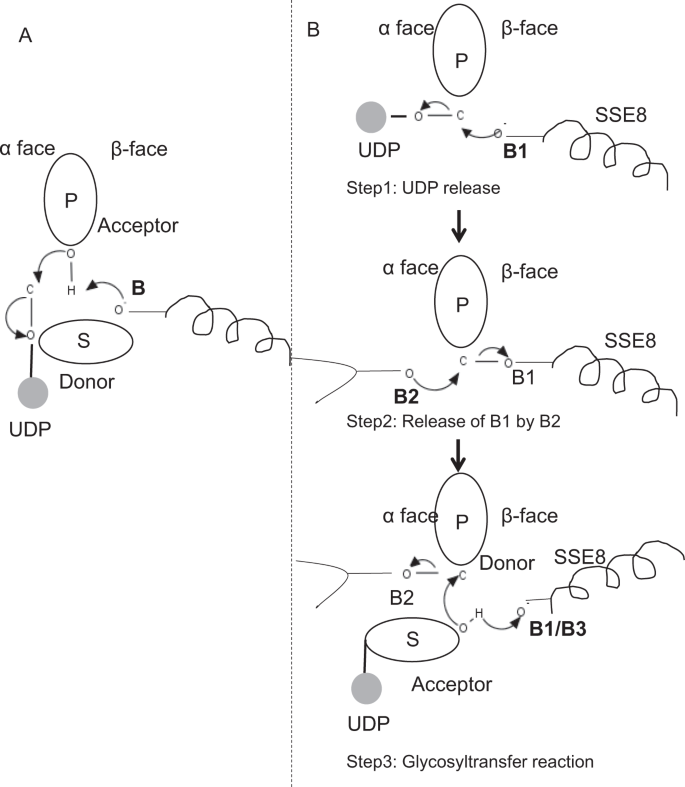
foreslået molekylær mekanisme i SeHAS. (A) mekanisme i en prototypisk glycosyltransferase med inversionskemi. B) foreslået mekanisme i klasse I har. P: polymert sukker, S: Substratsukker.UDP er angivet som en cirkel. B1, B2 og B3 er de katalytiske baser, der deltager i reaktionsmekanismen.
Glycosyltransferasereaktion forekommer sandsynligvis i flere trin
som det første trin undersøgte vi muligheden for en enkelttrins glycosyltransferasereaktion på cellulosesyntaselignende måde. Hvis glycosyltransferasereaktionen forekommer i et trin, ville det på et givet tidspunkt være nødvendigt at holde to UDP-dele, en fastgjort til polymer og anden fastgjort til indgående substrat. I det alternative flertrinsscenarie frigives UDP fra polymer, før katalytisk reaktion opstår. I dette tilfælde, for at skabe nettoinversion af stereokemi, ville reaktionen forekomme i en række ulige antal trin med SN2-mekanisme. For at evaluere hvilket scenario der er mere sandsynligt, gennemførte vi UDP-bindingsundersøgelser gennem docking af UDP-molekyler i glycosyltransferasedomænet. Vurderingen indikerer en signifikant overlapning af UDP-og UDP-substratbindingssteder.Resultatet er præsenteret i supplerende afsnit. En eksemplarisk energisk gunstig konformation af UDP sammen med substrat-og polymerbindingsområder er vist i supplerende Fig. S3. Selvom vurderingen er baseret på den statiske model, placering af to store molekyler af lignende kemisk natur i nærheden af krav til lignende fysiokemiske miljøer er usandsynligt for dette. Vi spekulerer i, at en passage foret med positivt ladede rester fra SSE9 og metalion kunne lette UDP-frigivelse fra polymerenden. Inddragelse af metalion i glycosyltransferase til UDP-frigivelse er også godt dokumenteret24. Da de to UDP-steder ikke udelukker hinanden, forekommer det andet scenario med flertrinsreaktion mere sandsynligt.
når UDP er frigivet fra polymer, ville et nukleofilt angreb fra OH–gruppen af substrat-UDP (acceptor) skabe en glycosidisk binding. For at skabe inversion skal UDP-frigivelse og efterfølgende nukleofilt angreb forekomme fra to modsatte flader af polymert sukker. Vi foreslår rollen som tre basekatalysatorer i det samlede reaktionsprogram, der ligger på donorsukkerens og donorsukkerens ansigter ved polymerenden. Disse trin er illustreret gennem Fig. 6B og beskrevet nedenfor.
foreslået tre-trins glycosyltransferasereaktion
trin1: UDP-frigivelse: Asp-260 fra SSE8 kunne fungere som en base (B1) og initiere frigivelsen af UDP-molekyle fra polymer (donor) fra kurflade. Dette trin ville skabe et kovalent bundet glycosyl-mellemprodukt, der er afskærmet på Prus ansigt med basen B1. For at skabe en inversion skal dette ansigt af sukkeret være frit for nukleofilt angreb fra indkommende sukker-O-H-gruppe. Derfor ville et mellemtrin med det nukleofile angreb fra det røde ansigt frigive det røde ansigt klar til nukleofilt angreb af acceptorsukker.
Trin 2: frigivelse af B1 ved B2; udforskning af thr-283 ‘ s rolle: Base B2 på donorsukkerens ansigt ville udføre et nukleofilt angreb på det anomere kulstof ved reaktionscentret og frigive B1. Vores strukturelle undersøgelser viser konserveret Gln-295 og Thr-283 på dette ansigt. UDP-frigivelse kan resultere i konformationsændringer og bringe en af disse rester i nærheden af donorsukker til katalyse. Mutation af Gln – 295 resulterer i op til 90% tab af aktivitet, men rollen som base er ikke kendt20. Vi vurderede muligheden for en konserveret Thr-283 bosat i en løkke for at fungere som den anden base. Vi muterede Thr til Ser indeholdende en lignende funktionel OH-gruppe og til Ala med lille alifatisk sidekæde. Både t283a og T283S mutanter viser ~95% tab af HA-produktion (Fig. 4A). Denne rest udviser positiv korrelation med regionerne SSE4 og SSE6 og et rumligt proksimalt område mellem rest 186 og Rest 190 (Fig. 5C). Rest 188, skønt den ikke er konserveret, er i nærheden af docket substrat (Fig. 3). Thr-283 viser ikke høj positiv korrelation med SSE8, der holder den katalytiske base. Det er muligt, at remanensen fungerer som en understøttende baserest under katalytisk reaktion med dens bevægelse koordineret med rumligt proksimalt substratbindingsområde uafhængigt af Asp-260 base i SSE8. Yderligere eksperimenter ville være nødvendige for at underbygge dens rolle som base. Samlet set fremhæver undersøgelsen endnu en funktionelt kritisk rest, ikke kendt tidligere.
Trin 3: Glycosyloverførselsreaktion: når B1 er frigivet, blokeres det polymere sukkers anomere carbon for reaktionen. Deprotonering af substrat-UDP på samme ansigt af en tredje base ville skabe en nukleofil gruppe. Dette trin kunne initieres af B1 eller en anden base B3. Asp-259, ved siden af B1 er en stærkt konserveret Rest i nærheden af substrat-UDP og kunne fungere som B3. Imidlertid er B1/B3 tættere på det polymere sukker (donor) som diskuteret i trin1. For at starte deprotonation skal B1 være i nærheden af acceptorsukker. Det kunne opnås gennem konformationsændringer på SSE8 assisteret af SSE7. Den ækvivalente spiral i cellulosesyntase har katalytisk base og gennemgår koordinerede konformationsovergange for glycosyltransferasereaktion og translokation. Et nukleofilt angreb af acceptorsukkeret på det anomere kulstof i donorsukkeret ville skabe en glycosidisk binding og frigivelse af base B2.