- 3-D Sehasin rakenteelliset ominaisuudet
- alaluokassa I on
- UDP-substraattien sidontapaikat limittyvät
- Lys-139 on tarpeeton Sehasissa ja sillä on rooli substraatin sidonnassa
- SSE5 sitoutuu polymeeriin ja vaikuttaa HA: n tuotantoon
- Gln-248 (sse7) on kriittinen ja uskottava rooli konformaatiomuutoksessa
- SSEs exhibitive coordinated motion
- pelkistävä päätypolymeerin venymä SeHAS: ssa, uskottava kolmivaiheinen mekanismi
- Glykosyylitransferaasireaktio tapahtuu todennäköisesti useassa vaiheessa
- ehdotettu kolmivaiheinen glykosyylitransferaasireaktio
3-D Sehasin rakenteelliset ominaisuudet
RaptorX webserver26-menetelmällä luotiin Sehas-sekvenssin Rakennemalli. Malli saatiin selluloosasyntaasimallilla (PDB: 4P00).Templaattientsyymillä on suuri toiminnallinen samankaltaisuus ja alhainen sekvenssin samankaltaisuus (~15%) SeHAS25: n kanssa. Huolimatta huonosta sekvenssin samankaltaisuudesta mallin kanssa, saatu malli on korkealaatuinen, kuten globaalit (P-arvo: 10-8) ja absoluuttiset (GDT-pisteet: 52) laatumittaukset26 osoittavat. Rakennemallin stereokemiallinen laadunarviointi osoittaa, että 98,5 prosenttia jäämistä sijaitsee Ramachandranin havaintoalan sallitulla/osittain sallitulla alueella.
kuvassa 1 on Sehasin Rakennemalli. HAS-Rakennemalli osoittaa, että yksiketju taittuu kolmeen osaan: (i) funktionaalinen glykosyylitransferaasidomeeni, (ii) neljä transmembraanikieli (TM1-TM4) ja (iii) kolme amfipaattista kierteitettä (AP1-AP3). Glykosyylitransferaasi-domeeni omaksuu β/α-arkkitehtuurissa GT-A-kertaiseksi muodostuneen 7-säikeisen β-arkin, jota ympäröivät α-kierteet. Transmembraanikierteet (TM1-TM4) muodostavat neljän helixin nipun ja muodostavat huokosten polymeerin translokaatiolle. 11 C-terminaalisten SeHAS-jäämien ennustetaan olevan sekavia, eikä niitä ole esitetty kuvassa. 1. Sehasin oligomeerisuutta tutkitaan edelleen. Vuoteen 2018 asti SeHAS: n ominaispiirteenä oli toimia monomeerisessa muodossaan 9. Viimeaikaisten raporttien mukaan SeHAS-entsyymi toimii homodimeerinä 27. Nykyinen työ rajoittuu protomeerin ominaisuuksien arviointiin.

Rakennemalli ja ominaisuudet SeHAS. SSE: Substructural element, AP: Amphipathic helix, TM: Trans-membrane helix.
Sehasin 3-D-Rakennemalli on yhdenmukainen Streptococcus pyogenes-bakteerin aiemmin määritetyn topologian kanssa, joka on johdettu fuusio -, merkintä-ja proteaasinesto-kokeista 12,16, 19, joilla on pieni ero amfipaattisten kierteiden määrässä. Ehdotamme, että paikalla on kolme amfipaattista heliisiä kahden aiemmin raportoidun amfipaattisen heliisin sijaan perustuen vertailevaan arviointiin selluloosasyntaasirakenteella. Amfipaattista helix AP2: ta vastaavia SeHAS-jäämiä ei ole erityisesti tutkittu niiden solupaikkaa16. Kuten myöhemmin tässä käsikirjoituksessa, tämä helix omistaa jäämiä toiminnallista merkitystä.
Rakennemalli selittää n-etyylimaleimidin (NEM) eston tulokset sehas19: ssä. NEM reagoi tioliryhmien kanssa, minkä vuoksi sitä käytetään kysteiinijäämien roolin tutkimiseen proteiineissa. Sehasissa on neljä KYS-jäämää: KYS-226, KYS-262 ja kys-281 ja kys-367. Kolme ensimmäistä kysteiinijäämää sijaitsevat sytosolissa, ja siksi ne ovat saatavilla NEM: lle, mikä johtaa inhibitioon. Cys-367 kuitenkin sijaitsee transmembrane helixissä ja on saavuttamattomissa NEM. Tämän vuoksi tämän jäämän osalta ei ole ilmoitettu inhibitiota. Substraatin läsnä ollessa NEM: n on osoitettu sitoutuvan vain Cys-281: een. Rakennetutkimuksemme (kuvattu myöhemmin) osoittavat, että Cys-226 ja Cys-262 sijaitsevat lähellä UDP-substraatin sitoutumispaikkaa ja substraatin läsnäolo estäisi siten ei-aineen pääsyn näihin jäämiin. Cys-281 sijaitsee kaukana UDP-sitoutumiskohdasta, eikä substraatin läsnäolo estä tätä kohtaa ei-estosta.
alaluokassa I on
vain vähän tietoa siitä, mikä on luokan I toiminnallinen koneisto. Koska 3-D-rakennetta ei ole, kokeellisesti tutkittujen kohteiden funktionaalista roolia ei tunneta. Jotta saisimme käsityksen SeHAS: n toiminnallisista komponenteista ja niiden suhteellisesta sijoittumisesta 3-D: hen, tunnistamme lyhyet vierekkäiset alueet, joilla on evolutionaarisesti säilyviä sekvenssiominaisuuksia, joita kutsutaan sub-structural elementeiksi (SSE). Vertailimme 81 Luokka I on sekvenssejä saatu tiukkojen valintakriteerit kehitetty menetelmiä osassa. Luokan I entsyymit eroavat toisistaan transmembraanikierteiden määrässä. Rakennetietojen puuttuessa alueen linjaus on heikkolaatuinen. Siksi sekvenssien vertailu rajoittuu sytosolialueeseen, jotta vältetään kohdat, joissa jäämien ja jäämien välinen vastaavuus on epäselvä. Yhdenmukaistaminen on luokan I sekvenssit annetaan täydentäviä Kuva. S1, luotu Jalview. Säilymispisteet lasketaan jokaisesta jäämien ja jäämien välisestä vastaavuudesta SeHAS-sekvenssin osalta. Osarakenneelementiksi (SSE) määritellään yhtäjaksoinen pätkä, jonka pistekeskiarvo on >=70 ja vähintään 2 aluetta, joiden pistekeskiarvo on >=80. Käyttämällä näitä kriteerejä, tunnistamme 9 osa-rakenneosia, merkitty SSE1-SSE9, potentiaalinen rakenteellinen / toiminnallinen merkitys On HAS (Kuva. 2). Sekundaarirakenne useimpien SSE-karttojen silmukoiksi lukuun ottamatta sse5: tä, SSE8: aa ja sse9: ää, jotka esiintyvät kierteissä. Nämä elementit on myös merkitty Fig. 1. Taulukossa 1 on yhteenveto sekvenssin yksityiskohdista sekä SSE: n rakenteellisesta ja toiminnallisesta roolista.

sehas-järjestysnumeroa koskeva suojelupisteanalyysi. SSE merkitty päälle. Sekundaarirakenneprojektio sekvenssi on merkitty alareunassa. Säikeitä merkitään nuolina ja kierteitä suorakulmioina. Täytetyt suorakulmiot vastaavat amfipaattisia kierteitä. Katso lisätietoja tekstistä.
tutkimusraporttimme ovat säilyneet SSE: SSE5 ja SSE7 erityisesti HAS: lle. Tähän mennessä tutkitut mutaatiot vastaavat jäämiä Tyr-74, Asp-159, ser-218, KYS-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406 ja Arg-413: n on osoitettu vaikuttavan toimintaan. Mutaatiot, jotka vastaavat jäämiä LYS-48, Glu-327, Lys-414, Lys-415,vaikuttavat reaktionopeuteen ja/tai HA-polymeerin molekyylipainoon18,19,20,21, 23. Useimmat näistä mutaatiopaikoista ovat sse1-4, 6, 8 ja 9 (taulukko 1).Muut sivustot eivät ole säilytetty ominaisuus luokan I on perhe. Bi et al. (2015) analysoi erilaisia prossessiivisiä glykosyylitransferaaseja ja käsittelee kolmen vaihtelevasti toisistaan poikkeavan Asp-jäämän esiintymistä glykosyylitransferaasialueella, jotka ovat ratkaisevia aktiivisuudelle25. Näitä ovat, ASP sse1: stä nukleotidisidonnassa, Asp SSE2: sta sitoutumisessa metalliin, Asp sse8: ssa todennäköinen rooli emäksenä. Lisäksi sse9: n jäämille ehdotetaan todennäköistä roolia polymeerien sitoutumisessa. Weigel (2015) ehdotti kahdeksaa ASP/Glu sisältävää tri-peptidiä potentiaalisiksi alueiksi, jotka osallistuvat UDP-sokerin sitomiseen12. SSE: n roolin selventämiseksi ja UDP-sokereihin sitoutuvien alueiden tunnistamiseksi teimme telakointisimulaatioita.
entsyymillä oletetaan olevan vähintään kaksi sitoutumiskohtaa, joista toinen on UDP-sokerin substraateille ja toinen polymeerisokerille glykosidisidosformaation katalysoimiseksi 12. Entsyymin rakenteen sitoutumiskohtien tunnistamiseksi teimme UDP-sokerialustojen telakointitutkimuksia: UDP-n-asetyyliglukosamiinia ja UDP-glukuronihappoa. UDP-substraattien sitoutumisalue arvioidaan hilalla, jonka keskus on glykosyylitransferaasialueella menetelmissä määritellyllä tavalla.
UDP-substraattien sidontapaikat limittyvät
Telakointisimulaatiot tehdään erikseen UDP-n-asetyyliglukosamiinille ja UDP-glukuronihapolle. Valitaan alhaisen energian konformerit (parempi kuin 5 kcal/mol). Kuvassa 3A esitetään eri kohteiden ja energeettisesti suotuisien konformereiden välisten kontaktien tiheys eri simulaatioajoissa. Polaarijäämiä, joiden taajuus on vähintään 10% mille tahansa kahdesta substraatista, on esitetty. Merkittävä havainto kuviosta on, että kahden sokerialustan sidontapaikat ovat päällekkäisiä.

(a) ligandia kontaktoivien jäämien taajuus UDP-n-Asetyyliglukosamiinin (UDP – GlcNAc) ja UDP-D-glukuronihapon (UDP-GlcA) energeettisesti suotuisissa konformeereissa. Taajuus piirretään X-akselilla ja sivustoja Y-akselilla. B) sse1–4: n, SSE8: n ja SSE9: n rooli UDP-sokerialustan sitomisessa. C) Sse6: n rooli ligandien sidonnassa. D) SSE: n rooli polymeerisidonnassa. E) SSE: n rooli 7. i) sse7-silmukka hyaluronaanisyntaasissa, ii) Ekvivalenttisilmukka selluloosasyntaasissa, iii) Ekvivalenttisilmukka ei-prokosessiivisessa glykosyylitransferaasissa. (F) energia minimoitu on rakenne osoittaa UDP-n-Asetyyliglukosamiini ja disakkaridi glukuronihapon ja N-Asetyyliglukosamiini moeities.
kosketusjäämien roolia arvioitiin tutkimalla sitoutumista energeettisesti suotuisimpaan biologisesti merkitykselliseen konformeeriin. Konformerin valintaa ohjaa UDP: n nukleotidirenkaan läheisyys evoluutiossa säilyneeseen SSE1: een, jonka tiedetään osallistuvan nukleotidien sitoutumiseen. Valitut konformerit sidontataskussa on esitetty kuvassa. 3B.sse1-SSE4, SSE6, SSE8 ja SSE9 osallistuvat substraatin sitomiseen (Kuva. 3b). Sse1, sse2 ja SSE4 stabiloivat paljolti substraattien uridiiniosaa, kun taas SSE3, sse8 ja sse9 vuorovaikuttavat sokerirenkaan kanssa. Substraatin UDP-renkaan ensimmäinen sitoutuminen entsyymiin voi olla helpompaa i) SSE2: n (sininen, kuva) säilyneen ASP-103: n sivuketjun avulla. 3B) vetysidosten kautta polaaristen nukleotidiryhmien kanssa ja (ii) Tyr-74: n aromaattisen renkaan (vihreä, kuva. 3B) sse1: stä π-π-vuorovaikutuksiin UDP: n uridiinirenkaan kanssa. Sivuketju Glu-76 (vihreä, kuva. 3B) sse1: stä muodostaa vetysidoksia UDP: n riboosisokerin polaaristen ryhmien kanssa. Jäännös Asp-161 SSE4: stä stabiloi riboosirenkaan OH-ryhmän, kun taas ASP-159 stabiloi metalli-ionin. Sse9: n GLN-295 ja ARG-298 (sininen) voivat vuorovaikuttaa ja stabiloida UDP-nukleotidin pyrofosfaattiryhmän. Trp-299: n NE-atomi on H-sidosetäisyydellä sokerialustaan ja todennäköisesti auttaa substraatin suuntaamisessa. ASP-260 vastaa topologisesti katalyyttistä emäkseä selluloosasyntaasi25: ssä. Sse8: ssa on Asp-260. Peräkkäisinä proksimaaleina tähän jäämään ovat ASP-259 ja Arg-261, jotka molemmat vuorovaikuttavat sokerirenkaan (vihreän) naparyhmien kanssa. Jäämä Arg-140, Lys-139: n vieressä, on osittain säilytetty ja korvattu vain Lys: llä SeHAS-homologeissa. Tämä jäämä on lähellä helix-tilan Sse8 (vihreä) N-terminaalista päätä. Tämä pää sisältää negatiivisesti varautuneita Asp-jäämiä, jotka voidaan neutraloida Arg-140: llä.
jäämät sse6: sta (Kuva. 3C) luo tukiranka ligandien tueksi sidontapaikalle. Silmukka on strategisesti sijoitettu ja muodostaa pohjan sitova tasku. Silmukka on myös lähellä katalyyttistä pohjaa (SSE8) ja sidottua polymeerisokeria (käsitellään myöhemmin). Kuten edellä on käsitelty, kokeet, joissa käytetään N-etlymaleimidia, sijoittavat tämän elementin säilyneen Cys-226: n lähelle UDP-sokeria sitovaa site19: ää. Tämä liittyy todennäköisesti mikroympäristön pKa: n ylläpitämiseen aktiivisella paikalla. Vaikka tämän jäämän mutaatio Ala: ksi ei ole oleellinen toiminnan kannalta, sen on osoitettu vaikuttavan aktiivisuuteen SeHAS19,28. Ser-227: n sivuketju osallistuu todennäköisesti silmukan konformaation stabilointiin vuorovaikutusten kautta pääketjun kanssa. Gly-228 ja Pro-229 tarjoavat tarvittavan joustavuuden ja jäykkyyden pääketjun konformaatioon (Kuva. 3C).
Lys-139 on tarpeeton Sehasissa ja sillä on rooli substraatin sidonnassa
Telakointiarvioiden mukaan Lys-139: n rooli ligandisidonnassa. Aiemmissa tutkimuksissa on raportoitu tämän jäämän sääntelyroolista nisäkkäiden HAS-muodoissa. Hiirellä mutaatio Arg: ksi johtaa täydelliseen toimintakatoon24. Koska SeHAS: ssa ei tehty mutaatiotutkimuksia sen roolin selventämiseksi, teimme Lys-139: n mutaatiotutkimuksia. Kokeellisen asennuksen ja määrityksen yksityiskohdat on kuvattu menetelmissä. Kokeelliset tulokset ja tutkimuksessa käytetty pMBAD-vektorikartta on esitetty kuvassa. 4A, B vastaavasti. Mutatoimme Lys-139: n ARG: ksi (K139R) tarkoituksenamme säilyttää lataus tuossa asennossa. Mutaatio ei johtanut toiminnan täydelliseen häviämiseen, mutta sillä oli vaikutusta. Ainoastaan 34 prosentin aktiivisuus (HA: n tuotanto) säilyi vertailussa valvontaan, joka toistaa tämän jäämän merkittävän toiminnallisen roolin (Kuva. 4 A). Tämän jäämän ja substraatin välisen varaukseen perustuvan vuorovaikutuksen edelleen mittaamiseksi mutatoimme positiivisesti varautuneen Lys-139: n negatiivisesti varautuneeseen Asp: hen (K139D). Negatiivinen varaus kohteessa johtaa 82 prosentin aktiivisuuden (HEHTAARITUOTANTO) säilymiseen verrattuna valvontaan. Tämä analyysi viittaa tämän jäämän rooliin substraatin polaaristen ryhmien stabiloinnissa. Sijamuotojen valinta kuvaa edelleen sitä, että sekä positiiviset että negatiivisesti varautuneet ryhmät majoittuvat paikalle. Tutkimuksemme osoittavat, että tämä jäämä vaikuttaa suoraan syntaasin toimintaan Sehasissa. Mutaatiot tässä kohdassa heikentävät syntaasin toimintaa huomattavasti.

SeHAS – mutaatiotutkimukset. A) tässä tutkimuksessa käytettyjen SeHAS-mutanttien suhteellinen aktiivisuus. Kokeet tehtiin kolmena kappaleena, ja HA-titterin keskivirhe oli ±0,01 – ±0,05. (B) pMBAD vector construct. Streptococcus equi subsp: n hasA-ja hasB-geenit. zooepidemicus kloonattiin peräkkäin. Mutaatiotutkimuksissa hasA wildtype korvattiin vastaavilla mutanteilla.
SSE5 sitoutuu polymeeriin ja vaikuttaa HA: n tuotantoon
amfipaattisten kierteiden muodostaman UDP-substraatin sitoutumisalueen yläpuolella oleva ontelo arvioidaan polymeeriyksikön sitoutumiseksi. Polymeerisitoutumistutkimus rajoittuu glykosidisitoutumiseen osallistuvaan terminaaliseen disakkaridiin. Telakointitutkimukset tehtiin ha-disakkaridiyksiköllä, joka koostui glykosyylitransferaasi-domeenin β 1-4-sidotusta n-asetyyliglukosamiinista ja D-Glukuronihaposta. Valittiin energeettisesti suotuisat konformit. Kuva 3D näyttää HA disakkaridi yksikkö telakoitunut lähellä sitova tasku. Sse5, SSE8 ja SSE9 osallistuvat sidontaan (Kuva. 3D). Jäännös Asp-260 sse8: sta on H-sidosetäisyydellä polymeerin terminaaliseen OH-ryhmään ja se osoitetaan katkoviivalla kuviossa. 3D. Arg-261 sse8: sta sijaitsee lähellä polymeeriä ja voi vuorovaikuttaa sokerin polaaristen OH-ryhmien kanssa. Sse9: n jäämä Trp-299 muodostaa Ch-π-yhteisvaikutuksia terminaalisen sokerin kanssa.
tietojemme mukaan tämä on ensimmäinen raportti, jossa oletetaan SSE5: n jäämien toiminnallista osallisuutta. Sse5: n tärkeimmät polymeeriin sitoutumiseen osallistuvat jäämät ovat Arg-205, Tyr-206, Phe-210 ja Arg-214. Arg-205 on lähellä telakoitunutta disakkaridia ja osallistuu vuorovaikutuksiin sokeriosan negatiivisesti varautuneiden polaariryhmien kanssa. Tyr-206: n tai SeHAS-homologien fenyylialaniinin nähdään stabiloivan ARG-205: n jäämiä kationi-π-interaktioiden avulla. ARG-214 tai Lys on homologisissa sekvensseissä lähellä polymeeriä ja lähellä osittain säilynyttä Phe-210: tä, jonka kanssa se muodostaa kationi-π-vuorovaikutuksia. Sse5: n jäämien mutaation seurauksia ei tunneta. Tässä tutkimme Tyr-206: n ja Arg-214: n mutatoitumisen seurauksia. Kokeelliset tuloksemme osoittavat, että kationien-π-vuorovaikutusten häiriintyminen mutatoimalla aromaattinen tyrosiini alaniiniksi (Y206A) johtaa 99%: n menetykseen HAS-aktiivisuudesta (HA-tuotanto) (Kuva. 4 A). Tämän vuorovaikutuksen häviäminen on voinut epäsuorasti vaikuttaa polymeerin sitoutumiseen viereisen Arg-205: n kautta. Vastaavasti emäksisen arginiinijäämän mutaatio 214: ssä alaniiniksi (R214A) johtaa toiminnan täydelliseen häviämiseen (Fig. 4 A). Mielenkiintoista on, että negatiivisen varauksen (R214E) käyttöönotto johtaa 93%: n funktion menetykseen (Kuva. 4 A). Nämä tulokset toistavat positiivisen nettovarauksen tarpeen tässä kohdassa polymeerin sitoutumisen ja translokaation helpottamiseksi. Nämä mutaatiot viittaavat polymeerisitoutumisen/translokaation ja glykosyylitransferaasiaktiivisuuden keskinäisriippuvuuteen.
edelleen kahden ligandin (UDP-sokeri ja disakkaridi) kanssa kompleksoituneen entsyymin energia minimoitiin MERIPIHKAISTEN voimakenttien avulla. Kuvassa 3F on entsyymi, joka on sitoutunut UDP-N-asetyyliglukosamiiniin ja disakkaridiin, jotka muodostuvat glukuronihaposta ja n-asetyyliglukosamiinista, joiden polymeeripäässä on glukuronihappoa. Minimointiprotokollan yksityiskohdat on kuvattu menetelmin.
Gln-248 (sse7) on kriittinen ja uskottava rooli konformaatiomuutoksessa
Gln-248 on sse7: ssä säilyvä jäännös, joka on pitkän silmukan päässä sitoutumiskohdasta. Ekvivalenttisilmukka sekä prossessiivisissa että ei-prossessiivisissa homologeissa on peräkkäisesti erilainen ja siinä on erillisiä konformaatioita substraattiin sitoutuneissa ja sitoutumattomissa entsyymimuodoissa (Fig. 3E (ii)) 29,30,31 ja kuva. 3e (iii) β 1-4 galaktosyylitransferaasi, PDB-koodi: 2FYD ja 2FY7) 32. Sehasin silmukka todennäköisesti helpottaa sse8: n sijoittelua katalyysia varten. Jäämä Gln-248 on kaukana sitovasta taskusta; tämän jäämän tarkkaa roolia ei voitu ennustaa näiden in-silico-tutkimusten perusteella. Sisäiset mutaatiotutkimukset osoittavat, että tämä jäämä on tärkeä. Jäämän korvaaminen Ala: lla johtaa lähes täydelliseen HA: n tuotannon menetykseen (Kuva. 4 A).Tämän jäämän roolia tutkitaan edelleen karkearakeisilla dynaamisilla tutkimuksilla, ja sitä käsitellään myöhemmässä jaksossa.
SSEs exhibitive coordinated motion
the current paradigm is structure-encodes-dynamics-encodes-function33,34,35. On yhä selvemmin huomattu, että atomien satunnaiset vaihtelut niiden synnyintilassa kätkevät sisäänsä koordinoidun liikkeen, joka altistaa proteiinin toiminnallisesti merkittäville rakenteellisille muutoksille. Nämä liikkeet voidaan kaapata matalien taajuuksien moodeilla elastisessa verkostomallinnuksessa. Näiden tilojen tiedetään olevan herkkiä rakenteellisille ja energisille yksityiskohdille. Siksi käytimme anisotrooppista Verkostomallinnusta (ANM), ENM-pohjaista lähestymistapaa, joka kuvasi maailmanlaajuisesti Sehasin 3-D-rakenteen koodaamaa dynamiikkaa. Käytimme ProDy36 ANM laskelmia. Tarkempia tietoja on esitetty Menetelmäosiossa. Koordinoitu liike esitetään ANM-verkon solmujen välisinä korrelaatiokertoimen arvoina. Keskimääräiset korrelaatiokertoimen arvot laskettiin 50 ensimmäisen moodin perusteella. Kuvassa 5A esitetään SeHAS: n korrelaatiokartta. Positiiviset korrelaatiokertoimen arvot kertovat samaan suuntaan liikkuvista atomeista. Alueellisesti proksimaalisten jäämien klusteria, jolla on korkea korrelaatiokerroin, pidetään rakenteellisesti ja toiminnallisesti merkittävänä. Jäämäparit, joilla on suuret positiiviset arvot, vastaavat osarakenneelementtejä. Lisäksi jäämäparien välinen korrelaatio ulottuu eri SSE: n alueille. SSE1-4 muodostaa tiiviisti vuorovaikutuksessa olevan aliverkkotunnuksen (musta suorakulmio). Vastaavasti SSE5-9 muodostaa koordinoidun vuorovaikutteisen aliverkkotunnuksen (harmaa suorakulmio). Kahta alidomaania erottaa heikosti korreloiva alue. Sisäiset globaalit liikkeet kuvaavat toiminnallista koordinaatiota, jota vaaditaan substraatin sitomisessa toiseen päähän sse1-4: llä ja polymeerisitomisessa toiseen päähän (sse5-9).

arviointi global dynamics SeHAS. A) SeHAS: n keskimääräiset korrelaatiokertoimen arvot jäämäpareille. GLN-248 (B): n ja Thr-283 (C): n keskimääräiset korrelaatiokertoimen arvot muiden SeHAS-jäämien kanssa.
tutkimme edelleen SeHAS: n dynamiikkaa GLN-248: n jäämien suhteen. Kuva. 5B osoittaa korrelaatiokertoimen arvojen jakautumisen muiden SeHAS-jäämien osalta. Gln-248 näyttää suuria positiivisia arvoja sse8, 9 ja SSE3, jotka pitävät katalyyttistä ja substraattia sitovia jäämiä. Koordinoitu liike näiden SSE: iden kanssa ANM: n kautta arvioituna kuvaa edelleen sen roolia toiminnallisesti merkityksellisessä konformaatiodynamiikassa.
ANM-tutkimusta laajennetaan arvioimaan mutaation vaikutusta korrelaatiokertoimen arvoihin. Jokaiselle mutantille saadaan Rakennemalli RaptorX26: n avulla. Mutanteilla on suuri rakenteellinen päällekkäisyys, Kun keskimääräinen RMSD on noin 1 Å kaikkien atomien välillä suhteessa WT-proteiinin rakenteeseen. Jokaisen mutanttirakenteen osalta lasketaan korrelaatiokertoimen arvot mutanttijäämän suhteen ja verrataan WT: hen. Tontit on esitetty kuvassa. S2. Mutaatioissa kohdissa 214, 248 ja 283 on huomattavia eroja SSE-alueiden arvoissa.
pelkistävä päätypolymeerin venymä SeHAS: ssa, uskottava kolmivaiheinen mekanismi
glykosyylitransferaasiperheen GT-2 prototyyppisissä jäsenissä,kuten selluloosasyntaasissa, polymeerin biosynteesi tapahtuu kasvupolymeerin pelkistämättömästä päästä 25, 31. Tällaisissa järjestelmissä UDP-substraatit toimivat luovuttajana, joka siirtää sokerin polymeerisokeriin, joka toimii hyväksyjänä24. Sokereiden välille syntyy β-sidos α-sidoksista sokeri-UDP-lähtöaineista suoran siirtymän SN2-substituutioreaktiolla. Tässä reaktiossa katalyyttisen emäksen suorittama deprotonointivaihe funktionalisoi acceptorin 24. Nukleofiilinen hyökkäys tämän hyväksyjäsokeriryhmän toimesta luovuttajaan yhden oksokarbeniumionimaisen siirtymätilan kautta johtaa glykosyylinsiirtoreaktioon, jossa luovuttajasokerista vapautuu UDP: tä ja anomeerisessa hiilessä stereokemia nettominersoituu. Tämä mekanismi on kuvattu Fig. 6A. SeHAS eroaa tästä prototyypistä. Tiedetään, että HA venyy pelkistyvästä lopusta12. Tämä tarkoittaa, että I) UDP: tä vapautuu polymeerin päästä eikä UDP-substraateista katalyysin aikana ja ii) luovuttajien ja hyväksyjien kääntyminen HA-UDP: n toimiessa luovuttajana ja UDP-sokerialustan toimiessa hyväksyjänä. Perustuen maisemaan ligandien sitomisesta ja saadun tiedon aktiivisesta sivuston arkkitehtuurista, keskustelemme ligandien osallistumisesta luovuttajana ja hyväksyjänä ja ehdotamme katalyyttistä mekanismia glykosyylin siirtoon Sehasissa (viite Kuva. 6b).
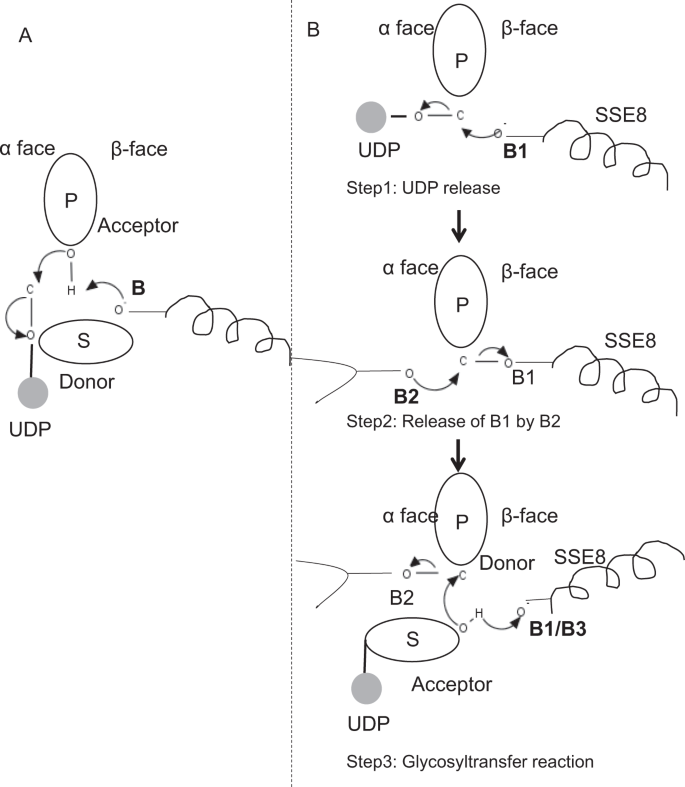
ehdotettu molekyylimekanismi Sehasissa. (A) mekanismi prototyyppisessä glykosyylitransferaasissa, jolla on inversiokemia. B) ehdotettu järjestelmä luokassa I on. P: Polymeerisokeri, S: Substraattisokeri.UDP merkitään ympyränä. B1, B2 ja B3 ovat reaktiomekanismiin osallistuvat katalyyttiset emäkset.
Glykosyylitransferaasireaktio tapahtuu todennäköisesti useassa vaiheessa
ensimmäisenä vaiheena selvitimme yksivaiheisen glykosyylitransferaasireaktion mahdollisuutta selluloosasyntaasin kaltaisella tavalla. Jos glykosyylitransferaasireaktio tapahtuu yhdessä vaiheessa, entsyymillä on tiettynä aikana oltava kaksi UDP-osaa, joista toinen on kiinnittynyt polymeeriin ja toinen saapuvaan substraattiin. Vaihtoehtoisessa monivaiheisessa skenaariossa polymeerin UDP vapautuu ennen katalyyttisen reaktion alkamista. Tällöin stereokemian nettonversioiden aikaansaamiseksi reaktio tapahtuisi parittomien vaiheiden sarjassa SN2-mekanismilla. Arvioidaksemme, kumpi skenaario on todennäköisempi, teimme UDP: n sitoutumistutkimuksia telakoimalla UDP-molekyylejä glykosyylitransferaasialueella. Arviointi osoittaa, että UDP: n ja UDP: n ja substraatin sidontapaikat ovat merkittävästi päällekkäisiä.Tulos on esitetty täydentävässä jaksossa. Yksi esimerkillinen energeettisesti suotuisa konformaatio UDP sekä substraatin ja polymeerin sitova alueet on esitetty täydentävässä Kuvassa. S3. Vaikka arviointi perustuu staattiseen malliin, kahden kemialliselta luonteeltaan samankaltaisen suuren molekyylin sijoittaminen lähelle fysikaaliskemiallisten ympäristöjen vaatimuksia on epätodennäköistä tämän entsyymin osalta. Spekuloimme, että väylä, joka on vuorattu positiivisesti varautuneilla jäämillä SSE9: stä ja metalli-ionista, voisi helpottaa UDP: n vapautumista polymeerin päästä. Myös metalli-ionin osallisuus glykosyylitransferaasissa UDP: n vapautumisessa on hyvin dokumentoitu 24. Koska nämä kaksi UDP-aluetta eivät ole toisiaan poissulkevia, monivaiheisen reaktion toinen skenaario näyttää todennäköisemmältä.
kun UDP: tä vapautuu polymeeristä, substraatti–UDP: n OH-ryhmän (acceptor) nukleofiilinen hyökkäys aiheuttaisi glykosidisen sidoksen. Inversioiden aikaansaamiseksi UDP: n vapautumisen ja sitä seuraavan nukleofiilisen hyökkäyksen on tapahduttava polymeerisokerin kahdelta vastakkaiselta taholta. Ehdotamme kolmen emäksisen katalyytin roolia kokonaisreaktiojärjestelmässä, jotka sijaitsevat luovuttajasokerin α-Ja β-pinnoilla polymeeripäässä. Nämä vaiheet on havainnollistettu Fig. 6B ja kuvattu alla.
ehdotettu kolmivaiheinen glykosyylitransferaasireaktio
Vaihe1: UDP: n vapautuminen: Sse8: n Asp-260 voi toimia emäksenä (B1) ja aloittaa UDP-molekyylin vapautumisen polymeeristä (luovuttaja) α-pinnasta. Tämä vaihe loisi kovalenttisesti sitoutuneen glykosyylikoentsyymin välituotteena β-pinnalla emäs B1: n kanssa. Inversioiden luomiseksi sokerin tämän pinnan on oltava vapaa tulevan sokerin o-h-ryhmän nukleofiiliselle hyökkäykselle. Näin ollen välivaihe, jossa nukleofiilinen hyökkäys α-pinnalta vapauttaisi nukleofiilisen hyökkäyksen kohteeksi joutuneen β-tahon hyväksyvän sokerin avulla.
Vaihe 2: B1: n vapautuminen B2: lla; Thr-283: n roolin tutkiminen: emäs B2 luovuttajasokerin α-pinnalla suorittaisi nukleofiilisen hyökkäyksen anomeeriseen hiileen reaktiokeskuksessa ja vapauttaisi B1: n. Rakennetutkimuksemme osoittavat Gln-295: n ja Thr-283: n säilyneen näillä kasvoilla. UDP: n vapautuminen voi johtaa konformaatiomuutoksiin ja tuoda yhden näistä jäämistä lähelle luovuttajasokeria katalyysiä varten. GLN-295: n mutaatio johtaa jopa 90%: n aktiivisuudenhäviöön, mutta sen merkitystä tukikohtana ei tunneta 20. Arvioimme mahdollisuutta, että thr-283 voisi toimia toisena tukikohtana. Me mutatoimme Thr: n ser: ksi, joka sisältää samankaltaisen toiminnallisen OH-ryhmän, ja Ala: ksi, jossa on pieni alifaattinen sivuketju. Molemmat, T283A ja T283S mutantit osoittavat ~95% menetys HA tuotanto (Kuva. 4 A). Tällä jäämällä on positiivinen korrelaatio alueiden SSE4 ja SSE6 kanssa ja spatiaalisesti proksimaalinen alue jäämän 186 ja jäämän 190 välillä (Kuva. 5c). Jäämä 188, vaikka ei säily, on telakoituneen substraatin läheisyydessä (Kuva. 3). Thr-283 ei osoita suurta positiivista korrelaatiota sse8: n kanssa, jossa on katalyyttinen pohja. On mahdollista, että jäännös toimii tukialustana katalyyttisen reaktion aikana ja sen liike koordinoituu spatiaalisesti proksimaalisen substraatin sitoutumisalueen kanssa riippumatta ASP-260: n emäksestä sse8: ssa. Lisäkokeita tarvittaisiin sen aseman vahvistamiseksi pohjana. Kaiken kaikkiaan tutkimus nostaa esiin vielä yhden toiminnallisesti kriittisen jäämän, jota ei ole aiemmin tunnettu.
Vaihe 3: Glykosyylinsiirtoreaktio: kun B1 vapautuu, polymeerisokerin anomeerisen hiilen β-pinta vapautuu reaktiota varten. Substraatti-UDP: n deprotonoituminen samalle pinnalle kolmannen emäksen avulla synnyttäisi nukleofiilisen ryhmän. Tämän vaiheen voi aloittaa B1 tai jokin muu tukikohta B3. ASP-259, B1: n vieressä on erittäin säilyvä jäännös substraatti-UDP: n läheisyydessä ja voisi toimia B3: na. B1 / B3 on kuitenkin lähempänä polymeerisokeria (luovuttajaa), kuten kohdassa 1 käsitellään. Deprotonaation aloittamiseksi B1: n on oltava lähellä acceptor-sokeria. Se voitaisiin saavuttaa konformaatiomuutoksilla sse8: ssa sse7: n avustamana. Selluloosasyntaasin ekvivalenttinen helix sisältää katalyyttisen emäksen, ja se käy läpi koordinoituja konformaatiomurroksia glykosyylitransferaasireaktiota ja translokaatiota varten. Hyväksyjäsokerin nukleofiilinen hyökkäys luovuttajasokerin anomeeriseen hiileen synnyttäisi glykosidisen sidoksen ja vapauttaisi emäksen B2.