- 3-D cechy strukturalne SeHAS
- Elementy Podstrukturalne (SSE) w klasie i ma
- miejsca wiązania substratów UDP pokrywają się
- Lys-139 jest zbędny w SeHAS i odgrywa rolę w wiązaniu substratów
- sse5 wiąże się z polimerem i wpływa na produkcję HA
- Gln-248 (SSE7) jest krytyczny z prawdopodobną rolą w przejściu konformacji
- SSEs wykazują ruch skoordynowany
- zmniejszenie wydłużenia końcowego polimeru w SeHAS, prawdopodobny trójstopniowy mechanizm
- reakcja Glikozylotransferazy zachodzi prawdopodobnie w wielu etapach
- proponowana trzyetapowa reakcja glikozylotransferazy
3-D cechy strukturalne SeHAS
model strukturalny sekwencji SeHAS został wygenerowany przy użyciu RaptorX webserver26. Model uzyskano za pomocą szablonu syntazy celulozy (PDB: 4P00).Enzym szablonowy charakteryzuje się wysokim podobieństwem funkcjonalnym i niskim podobieństwem sekwencji (~15%) z SeHAS25. Pomimo słabego podobieństwa sekwencji do szablonu, uzyskany model jest wysokiej jakości, na co wskazują globalne (wartość P: 10-8) i bezwzględne (wynik GDT: 52) miary jakości26. Ocena jakości Stereo-chemicznej modelu strukturalnego wskazuje, że 98,5% pozostałości znajduje się w dozwolonym/częściowo dozwolonym obszarze działki Ramachandranu.
Rysunek 1 przedstawia model strukturalny SeHAS. Model strukturalny HAS pokazuje, że pojedynczy łańcuch składa się na trzy elementy: (i) funkcjonalna domena glikozylotransferazy, (ii) cztery helisy przezbłonowe (TM1-TM4) i (iii) trzy helisy amfipatyczne (AP1-AP3). Domena glikozylotransferazy przyjmuje GT-fałd utworzony przez mieszany 7-nitkowy arkusz β otoczony helisami α w architekturze β / α. Helisy Transmembrane (TM1-TM4) tworzą wiązkę czterech Helis i tworzą pory dla translokacji polimeru. 11 przewiduje się, że końcowe pozostałości SeHAS są nieuporządkowane i nie są pokazane na Fig. 1. Oligomeryczny charakter SeHAS jest nadal badany. Do 2018 roku SeHAS funkcjonował w formie monomerycznej9. Ostatnie doniesienia wskazują, że enzym SeHAS działa jako homodimer27. Zakres niniejszej pracy ogranicza się do oceny cech w protomerze.

Model strukturalny i cechy SeHAS. SSE: element Substrukturalny, AP: helisa Amfipatyczna, TM: helisa Trans-membranowa.
trójwymiarowy model strukturalny SeHAS jest zgodny z wcześniej ustaloną topologią HAS w Streptococcus pyogenes uzyskaną przy użyciu eksperymentów fuzji, znakowania i dostępności proteaz12,16, 19 z niewielką różnicą w liczbie Helis amfipatycznych. Proponujemy obecność trzech Helis amfipatycznych zamiast dwóch Helis amfipatycznych wcześniej zgłoszonych na podstawie oceny porównawczej ze strukturą syntazy celulozowej. Pozostałości SeHAS odpowiadające helisie amfipatycznej AP2 nie zostały zbadane specjalnie pod kątem ich lokalizacji komórkowej16. Jak omówiono później w tym rękopisie, helisa ta posiada pozostałości o znaczeniu funkcjonalnym.
model strukturalny wyjaśnia wyniki hamowania N-etylomaleimidu (NEM)w SeHAS19. NEM reaguje z grupami tiolowymi i dlatego jest stosowany do badania roli reszt cysteiny w białkach. SeHAS ma cztery pozostałości Cys: Cys-226, Cys-262 i Cys-281 i Cys-367. Pierwsze trzy reszty cysteiny znajdują się w cytozolu i dlatego są dostępne dla NEM, co prowadzi do hamowania. Cys-367 znajduje się jednak w helisie transbłonowej i jest niedostępny dla NEM. W związku z tym nie odnotowano hamowania dla tej pozostałości. W obecności substratu NEM wiąże się tylko z Cys-281. Nasze badania strukturalne (opisane później) wskazują, że Cys-226 i Cys-262 znajdują się w pobliżu miejsca wiązania UDP-substrat, a obecność substratu blokuje w ten sposób dostęp NEM do tych pozostałości. Cys – 281 leży z dala od miejsca wiązania UDP, a obecność substratu nie blokuje tego miejsca przed hamowaniem NEM.
Elementy Podstrukturalne (SSE) w klasie i ma
niewiele jest informacji na temat maszyn funkcjonalnych specyficznych dla klasy i ma. W przypadku braku struktury 3D nie jest znana funkcjonalna rola doświadczalnie badanych miejsc. Dlatego, aby zrozumieć elementy funkcjonalne w SeHAS i ich względne rozmieszczenie w 3-D, identyfikujemy krótkie sąsiadujące regiony z ewolucyjnie zachowywanymi cechami sekwencji nazywanymi elementami substrukturalnymi (SSE). Porównaliśmy 81 sekwencji klasy I uzyskanych dzięki rygorystycznym kryteriom selekcji opracowanym w dziale metody. Klasa I ma enzymy różniące się liczbą Helis przezbłonowych. Ze względu na brak informacji strukturalnych dostosowanie w tym regionie jest niskiej jakości. W związku z tym porównanie sekwencji ogranicza się do regionu cytozolowego, aby uniknąć miejsc o niejednoznacznej zgodności pozostałość-pozostałość. Wyrównanie sekwencji HAS klasy I jest podane jako uzupełnienie rys. S1, utworzone za pomocą Jalview. Wynik zachowania jest obliczany dla każdej zgodności pozostałości z pozostałościami w odniesieniu do sekwencji SeHAS. Ciąg dalszy o średniej punktacji >=70 i co najmniej 2 miejscach punktacji > = 80 jest zdefiniowany jako element substrukturalny (SSE). Na podstawie tych kryteriów identyfikujemy 9 elementów substrukturalnych, oznaczonych SSE1-SSE9, o potencjalnym znaczeniu strukturalno-funkcjonalnym w HAS (rys. 2). Struktura Drugorzędna dla większości SSE mapuje pętle z wyjątkiem SSE5, SSE8 i sse9, które występują w helisach. Elementy te są również oznaczone na Rys. 1. W tabeli 1 podsumowano szczegóły sekwencji, a także strukturalną i funkcjonalną rolę SSE.

Wykres punktacji ochrony w odniesieniu do numeru sekwencji SeHAS. SSE wskazane na górze. Rzut struktury wtórnej sekwencji jest wskazany na dole. Nici są oznaczone jako Strzałki i helisy reprezentowane jako prostokąty. Wypełnione prostokąty odpowiadają helisom amfipatycznym. Szczegóły w tekście.
nasze raporty z badań zachowały SSE: sse5 i sse7 specyficzne dla HAS. Mutacje badane do tej pory, odpowiadające pozostałościom Tyr-74, Asp-159, Ser – 218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, wykazały wpływ na aktywność. Mutacje odpowiadające pozostałościom Lys-48, Glu-327, Lys-414,Lys-415 wpływają na szybkość reakcji i/lub masę cząsteczkową polimeru HA18,19,20,21, 23. Większość z tych miejsc mutacji mapuje się do SSE1-4, 6, 8 i 9 (Tabela 1).Inne miejsca nie są zachowaną cechą klasy i ma rodzinę. Bi i in. (2015) przeanalizował różnorodne glikozylotransferazy procesywne i omówił obecność trzech różnie rozmieszczonych reszt Asp w domenie glikozylotransferazy, które są kluczowe dla aktywności25. Należą do nich Asp z SSE1 w wiązaniu nukleotydowym, Asp z SSE2 w wiązaniu z metalem, Asp w Sse8 z prawdopodobną rolą jako zasady. Ponadto sugeruje się prawdopodobną rolę w wiązaniu polimerów dla pozostałości SSE9. Weigel (2015) zaproponował osiem tri-peptydów zawierających Asp/Glu jako potencjalne regiony zaangażowane w Wiązanie cukru UDP12. Aby wyjaśnić rolę SSE i zidentyfikować regiony wiążące się z UDP-sugars, przeprowadziliśmy symulacje dokowania.
oczekuje się, że enzym ma co najmniej dwa miejsca wiązania, jedno dla substratów cukru UDP, a drugie dla cukru polimerowego do katalizowania tworzenia wiązania glikozydowego12. Aby zidentyfikować miejsca wiązania w strukturze enzymu, przeprowadziliśmy badania dokujące substratów UDP-cukrowych: UDP-N-acetyloglukozaminy i kwasu UDP-glukuronowego. Region wiązania dla substratów UDP ocenia się za pomocą siatki z jego centrum w domenie glikozylotransferazy, jak określono w metodach.
miejsca wiązania substratów UDP pokrywają się
symulacje dokowania są prowadzone oddzielnie dla UDP-N-acetyloglukozaminy i kwasu UDP-glukuronowego. Dobierane są niskoenergetyczne konformatory (lepsze niż 5 kcal / mol). Rysunek 3A pokazuje częstotliwość kontaktów różnych miejsc z korzystnymi energetycznie konformerami w różnych przebiegach symulacji. Pokazano pozostałości polarne o częstotliwości co najmniej 10% w stosunku do dowolnego z dwóch substratów. Zauważalna obserwacja z rysunku polega na tym, że miejsca wiązania dwóch substratów cukru nakładają się na siebie.

(A) Częstotliwość styku ligandów dla energicznie korzystnych konformerów acetyloglukozaminy UDP – N (UDP-GlcNAc) i kwasu glukuronowego UDP – D (UDP-GlcA). Częstotliwość jest wykreślona na osi X, A miejsca na osi Y. B) rola SSE1-4, SSE8 i SSE9 w wiązaniu substratów UDP z cukrem. C) rola SSE6 w wiązaniu ligandów. D) rola SSE w wiązaniu polimerów. E) rola SSE7. (i) pętla SSE7 w syntazie hialuronowej, (ii) równoważna pętla w syntazie celulozy, (iii) równoważna pętla w nieprocesywnej glikozylotransferazie. (F) energia zminimalizowana ma strukturę wykazującą UDP-N-Acetyloglukozaminę i disacharyd kwasu glukuronowego i moeities N-Acetyloglukozaminę.
rolę kontaktujących się pozostałości oceniono poprzez zbadanie wiązania z najkorzystniejszym energetycznie biologicznie odpowiednim konformatorem. Wybór konformatora jest kierowany przez bliskość pierścienia nukleotydowego UDP do ewolucyjnie zachowywanego SSE1, o którym wiadomo, że bierze udział w wiązaniu nukleotydowym. Wybrane konformery w kieszeni wiązania pokazano na Fig. 3b.SSE1-SSE4, Sse6, SSE8 i Sse9 są zaangażowane w Wiązanie podłoża (rys. 3b). SSE1, SSE2 i SSE4 w dużej mierze stabilizują urydynową część substratów, podczas gdy SSE3, SSE8 i sse9 oddziałują z pierścieniem cukru. Początkowe Wiązanie pierścienia UDP substratu z enzymem może być ułatwione przez (i) łańcuch boczny konserwowanego Asp-103 SSE2 (niebieski, Fig. 3B) przez wiązania wodorowe z polarnymi grupami nukleotydów i (ii) przez aromatyczny pierścień Tyr-74 (zielony, Fig. 3B) od SSE1 poprzez interakcje π-π z pierścieniem urydynowym UDP. Łańcuch boczny Glu-76 (zielony, rys. 3B) z SSE1 tworzy wiązania wodorowe z polarnymi grupami cukru rybozowego UDP. Pozostałość Asp-161 z SSE4 stabilizuje grupę Oh pierścienia rybozowego, podczas gdy Asp-159 stabilizuje jon metalu. Gln – 295 I Arg-298 (niebieski) z SSE9 mogą oddziaływać i stabilizować grupę pirofosforanową nukleotydu UDP. ATOM NE TRP-299 znajduje się w odległości wiązania H z substratem cukru i prawdopodobnie pomaga w orientacji substratu. Asp-260 jest topologicznie równoważny zasadzie katalitycznej w syntezie celulozowej25. SSE8 posiada Asp-260. Kolejno bliższe tej pozostałości są Asp – 259 i Arg-261, z których oba oddziałują z polarnymi grupami pierścienia cukrowego (zielony). Pozostałość Arg-140, obok Lys-139, jest częściowo konserwowana i zastąpiona tylko Lys w homologach SeHAS. Pozostałość ta znajduje się w pobliżu n-końcowego końca helisy trzymającej SSE8 (zielony). Ten koniec zawiera ujemnie naładowane pozostałości Asp, które można zneutralizować za pomocą Arg-140.
pozostałości z SSE6 (rys. 3C) Utwórz rusztowanie do podtrzymywania ligandów w miejscu wiązania. Pętla jest strategicznie umieszczona i stanowi podstawę kieszeni wiązania. Pętla znajduje się również w pobliżu Zasady katalitycznej (SSE8) i związanego cukru polimerowego (omówione później). Jak omówiono powyżej, eksperymenty z użyciem N-etlymaleimidu umieszczają zachowany Cys-226 tego pierwiastka w pobliżu miejsca wiązania UDP-cukier19. Jest to prawdopodobnie związane z utrzymaniem pKa mikrośrodowiska w miejscu aktywnym. Chociaż nie jest to istotne dla aktywności, wykazano,że mutacja tej reszty do Ala wpływa na aktywność w SeHAS19, 28. Łańcuch boczny Ser-227 jest prawdopodobnie zaangażowany w stabilizację konformacji pętli poprzez interakcje z łańcuchem głównym. Gly – 228 i Pro-229 zapewniają niezbędną elastyczność i sztywność konformacji łańcucha głównego (rys. 3C).
Lys-139 jest zbędny w SeHAS i odgrywa rolę w wiązaniu substratów
oceny dokowania sugerują rolę Lys-139 w wiązaniu ligandów. Wcześniejsze badania donoszą o regulacyjnej roli tej pozostałości w ssaczych formach HAS. U myszy mutacja w Arg powoduje całkowitą utratę aktywności24. Wobec braku jakichkolwiek badań mutacyjnych w SeHAS, w celu dalszego wyjaśnienia jego roli, przeprowadziliśmy badania mutacji Lys-139. Szczegóły dotyczące konfiguracji eksperymentalnej i testu opisano w metodach. Wyniki eksperymentalne i mapa wektorowa pmbad użyta do badania przedstawiono na Fig. 4A, B, odpowiednio. Zmutowaliśmy Lys – 139 do Arg (K139R) w celu zachowania ładunku w tej pozycji. Mutacja nie doprowadziła do całkowitej utraty aktywności, ale miała wpływ. Tylko 34% aktywności (produkcja HA)zostało zatrzymane w porównaniu z kontrolą, która potwierdza istotną rolę funkcjonalną tej pozostałości (rys. 4a). Aby dalej badać oddziaływanie oparte na ładunku między tą osadą a substratem, zmutowaliśmy dodatnio naładowany Lys-139 do ujemnie naładowanego Asp (K139D). Ujemny ładunek na terenie prowadzi do zachowania 82% aktywności (produkcja HA) w porównaniu z kontrolą. Analiza ta sugeruje rolę tej pozostałości w stabilizowaniu grup polarnych substratu. Wybór podstawień dodatkowo ilustruje, że zarówno dodatnie, jak i ujemnie naładowane grupy są zakwaterowane w miejscu. Nasze badania pokazują, że ta pozostałość bezpośrednio wpływa na aktywność syntazy w SeHAS. Mutacje w tym miejscu upośledzają funkcję syntazy do znacznego poziomu.

badania mutacji na SeHAS. A) względna aktywność mutantów SeHAS przeprowadzona w tym badaniu. Eksperymenty prowadzono w trójplikatach, a błąd standardowy dla miana HA wynosił od ±0,01 do ±0,05. B) konstrukcja wektorowa pMBAD. geny hasA i hasB z Streptococcus equi subsp. zooepidemicus były kolejno klonowane. W badaniach mutacyjnych Hasa wildtype zastąpiono odpowiadającymi mu mutantami.
sse5 wiąże się z polimerem i wpływa na produkcję HA
wgłębienie powyżej obszaru wiązania UDP-substrat utworzonego przez helisy amfipatyczne jest oceniane pod kątem wiązania jednostki polimeru. Badanie wiązania polimerów ogranicza się do końcowego dwucukru biorącego udział w tworzeniu wiązania glikozydowego. Badania dokowania przeprowadzono z jednostką dwucukrową HA zawierającą N-acetyloglukozaminę połączoną β 1-4 i kwas D-glukuronowy w domenie glikozylotransferazy. Wybrano korzystnych energetycznie konformatorów. Rysunek 3D przedstawia jednostkę disacharydu HA zadokowaną w pobliżu kieszeni wiązania. Sse5, Sse8 i sse9 są zaangażowane w Wiązanie (rys. 3D). Pozostałość Asp – 260 z SSE8 znajduje się w odległości wiązania H z końcową grupą OH polimeru i jest oznaczona linią przerywaną na Fig. 3D. Arg-261 z SSE8 leży blisko polimeru i może wchodzić w interakcje z polarnymi grupami OH cukru. Pozostałość Trp-299 z SSE9 tworzy interakcje CH-π z końcowym cukrem.
zgodnie z naszą najlepszą wiedzą jest to pierwszy raport zakładający funkcjonalne zaangażowanie pozostałości z SSE5. Kluczowe pozostałości w SSE5 zaangażowane w wiązanie z polimerem to Arg-205, Tyr-206, Phe-210 I Arg-214. Arg-205 znajduje się w pobliżu zadokowanego disacharydu i bierze udział w interakcjach z ujemnie naładowanymi polarnymi grupami ugrupowania cukrowego. Tyr-206 lub fenyloalanina w homologach SeHAS jest postrzegana jako stabilizująca pozostałość Arg-205 poprzez interakcje kation-π. Arg-214 lub Lys w sekwencjach homologicznych znajduje się w pobliżu polimeru i blisko częściowo zachowanego Phe-210, z którym tworzy interakcje kation-π. Konsekwencja mutacji pozostałości z SSE5 nie jest znana. Tutaj badamy konsekwencje mutacji Tyr – 206 i Arg-214 na działanie poprzez mutagenezę ukierunkowaną na miejsce. Nasze wyniki doświadczalne pokazują, że zakłócenie oddziaływań kation-π poprzez mutację aromatycznej tyrozyny do alaniny (Y206A) powoduje 99% utratę aktywności HAS (produkcja HA) (Fig. 4a). Utrata tej interakcji mogła pośrednio wpływać na Wiązanie polimeru przez przyległy Arg-205. Podobnie mutacja zasadowej reszty argininy w 214 do alaniny (R214a) prowadzi do całkowitej utraty funkcji (Fig. 4a). Co ciekawe, wprowadzenie ładunku ujemnego (R214E) prowadzi do 93% utraty funkcji (rys. 4a). Wyniki te powtarzają potrzebę dodatniego ładunku netto w tym miejscu w celu ułatwienia wiązania polimeru i translokacji. Mutacje te wskazują na współzależność wiązania/translokacji polimerów i aktywności glikozylotransferazy.
co więcej, enzym skompleksowany z dwoma ligandami (UDP-cukrem i disacharydem) został zminimalizowany energetycznie za pomocą bursztynowych pól siłowych. 3F przedstawia enzym związany z UDP-N-acetyloglukozaminą i disacharydem utworzonym przez połączony kwas glukuronowy I N-acetyloglukozaminę z kwasem glukuronowym na końcu polimerowym. Szczegóły dotyczące protokołu minimalizacji są opisane w Methods.
Gln-248 (SSE7) jest krytyczny z prawdopodobną rolą w przejściu konformacji
Gln-248 jest zachowaną pozostałością w SSE7, długą pętlą z dala od miejsca wiązania. Równoważna pętla zarówno w homologach procesywnych, jak i nieprocesywnych jest sekwencyjnie różna i wykazuje wyraźne konformacje w postaciach enzymów związanych z substratem i niezwiązanych (Fig. 3E (ii)) 29,30,31 i Fig. 3E (III) β 1-4 galaktozylotransferazy, kod PDB: 2FYD i 2FY7) 32. Pętla w SeHAS prawdopodobnie ułatwi pozycjonowanie SSE8 do katalizy. Pozostałość Gln-248 leży z dala od kieszeni wiążącej; dokładnej roli tej pozostałości nie można przewidzieć na podstawie tych badań in-silico. Wewnętrzne badania mutacji wykazują, że ta pozostałość jest ważna. Zastąpienie pozostałości Ala skutkuje niemal całkowitą utratą produkcji HA (rys. 4a).Rola tej pozostałości jest dalej sondowane przez gruboziarnistych badań dynamicznych i jest omówione w dalszej części.
SSEs wykazują ruch skoordynowany
obecny paradygmat to struktura-koduje-dynamika-koduje-funkcję33,34,35. Coraz częściej uznaje się, że przypadkowe fluktuacje atomów w ich rodzimym stanie ukrywają skoordynowany ruch, który predysponuje białko do istotnych funkcjonalnie zmian w strukturze. Ruchy te mogą być przechwytywane przez tryby niskiej częstotliwości w elastycznym modelowaniu sieci. Wiadomo, że tryby te są niewrażliwe na szczegóły strukturalne i energetyczne. Dlatego zastosowaliśmy anizotropowe Modelowanie sieci (ANM), podejście oparte na ENM do przechwytywania globalnego obrazu dynamiki zakodowanej przez trójwymiarową strukturę SeHAS. Użyliśmy ProDy36 do obliczeń ANM. Dalsze szczegóły znajdują się w dziale metody. Ruch koordynowany jest reprezentowany jako wartości współczynników korelacji między węzłami sieci ANM. Średnie wartości współczynnika korelacji obliczono na podstawie pierwszych 50 trybów. Rysunek 5A przedstawia mapę korelacji dla SeHAS. Dodatnie wartości współczynnika korelacji wskazują, że atomy poruszają się w tym samym kierunku. Skupisko przestrzennie proksymalnych reszt o wysokim współczynniku korelacji uważa się za ważne pod względem strukturalnym i funkcjonalnym. Pary pozostałości o dużych wartościach dodatnich odpowiadają elementom substrukturalnym. Ponadto korelacja między parami pozostałości rozciąga się na regiony w różnych SSE. SSE1-4 tworzą ściśle oddziałującą subdomenę (czarny prostokąt). Podobnie SSE5-9 tworzy skoordynowaną interakcję z subdomeną (szary prostokąt). Obie subdomeny są oddzielone słabo skorelowanym regionem. Wewnętrzne ruchy globalne ilustrują koordynację funkcjonalną wymaganą w odniesieniu do wiązania substratu na jednym końcu, przez sse1-4 i Wiązanie polimerowe na drugim końcu (SSE5-9).

ocena dynamiki globalnej w SeHAS. A) średnie wartości współczynnika korelacji dla Seh w parach pozostałości. Średnie wartości współczynnika korelacji dla Gln-248 (B) i Thr-283 (C) z innymi pozostałościami SeHAS.
dalej badaliśmy dynamikę SeHAS w odniesieniu do pozostałości Gln-248. Fig. 5B pokazuje rozkład wartości współczynnika korelacji w odniesieniu do innych pozostałości w SeHAS. GLN-248 wykazuje duże wartości dodatnie z SSE8, 9 i SSE3, które zawierają pozostałości katalityczne i wiążące substrat. Skoordynowany ruch z tymi SSE oceniany za pomocą ANM dodatkowo ilustruje jego rolę w funkcjonalnie istotnej dynamice konformacji.
badanie ANM jest rozszerzone o ocenę wpływu mutacji na wartości współczynnika korelacji. Dla każdego z mutantów uzyskuje się model strukturalny za pomocą RaptorX26. Mutanty wykazują wysokie nakładanie się struktury ze średnią RMSD wynoszącą około 1 Å we wszystkich atomach w odniesieniu do struktury białka WT. Dla każdej struktury zmutowanej wartości współczynnika korelacji w odniesieniu do pozostałości zmutowanych są obliczane i porównywane z WT. Działki są pokazane na Rys. S2. Mutacje w ośrodkach 214, 248 i 283 wykazują znaczne różnice w wartościach w regionach SSE.
zmniejszenie wydłużenia końcowego polimeru w SeHAS, prawdopodobny trójstopniowy mechanizm
w prototypowych członach rodziny GLIKOZYLOTRANSFERAZY GT – 2, takich jak syntaza celulozowa,biosynteza polimeru następuje z nieodwracalnego końca rosnącego polimeru 25, 31. W takich systemach substraty UDP działają jako dawca przenoszący cukier do cukru polimerowego, który działa jako akceptor24. Wiązanie β między cukrami powstaje z prekursorów α związanych z cukrem i UDP w wyniku bezpośredniej reakcji substytucji SN2. W tej reakcji etap deprotonacji przez katalityczną zasadę funkcjalizuje akceptor24. Atak nukleofilowy tej grupy cukru akceptującego na dawcę poprzez pojedynczy jonowy stan przejściowy oksokarbenu powoduje reakcję przeniesienia glikozylu z uwalnianiem UDP z cukru dawcy i inwersję netto stereochemii przy węglu anomerycznym. Mechanizm ten zilustrowano na Fig. 6a. SeHAS różni się od tego prototypu. Wiadomo, że HA wydłuża się od końca redukcji12. Oznacza to, że (i) UDP jest uwalniany z końca polimeru, a nie z substratów UDP podczas katalizy oraz (ii) odwrócenie dawcy i akceptorów z HA-UDP działającym jako dawca, a UDP-substrat cukrowy jako akceptor. Opierając się na krajobrazie wiązania ligandów i uzyskanej wiedzy o architekturze miejsca aktywnego, omawiamy udział ligandów jako dawcy i akceptora i proponujemy mechanizm katalityczny transferu glikozylu w SeHAS(patrz Rys. 6b).
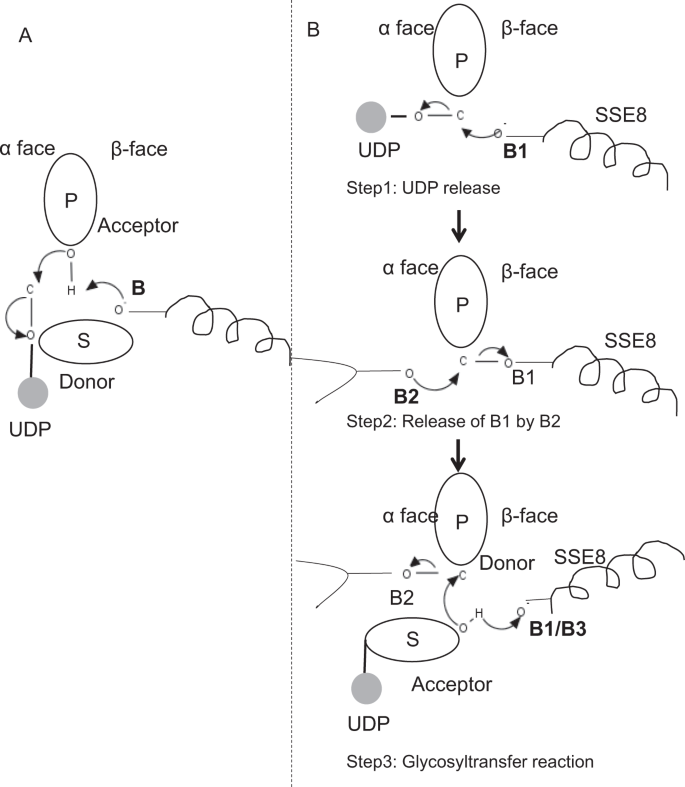
proponowany mechanizm molekularny w SeHAS. A) mechanizm w prototypowej glikozylotransferazie z chemią inwersji. B) proponowany mechanizm w klasie I ma. P: cukier polimerowy, s: cukier Substratowy.UDP jest oznaczony jako okrąg. B1, B2 i B3 są zasadami katalitycznymi uczestniczącymi w mechanizmie reakcji.
reakcja Glikozylotransferazy zachodzi prawdopodobnie w wielu etapach
w pierwszym etapie zbadaliśmy możliwość pojedynczej reakcji glikozylotransferazy w sposób podobny do syntazy celulozy. Jeśli reakcja glikozylotransferazy zachodzi w jednym etapie, enzym w danym czasie musiałby posiadać dwie grupy UDP, jedną przyłączoną do polimeru, a drugą przyłączoną do przychodzącego substratu. W alternatywnym wieloetapowym scenariuszu UDP z polimeru jest uwalniany przed zajściem reakcji katalitycznej. W tym przypadku, aby wytworzyć inwersję stereochemiczną, reakcja zachodzi w szeregu nieparzystej liczby kroków z mechanizmem SN2. Aby ocenić, który scenariusz jest bardziej prawdopodobny, przeprowadziliśmy badania wiązania UDP poprzez dokowanie cząsteczek UDP w domenie glikozylotransferazy. Ocena wskazuje na znaczne nakładanie się miejsc wiązania UDP i UDP-substrat.Wynik przedstawiono w sekcji uzupełniającej. Przykładowa korzystna energetycznie konformacja UDP wraz z regionami wiążącymi podłoże i polimer przedstawiono na fig. S3. Chociaż ocena opiera się na modelu statycznym, umieszczenie dwóch dużych cząsteczek o podobnym charakterze chemicznym w bliskim sąsiedztwie z wymaganiami podobnych środowisk fizykochemicznych jest mało prawdopodobne dla tego enzymu. Spekulujemy, że przejście wyłożone dodatnio naładowanymi resztkami z SSE9 i jonami metalu może ułatwić uwalnianie UDP z końca polimeru. Dobrze udokumentowano również udział jonów metali w glikozylotransferazie w uwalnianiu UDP24. Ponieważ obie strony UDP nie wykluczają się wzajemnie, drugi scenariusz reakcji wieloetapowej wydaje się bardziej prawdopodobny.
po uwolnieniu UDP z polimeru, nukleofilowy atak z grupy OH substrat-UDP (akceptor) utworzyłby połączenie glikozydowe. Aby wytworzyć inwersję, uwalnianie UDP i późniejszy atak nukleofilowy musi nastąpić z dwóch przeciwległych stron cukru polimerowego. Proponujemy rolę trzech katalizatorów zasadowych w ogólnym schemacie reakcji, które leżą na powierzchniach α i β cukru dawcy na końcu polimeru. Kroki te zilustrowano na Fig. 6B i opisane poniżej.
proponowana trzyetapowa reakcja glikozylotransferazy
Krok 1: uwalnianie UDP: Asp-260 z SSE8 może działać jako zasada (B1) i inicjować uwalnianie cząsteczki UDP z polimeru (dawcy) z powierzchni α. Ten krok stworzyłby kowalencyjnie związany pośredni enzym glikozylowy ekranowany na powierzchni β z zasadą B1. Aby wytworzyć inwersję, ta powierzchnia cukru musi być wolna od nukleofilowego ataku grupy cukrowej o-H. W związku z tym etap pośredni, z atakiem nukleofilowym z powierzchni α uwolniłby powierzchnię β gotową do ataku nukleofilowego przez cukier akceptujący.
Krok 2: uwolnienie B1 przez B2; zbadanie roli Thr – 283: baza B2 na powierzchni α cukru dawcy przeprowadzi atak nukleofilowy na węgiel anomeryczny w centrum reakcji i uwolni B1. Nasze badania strukturalne pokazują zachowane Gln – 295 i Thr-283 na tej powierzchni. Uwalnianie UDP może spowodować zmiany konformacyjne i doprowadzić jedną z tych pozostałości w pobliżu cukru dawcy do katalizy. Mutacja Gln-295 powoduje do 90% utratę aktywności, ale rola jako bazy nie jest znana20. Oceniliśmy możliwość zachowania thr – 283 znajdującego się w pętli, aby działał jako druga baza. Zmutowaliśmy Thr do Ser zawierającego podobną funkcjonalną grupę OH I do Ala z małym alifatycznym łańcuchem bocznym. Zarówno mutanty t283a, jak i t283s wykazują ~95% utratę produkcji HA (rys. 4a). Pozostałość ta wykazuje dodatnią korelację z regionami SSE4 i sse6 oraz przestrzennie bliższym regionem pomiędzy pozostałością 186 a pozostałością 190 (Fig. 5C). Pozostałość 188, choć nie zachowana, znajduje się w pobliżu zadokowanego podłoża (rys. 3). Thr-283 nie wykazuje wysokiej dodatniej korelacji z sse8 posiadającym zasadę katalityczną. Możliwe jest, że pozostałość działa jako podporowa zasadowa pozostałość podczas reakcji katalitycznej z jej ruchem skoordynowanym z przestrzennie bliższym obszarem wiązania substratu niezależnym od Zasady Asp-260 w SSE8. Dalsze eksperymenty byłyby wymagane, aby uzasadnić jego rolę jako podstawy. Ogólnie rzecz biorąc, w badaniu podkreślono jeszcze inną funkcjonalnie krytyczną pozostałość, nieznaną wcześniej.
Krok 3: reakcja transferu Glikozylu: po uwolnieniu B1, twarz β anomerycznego węgla cukru polimerowego jest odblokowywana w reakcji. Deprotonacja substratu-UDP na tej samej powierzchni przez trzecią zasadę utworzyłaby grupę nukleofilową. Ten krok może być zainicjowany przez B1 lub inną bazę B3. Asp-259, obok B1, jest wysoce zachowywaną pozostałością w pobliżu substratu-UDP i może działać jako B3. Jednak B1 / B3 jest bliżej cukru polimerowego (dawcy), jak omówiono w Kroku 1. Aby rozpocząć deprotonację, B1 musi znajdować się w pobliżu cukru akceptora. Można to osiągnąć poprzez zmiany konformacji na SSE8 wspomagane przez SSE7. Równoważna helisa w syntazie celulozy posiada katalityczną zasadę i podlega skoordynowanym przemianom konformacyjnym dla reakcji glikozylotransferazy i translokacji. Nukleofilowy atak cukru akceptującego na anomeryczny węgiel cukru dawcy stworzyłby połączenie glikozydowe i uwolnienie Zasady B2.