- 3-D de las características Estructurales de SeHAS
- Elementos subestructurales (ESS) en la Clase I TIENE
- Los sitios de unión de sustratos UDP se superponen
- Lys-139 es prescindible en SeHAS y tiene un papel en la unión del sustrato
- SSE5 se une al polímero e influye en la producción de HA
- Gln-248 (SSE7) es crítico con un papel plausible en la transición de conformación
- Las pequeñas empresas exhiben movimiento coordinado
- Alargamiento del polímero de extremo reductor en SeHAS, un mecanismo plausible de tres pasos
- La reacción de glicosiltransferasa probablemente ocurre en múltiples pasos
- Reacción de glicosiltransferasa de tres pasos propuesta
3-D de las características Estructurales de SeHAS
Un modelo estructural de SeHAS secuencia fue generada usando raptor x webserver26. El modelo se obtuvo con plantilla de celulosa sintasa( PDB: 4P00).La enzima plantilla comparte una alta similitud funcional y una baja similitud de secuencia (~15%) con SeHAS25. A pesar de la escasa similitud de secuencias con la plantilla, el modelo obtenido es de alta calidad, como indican las mediciones de calidad global (valor de P: 10-8) y absoluta (puntuación GDT: 52) 26. La evaluación de la calidad estereoquímica del modelo estructural indica que el 98,5% de los residuos residen en la región permitida/parcialmente permitida de la parcela de Ramachandran.
La Figura 1 muestra el modelo estructural de SeHAS. El modelo estructural HAS muestra que la cadena única se pliega en tres componentes: (i) un dominio de glicosiltransferasa funcional, (ii) cuatro hélices transmembranas (TM1-TM4) y (iii) tres hélices anfipáticas (AP1-AP3). El dominio glicosiltransferasa adopta un pliegue GT-A formado por una lámina β mixta de 7 hilos rodeada de hélices α en arquitectura β / α. Las hélices transmembranas (TM1-TM4) forman un haz de cuatro hélices y crean un poro para la translocación de polímeros. 11 Se predice que los residuos C-terminales de SeHAS están desordenados y no se muestran en la Fig. 1. La naturaleza oligomérica de los SeHAS todavía está siendo investigada. Hasta 2018, SeHAS se caracterizaba por funcionar en su forma monomérica9. Informes recientes indican que la enzima SeHAS funciona como homodímero27. El alcance del presente trabajo se limita a la evaluación de las características del protómero.

Modelo estructural y características de SeHAS. SSE: Elemento subestructural, AP: Hélice anfipática, TM: Hélice trans-membrana.
El modelo estructural en 3D de SeHAS es consistente con la topología de HAS previamente determinada en Streptococcus pyogenes derivada mediante experimentos de fusión, etiquetado y accesibilidad a proteasa 12,16,19 con una ligera diferencia en el número de hélices anfipáticas. Proponemos la presencia de tres hélices anfipáticas en lugar de dos hélices anfipáticas reportadas previamente, en base a una evaluación comparativa con la estructura de la celulosa sintasa. Los residuos de SeHAS correspondientes a la hélice anfipática AP2 no se han investigado específicamente para determinar su ubicación celular16. Como se discutió más adelante en este manuscrito, esta hélice contiene residuos de importancia funcional.
El modelo estructural explica los resultados de la inhibición de N-etilmaleimida (NEM) en SeHAS19. El NEM reacciona con los grupos tiol y, por lo tanto, se utiliza para investigar el papel de los residuos de cisteína en las proteínas. SeHAS tiene cuatro residuos de Cys: Cys-226, Cys-262 y Cys-281 y Cys-367. Los tres primeros residuos de cisteína se encuentran en el citosol y, por lo tanto, son accesibles para la NEM, lo que conduce a la inhibición. Cys-367, sin embargo, se encuentra en la hélice transmembrana y es inaccesible para NEM. Por lo tanto, no se ha notificado inhibición para este residuo. En presencia de sustrato, se muestra que la NEM se une solo al Cys-281. Nuestros estudios estructurales (descritos más adelante) indican que Cys-226 y Cys-262 se encuentran muy cerca del sitio de unión del sustrato UDP y la presencia de sustrato bloquearía el acceso de NEM a estos residuos. Cys-281 se encuentra lejos del sitio de unión a UDP y la presencia de sustrato no bloquea este sitio de inhibición de NEM.
Elementos subestructurales (ESS) en la Clase I TIENE
Hay poca información sobre la maquinaria funcional específica de la Clase I TIENE. En ausencia de estructura 3D, no se conoce un papel funcional de los sitios estudiados experimentalmente. Por lo tanto, para obtener una comprensión de los componentes funcionales en SeHAS y su disposición relativa en 3-D, identificamos regiones contiguas cortas con características de secuencia conservadas evolutivamente llamadas elementos subestructurales (ESS). Comparamos 81 secuencias de Clase I obtenidas a través de estrictos criterios de selección elaborados en la sección Métodos. Las enzimas de clase I difieren en el número de hélices transmembranas. En ausencia de información estructural, la alineación en esta región es de mala calidad. Por lo tanto, la comparación de secuencias se limita a la región citosólica para evitar sitios con correspondencia ambigua residuo-residuo. La alineación de las secuencias de Clase I de HAS se proporciona como complemento Fig. S1, creado con Jalview. Se calcula una puntuación de conservación para cada correspondencia residuo-residuo con respecto a la secuencia SeHAS. Un tramo contiguo con puntaje promedio > =70 y al menos 2 sitios con puntaje > = 80 se define como elemento subestructural (ESS). Utilizando este criterio, identificamos 9 elementos subestructurales, etiquetados como SSE1-SSE9, de importancia estructural/funcional potencial en HAS (Fig. 2). La estructura secundaria para la mayoría de las SSE se asigna a bucles, excepto SSE5, SSE8 y SSE9, que se encuentran en hélices. Estos elementos también están marcados en la Fig. 1. La Tabla 1 resume los detalles de la secuencia, así como el papel estructural y funcional de la ESS.

Una gráfica de puntuación de conservación con respecto al número de secuencia de SeHAS. SSE indicado en la parte superior. La proyección de la estructura secundaria de la secuencia se indica en la parte inferior. Las hebras están marcadas como flechas y hélices representadas como rectángulos. Los rectángulos rellenos corresponden a hélices anfipáticas. Consulte el texto para obtener más detalles.
Nuestro estudio reporta ESS conservadas: ESS5 y ESS7 específicas de la HAS. Mutaciones estudiadas hasta ahora, correspondientes a residuos Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, han demostrado influir en la actividad. Mutaciones correspondientes a residuos Lys-48, Glu-327, Lys-414, Lys-415 influyen en la velocidad de reacción y/o peso molecular del polimero18,19,20,21,23. La mayoría de estos sitios de mutación corresponden a SSE1-4, 6, 8 y 9 (Tabla 1).Otros sitios no son una característica conservada de Class I HAS family. Bi et al. (2015) analizaron diversas glicosiltransferasas procesivas y discutieron la presencia de tres residuos de Asp espaciados de forma variable en el dominio de las glicosiltransferasas, que son cruciales para la actividad25. Estos incluyen, Asp de SSE1 en la unión de nucleótidos, Asp de SSE2 en la unión al metal, Asp en SSE8 con un papel probable como base. Además, se sugiere un papel probable en la unión de polímeros para residuos de SSE9. Weigel (2015) propuso ocho tripéptidos que contienen Asp/Glu como regiones potenciales involucradas en la unión UDP-azúcar 12. Con el fin de dilucidar el papel de la ESS e identificar regiones que se unen a UDP-azúcares, realizamos simulaciones de acoplamiento.
Se espera que la enzima tenga al menos dos sitios de unión, uno para sustratos de azúcar UDP y otro para azúcar polimérico para catalizar una formación de enlace glucosídico12. Para identificar los sitios de unión en la estructura enzimática, realizamos estudios de acoplamiento de sustratos UDP-azúcar: UDP-N-acetilglucosamina y UDP-ácido glucurónico. La región de unión para sustratos UDP se evalúa a través de una cuadrícula con su centro en el dominio glicosiltransferasa, tal como se define en los Métodos.
Los sitios de unión de sustratos UDP se superponen
Las simulaciones de acoplamiento se realizan por separado para UDP-N-acetilglucosamina y ácido UDP-glucurónico. Se seleccionan conformadores de baja energía (mejores que 5 kcal/mol). La Figura 3A muestra la frecuencia de contactos de varios sitios con conformadores energéticamente favorables en diferentes corridas de simulación. Se muestran residuos polares con al menos un 10% de frecuencia en cualquiera de los dos sustratos. La observación notable de la figura es que los sitios de unión de los dos sustratos de azúcar se superponen.

(A) Frecuencia de residuos de contacto con ligandos para conformadores energéticamente favorables de UDP-N Acetilglucosamina (UDP-GlcNAc) y ácido glucurónico UDP – D (UDP-GlcA). La frecuencia se representa en el eje X y los sitios en el eje Y. B) Papel de SSE1-4, SSE8 y SSE9 en la unión del sustrato UDP-azúcar. (C) Papel de SSE6 en la unión de ligandos. D) Papel de las pequeñas empresas en la unión de polímeros. E) Función de la SSE7. (i) Bucle SSE7 en hialuronan sintasa, (ii) Bucle equivalente en celulosa sintasa, (iii) Bucle equivalente en glicosiltransferasa no procesiva. F) La energía minimizada tiene una estructura que muestra la UDP-N-acetilglucosamina y el disacárido del ácido glucurónico y los moeities de la N-acetilglucosamina.
El papel de los residuos de contacto se evaluó mediante la investigación de la unión con el conformador biológicamente relevante energéticamente más favorable. La selección del conformador está guiada por la proximidad del anillo de nucleótidos de UDP al SSE1 conservado evolutivamente que se sabe que está involucrado en la unión de nucleótidos. Las conformadoras seleccionadas en el bolsillo de encuadernación se muestran en la Fig. 3B. SSE1-SSE4, SSE6, SSE8 y SSE9 están involucrados en la unión del sustrato (Fig. 3B). SSE1, SSE2 y SSE4 estabilizan en gran medida la parte de uridina de los sustratos, mientras que SSE3, SSE8 y SSE9 interactúan con el anillo de azúcar. La unión inicial del anillo UDP del sustrato con la enzima podría ser facilitada por (i) la cadena lateral de Asp-103 conservado de SSE2 (azul, Fig. 3B) a través de enlaces de hidrógeno con grupos polares de nucleótidos y (ii) por anillo aromático de Tyr-74 (verde, Fig. 3B) de SSE1 a través de interacciones π-π con el anillo de uridina de UDP. Cadena lateral de Glu-76 (verde, Fig. 3B) a partir de SSE1 se forman enlaces de hidrógeno con grupos polares de azúcar ribosa de UDP. El residuo Asp-161 de SSE4 estabiliza el grupo OH del anillo de ribosa, mientras que el Asp-159 estabiliza el ion metálico. Gln-295 y Arg-298 (azul) de SSE9 podrían interactuar y estabilizar el grupo pirofosfato del nucleótido UDP. El átomo NE de Trp-299 se encuentra a una distancia de unión en H al sustrato de azúcar y probablemente ayuda a orientar el sustrato. Asp-260 es topológicamente equivalente a la base catalítica en la síntesis de celulosa 25. SSE8 sostiene Asp-260. Secuencialmente proximales a este residuo están Asp – 259 y Arg-261 que interactúan con los grupos polares del anillo de azúcar (verde). El residuo Arg-140, junto al Lys-139, se conserva parcialmente y se reemplaza solo con Lys en homólogos de SeHAS. Este residuo está muy cerca del extremo N-terminal de la hélice que sostiene SSE8 (verde). Este extremo contiene residuos de Asp cargados negativamente que podrían ser neutralizados por Arg-140.
Residuos de SSE6 (Fig. 3C) cree un andamio para soportar los ligandos en el sitio de unión. El lazo se coloca estratégicamente y forma la base del bolsillo de encuadernación. El bucle también se encuentra cerca de la base catalítica (SSE8) y del azúcar polimérico unido (discutido más adelante). Como se discutió anteriormente, los experimentos con N-etlimaleimida colocan el Cys-226 conservado de este elemento cerca del sitio de unión al azúcar UDP19. Esto probablemente está involucrado en el mantenimiento del pKa del microambiente en el sitio activo. Aunque no es esencial para la actividad, se ha demostrado que la mutación de este residuo en Ala influye en la actividad de las SeHAS19, 28. La cadena lateral del Ser-227 probablemente participa en la estabilización de la conformación del bucle a través de interacciones con la cadena principal. Gly-228 y Pro-229 proporcionan la flexibilidad y rigidez necesarias a la conformación de la cadena principal, respectivamente (Fig. 3C).
Lys-139 es prescindible en SeHAS y tiene un papel en la unión del sustrato
Las evaluaciones de acoplamiento sugieren un papel de Lys-139 en la unión del ligando. Estudios previos han reportado un papel regulador de este residuo en formas de HAS de mamíferos. En ratones, una mutación a Arg da lugar a una pérdida de actividad completa24. En ausencia de estudios mutacionales en SeHAS, para dilucidar aún más su papel, realizamos estudios de mutación de Lys-139. Los detalles sobre la configuración experimental y el ensayo se describen en Métodos. Los resultados experimentales y el mapa vectorial de pMBAD utilizado para el estudio se muestran en la Fig. 4A, B, respectivamente. Mutamos Lys-139 a Arg (K139R) con el objetivo de conservar la carga en esa posición. La mutación no condujo a una pérdida completa de actividad, pero sí tuvo un impacto. Solo se retuvo un 34% de actividad (producción de HA) en comparación con el control, lo que reitera un papel funcional significativo de este residuo (Fig. 4A). Para investigar aún más la interacción basada en la carga entre este residuo y el sustrato, mutamos Lys-139 cargado positivamente a Asp cargado negativamente (K139D). La carga negativa en el sitio conduce a la retención del 82% de actividad (producción de HA) en comparación con el control. Este análisis sugiere un papel para este residuo en la estabilización de grupos polares del sustrato. La selección de sustituciones ilustra aún más que en el lugar se alojan grupos con cargas positivas y negativas. Nuestros estudios muestran que este residuo influye directamente en la actividad de la sintasa en SeHAS. Las mutaciones en este sitio deterioran la función de la sintasa a niveles considerables.

Estudios de mutación en SeHAS. (A) Actividad relativa de mutantes SeHAS realizada en este estudio. Los experimentos se realizaron en triplicados y el error estándar para el título de HA estuvo en el rango de ±0,01 a ±0,05. B) Construcción vectorial de pMBAD. Genes hasA y hasB de Streptococcus equi subsp. zooepidemicus fueron clonados secuencialmente. Para los estudios mutacionales, se reemplazó un tipo salvaje de hasA por mutantes correspondientes.
SSE5 se une al polímero e influye en la producción de HA
La cavidad por encima de la región de unión del sustrato UDP formada por hélices anfipáticas se evalúa para la unión de la unidad de polímero. El estudio de unión a polímeros se limita al disacárido terminal involucrado en la formación de enlaces glucosídicos. Se realizaron estudios de acoplamiento con una unidad disacárida de HA compuesta por una N-acetilglucosamina unida a β 1-4 y ácido D-glucurónico en el dominio de la glicosiltransferasa. Se seleccionaron conformadores energéticamente favorables. La Figura 3D muestra una unidad de disacáridos de HA acoplada cerca de la bolsa de encuadernación. SSE5, SSE8 y SSE9 están involucrados en la unión (Fig. 3D). El residuo Asp-260 de SSE8 se encuentra en la distancia de unión en H al grupo terminal OH del polímero y se indica mediante una línea discontinua en la Fig. 3D. Arg-261 de SSE8 se encuentra cerca del polímero y podría interactuar con los grupos polares OH del azúcar. El residuo Trp-299 de SSE9 forma interacciones CH-π con el azúcar terminal.
A nuestro leal saber y entender, este es el primer informe que plantea la hipótesis de la implicación funcional de los residuos de la ESS5. Los residuos clave en SSE5 involucrados en la unión al polímero son Arg-205, Tyr-206, Phe-210 y Arg-214. El Arg-205 está muy cerca del disacárido acoplado y participa en interacciones con los grupos polares cargados negativamente de la fracción de azúcar. Se observa que el Tyr-206 o fenilalanina en homólogos de SeHAS estabiliza el residuo Arg-205 a través de interacciones catión-π. Arg-214 o Lys en secuencias homólogas está muy cerca del polímero y cerca de Phe-210 parcialmente conservado con el que forma interacciones catión-π. Se desconoce la consecuencia de la mutación de los residuos de la ESS5. Aquí, probamos la consecuencia de la mutación de Tyr-206 y Arg-214 en función a través de la mutagénesis dirigida al sitio. Nuestros resultados experimentales muestran que la interrupción de las interacciones catión-π al mutar la tirosina aromática a alanina (Y206A) produce una pérdida del 99% de la actividad HAS (producción de HA) (Fig. 4A). La pérdida de esta interacción podría haber influido indirectamente en la unión de polímeros a través de Arg-205 adyacente. De manera similar, la mutación del residuo básico de arginina en 214 a alanina (R214A) conduce a la pérdida completa de la función (Fig. 4A). Curiosamente, la introducción de carga negativa (R214E) conduce a una pérdida de función del 93% (Fig. 4A). Estos resultados reiteran la necesidad de una carga neta positiva en este sitio para facilitar la unión y translocación de polímeros. Estas mutaciones indican la interdependencia de la unión/translocación de polímeros y las actividades de la glicosiltransferasa.
Además, la enzima complejada con los dos ligandos (UDP-azúcar y disacárido) fue minimizada usando campos de fuerza ÁMBAR. La Figura 3F muestra la enzima unida a UDP-N-acetilglucosamina y disacárido formada por ácido glucurónico unido y N-acetilglucosamina con ácido glucurónico en el extremo polimérico. Los detalles del protocolo de minimización se describen en Métodos.
Gln-248 (SSE7) es crítico con un papel plausible en la transición de conformación
Gln-248 es un residuo conservado en SSE7, un bucle largo lejos del sitio de unión. El bucle equivalente en homólogos procesivos y no procesivos es secuencialmente diferente y muestra conformaciones distintas en formas enzimáticas unidas al sustrato y no unidas (Fig. 3E ii)) 29, 30, 31 y Fig. 3E (iii) β 1-4 galactosiltransferasa, código PDB: 2FYD y 2FY7) 32. Es probable que el bucle en SeHAS facilite el posicionamiento de SSE8 para la catálisis. El residuo Gln-248 se encuentra lejos de la bolsa de unión; el papel exacto de este residuo no se pudo predecir en base a estos estudios in-silico. Los estudios internos de mutación muestran que este residuo es importante. La sustitución del residuo por Ala resulta en una pérdida casi completa de producción de HA (Fig. 4A).El papel de este residuo se analiza más a fondo a través de estudios dinámicos de grano grueso y se discute en una sección posterior.
Las pequeñas empresas exhiben movimiento coordinado
El paradigma actual es estructura-codifica-dinámica-codifica-funciona33, 34, 35. Cada vez se reconoce más que las fluctuaciones aleatorias de los átomos en su estado nativo ocultan un movimiento coordinado que predispone a la proteína a cambios funcionales relevantes en su estructura. Estos movimientos se pueden capturar mediante modos de baja frecuencia en el modelado de redes elásticas. Se sabe que estos modos son insensibles a los detalles estructurales y energéticos. Por lo tanto, utilizamos el Modelado de red Anisotrópico (ANM), un enfoque basado en ENM para capturar imágenes globales de dinámicas codificadas por la estructura 3D de SeHAS. Usamos ProDy36 para cálculos de ANM. Más detalles se detallan en la sección Métodos. El movimiento coordinado se representa como valores de coeficiente de correlación entre nodos de la red ANM. Los valores medios del coeficiente de correlación se calcularon con base en los primeros 50 modos. La Figura 5A muestra el mapa de correlación para SeHAS. Los valores positivos del coeficiente de correlación son indicativos de átomos moviéndose en la misma dirección. El grupo de residuos espacialmente proximales con alto coeficiente de correlación se considera estructural y funcionalmente importante. Los pares de residuos con grandes valores positivos corresponden a elementos subestructurales. Además, la correlación entre pares de residuos se extiende a regiones de diferentes ESS. SSE1-4 forma un subdominio que interactúa estrechamente (rectángulo negro). Del mismo modo, SSE5-9 forma un subdominio de interacción coordinada (rectángulo gris). Los dos subdominios están separados por una región mal correlacionada. Los movimientos globales intrínsecos ilustran la coordinación funcional requerida con respecto a la unión del sustrato en un extremo, por SSE1-4 y la unión del polímero en el otro extremo (SSE5-9).

Evaluación de la dinámica global en SeHAS. A) Valores medios del coeficiente de correlación para las SEHA entre pares de residuos. Valores medios del coeficiente de correlación para Gln-248 (B) y Thr-283 (C) con otros residuos de SeHAS.
Exploramos más a fondo la dinámica de los SeHAS con respecto a los residuos Gln-248. Higo. 5B muestra la distribución de los valores del coeficiente de correlación con respecto a otros residuos en SeHAS. El Gln-248 muestra grandes valores positivos con SSE8, 9 y SSE3 que retienen residuos de unión catalítica y de sustrato. Un movimiento coordinado con estas pequeñas empresas evaluadas a través de la ANM ilustra aún más su papel en la dinámica de conformación funcionalmente relevante.
El estudio ANM se amplía para evaluar el efecto de la mutación en los valores del coeficiente de correlación. Para cada uno de los mutantes, se obtiene un modelo estructural utilizando RaptorX26. Los mutantes muestran una alta superposición estructural con un RMSD promedio de aproximadamente 1 Å en todos los átomos con respecto a la estructura de la proteína WT. Para cada estructura mutante, se calculan los valores del coeficiente de correlación con respecto al residuo mutante y se comparan con el peso. Las gráficas se muestran en la Fig. S2. Las mutaciones en el sitio 214, 248 y 283 muestran diferencias sustanciales en los valores en las regiones de ESS.
Alargamiento del polímero de extremo reductor en SeHAS, un mecanismo plausible de tres pasos
En miembros prototípicos de la familia GT-2 de la glicosiltransferasa, como la sintasa de celulosa,la biosíntesis del polímero se produce a partir del extremo no reductor del polimero25, 31 en crecimiento. En tales sistemas, los sustratos UDP actúan como un donante transfiriendo el azúcar al azúcar polimérico que actúa como aceptador24. Un enlace β entre los azúcares se crea a partir de precursores de azúcar-UDP ligados a α a través de una reacción de sustitución SN2 de desplazamiento directo. En esta reacción, un paso de desprotonación por una base catalítica funcionaliza el aceptador24. El ataque nucleofílico de este grupo de azúcar aceptor sobre el donante a través de un solo estado de transición tipo iónico de oxocarbenio produce una reacción de transferencia de glicosilo con la liberación de UDP del azúcar donante y la inversión neta de la estereoquímica en el carbono anomérico. Este mecanismo se ilustra en la Fig. 6A. SeHAS difiere de este prototipo. Se sabe que HA se alarga desde el extremo reductor12. Esto implica (i) que el UDP se libera del extremo del polímero y no de los sustratos UDP durante la catálisis y (ii) La reversión del donante y los aceptadores con el HA-UDP actuando como donante y el sustrato UDP-azúcar como aceptador. Con base en el panorama de la unión de ligandos y el conocimiento obtenido sobre la arquitectura del sitio activo, discutimos la participación de ligandos como donantes y aceptores y proponemos un mecanismo catalítico para la transferencia de glicosilo en SeHAS (Consulte la Fig. 6B).
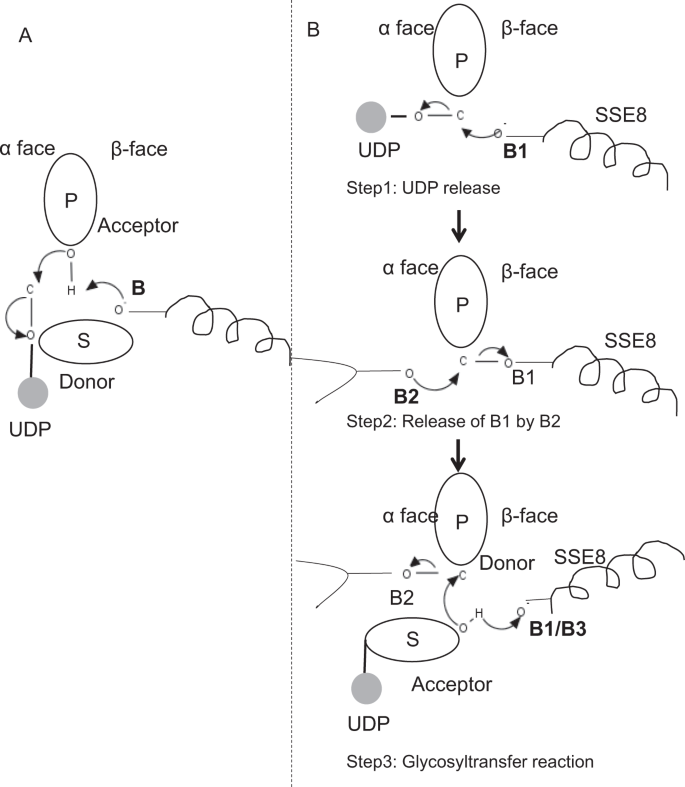
Mecanismo molecular propuesto en SeHAS. A) Mecanismo en una glicosiltransferasa prototípica con química de inversión. B) Se ha propuesto un mecanismo de Clase I. P: Azúcar polimérico, S: Azúcar de sustrato.UDP se indica como un círculo. B1, B2 y B3 son las bases catalíticas que participan en el mecanismo de reacción.
La reacción de glicosiltransferasa probablemente ocurre en múltiples pasos
Como primer paso, exploramos la posibilidad de una reacción de glicosiltransferasa de un solo paso en forma similar a la celulosa sintasa. Si la reacción de la glicosiltransferasa ocurre en un solo paso, la enzima en un momento dado necesitaría contener dos mitades UDP, una unida al polímero y otra unida al sustrato entrante. En el escenario alternativo de varios pasos, el UDP del polímero se libera antes de que ocurra la reacción catalítica. En este caso, para crear una inversión neta de la estereoquímica, la reacción ocurriría en una serie de pasos impares con mecanismo SN2. Para evaluar qué escenario es más probable, realizamos estudios de unión UDP a través del acoplamiento de moléculas UDP en el dominio glicosiltransferasa. La evaluación indica una superposición significativa de los sitios de unión UDP y UDP-sustrato.El resultado se presenta en la Sección complementaria. Una conformación energéticamente favorable ejemplar de UDP junto con regiones de unión de sustrato y polímero se muestra en la Fig suplementaria. S3. Aunque la evaluación se basa en el modelo estático, la colocación de dos moléculas grandes de naturaleza química similar en estrecha proximidad con los requisitos de entornos fisioquímicos similares es poco probable para esta enzima. Especulamos que un pasaje revestido con residuos cargados positivamente de SSE9 e iones metálicos podría facilitar la liberación de UDP desde el extremo del polímero. La participación de iones metálicos en la glicosiltransferasa para la liberación de UDP también está bien documentada24. Dado que los dos sitios UDP no son mutuamente excluyentes, el segundo escenario de reacción en varios pasos parece más probable.
Una vez que el UDP se libera del polímero, un ataque nucleofílico del grupo OH de sustrato–UDP (aceptor) crearía un enlace glucosídico. Para crear inversión, la liberación de UDP y el ataque nucleofílico subsiguiente deben ocurrir desde dos caras opuestas de azúcar polimérico. Proponemos el papel de tres catalizadores de base en el esquema de reacción general que se encuentran en las caras α y β del azúcar donante en el extremo del polímero. Estos pasos se ilustran a través de la Fig. 6B y se describe a continuación.
Reacción de glicosiltransferasa de tres pasos propuesta
Paso 1: Liberación de UDP: Asp – 260 de SSE8 podría actuar como base (B1) e iniciar la liberación de la molécula UDP del polímero (donante) de la cara α. Este paso crearía un intermediario de enzima glicosil unida covalentemente blindado en la cara β con la base B1. Para crear una inversión, esta cara del azúcar debe estar libre de ataques nucleofílicos por parte del grupo O-H de azúcar entrante. Por lo tanto, un paso intermedio, con el ataque nucleofílico de la cara α, liberaría la cara β lista para el ataque nucleofílico por el azúcar aceptor.
Paso 2: Liberación de B1 por B2; Explorando el papel de Thr-283: La base B2 en la cara α del azúcar donante llevaría a cabo un ataque nucleofílico al carbono anomérico en el centro de reacción y liberaría B1. Nuestros estudios estructurales muestran Gln-295 y Thr-283 conservados en esta cara. La liberación de UDP podría dar lugar a cambios conformacionales y llevar uno de estos residuos cerca del azúcar donante para la catálisis. La mutación del Gln-295 produce hasta un 90% de pérdida de actividad, pero no se conoce su papel como base 20. Evaluamos la posibilidad de que un Thr-283 conservado residiera en un bucle para funcionar como segunda base. Mutamos Thr a Ser que contenía un grupo funcional de OH similar y a Ala con una pequeña cadena lateral alifática. Los mutantes T283A y T283S muestran una pérdida de producción de HA de ~95% (Fig. 4A). Este residuo muestra una correlación positiva con las regiones SSE4 y SSE6 y una región espacialmente proximal entre el residuo 186 y el residuo 190 (Fig. 5C). El residuo 188, aunque no se conserva, se encuentra en las proximidades del sustrato acoplado (Fig. 3). Thr-283 no muestra una alta correlación positiva con SSE8 que sostiene la base catalítica. Es posible que el residuo actúe como un residuo de base de soporte durante la reacción catalítica con su movimiento coordinado con la región de unión al sustrato espacialmente proximal independiente de la base Asp-260 en SSE8. Se requerirían más experimentos para corroborar su papel como base. En general, el estudio destaca otro residuo funcionalmente crítico, no conocido previamente.
Paso 3: Reacción de transferencia de glicosilo: Una vez que se libera B1, la cara β del carbono anomérico del azúcar polimérico se desbloquea para la reacción. La desprotonación de substrato-UDP en la misma cara por una tercera base crearía un grupo nucleofílico. Este paso podría ser iniciado por B1 u otra base B3. Asp-259, junto a B1, es un residuo altamente conservado en la proximidad del sustrato-UDP y podría actuar como B3. Sin embargo, B1/B3 está más cerca del azúcar polimérico (donante) como se discutió en el paso 1. Para iniciar la desprotonación, el B1 tiene que estar cerca del azúcar receptor. Podría lograrse a través de cambios de conformación en la ESS8 asistidos por la ESS7. La hélice equivalente en la celulosa sintasa mantiene la base catalítica, y se somete a transiciones conformacionales coordinadas para la reacción y translocación de la glicosiltransferasa. Un ataque nucleofílico del azúcar aceptor sobre el carbono anomérico del azúcar donante crearía un enlace glucosídico y la liberación de la base B2.