- 3-D-Strukturmerkmale von SeHAS
- Unterbauelemente (SSE) der Klasse I HAS
- Bindungsstellen von UDP-Substraten überlappen sich
- Lys-139 ist in SeHAS entbehrlich und spielt eine Rolle bei der Substratbindung
- SSE5 bindet an Polymer und beeinflusst die HA-Produktion
- Gln-248 (SSE7) ist kritisch mit einer plausiblen Rolle beim Konformationsübergang
- SSE zeigen koordinierte Bewegung
- Verringerung der Endpolymerdehnung in SeHAS, ein plausibler dreistufiger Mechanismus
- Glycosyltransferase-Reaktion tritt wahrscheinlich in mehreren Schritten auf
- Vorgeschlagene dreistufige Glykosyltransferase-Reaktion
3-D-Strukturmerkmale von SeHAS
Ein Strukturmodell der SeHAS-Sequenz wurde mit RaptorX webserver26 generiert. Das Modell wurde mit Cellulosesynthase-Template (PDB: 4P00) erhalten.Das Template-Enzym teilt eine hohe funktionelle Ähnlichkeit und eine geringe Sequenzähnlichkeit (~ 15%) mit SeHAS25. Trotz der geringen Sequenzähnlichkeit zur Vorlage ist das erhaltene Modell von hoher Qualität, wie die globalen (P-Wert: 10-8) und absoluten (GDT-Wert: 52) Qualitätsmessungen anzeigen26. Die stereochemische Qualitätsbewertung des Strukturmodells zeigt, dass sich 98,5% der Rückstände in der erlaubten / teilweise erlaubten Region des Ramachandran-Grundstücks befinden.
Abbildung 1 zeigt das Strukturmodell von SeHAS. Das HAS-Strukturmodell zeigt, dass sich die einzelne Kette in drei Komponenten faltet: (i) eine funktionelle Glykosyltransferase-Domäne, (ii) vier Transmembranhelices (TM1-TM4) und (iii) drei amphipathische Helices (AP1-AP3). Die Glycosyltransferase-Domäne nimmt eine GT-A-Falte an, die durch ein gemischtes 7-Strang-β-Blatt gebildet wird, das von α-Helices in β / α-Architektur umgeben ist. Transmembranhelices (TM1-TM4) bilden ein Vierhelixbündel und erzeugen eine Pore für die Polymertranslokation. 11 C-terminale Reste von SeHAS werden als ungeordnet vorhergesagt und in Fig. 1. Die oligomere Natur von SeHAS wird noch untersucht. Bis 2018 wurde SeHAS charakterisiert, um in seiner monomeren Form zu funktionieren9. Jüngste Berichte zeigen SeHAS Enzymfunktionen als homodimer27. Der Umfang der vorliegenden Arbeit beschränkt sich auf die Beurteilung von Merkmalen im Protomer.

Strukturmodell und Merkmale von SeHAS. SSE: Substrukturelles Element, AP: Amphipathische Helix, TM: Trans-Membran-Helix.
Das 3D-Strukturmodell von SeHAS stimmt mit der zuvor bestimmten Topologie von HAS in Streptococcus pyogenes überein, die unter Verwendung von Fusions-, Markierungs- und Protease-Zugänglichkeitsexperimenten abgeleitet wurde12,16,19 mit einem geringfügigen Unterschied in der Anzahl der amphipathischen Helices. Wir schlagen das Vorhandensein von drei amphipathischen Helices anstelle von zwei amphipathischen Helices vor, die zuvor auf der Grundlage einer vergleichenden Bewertung mit Cellulosesynthasestruktur berichtet wurden. SeHAS-Reste, die der amphipathischen Helix AP2 entsprechen, wurden nicht speziell auf ihren zellulären Standort untersucht16. Wie später in diesem Manuskript diskutiert, hält diese Helix Reste von funktioneller Bedeutung.
Das Strukturmodell erklärt die Ergebnisse der N-Ethylmaleinimid (NEM)-Hemmung in SeHAS19. NEM reagiert mit Thiolgruppen und wird daher verwendet, um die Rolle von Cysteinresten in Proteinen zu untersuchen. SeHAS hat vier Cys-Reste: Cys-226, Cys-262 und Cys-281 und Cys-367. Die ersten drei Cysteinreste befinden sich im Cytosol und sind daher für NEM zugänglich, was zu einer Hemmung führt. Cys-367 befindet sich jedoch in der Transmembranhelix und ist für NEM unzugänglich. Daher wird für diesen Rückstand keine Hemmung gemeldet. In Gegenwart von Substrat bindet NEM nur an Cys-281. Unsere strukturellen Studien (später beschrieben) zeigen, dass Cys-226 und Cys-262 in unmittelbarer Nähe der UDP-Substratbindungsstelle liegen und das Vorhandensein von Substrat somit den Zugang von NEM zu diesen Resten blockieren würde. Cys-281 liegt von der UDP-Bindungsstelle entfernt und das Vorhandensein von Substrat blockiert diese Stelle nicht von der NEM-Hemmung.
Unterbauelemente (SSE) der Klasse I HAS
Es gibt nur wenige Informationen über die für die Klasse I HAS spezifischen Funktionsmaschinen. In Ermangelung einer 3D-Struktur ist eine funktionelle Rolle experimentell untersuchter Stellen nicht bekannt. Um die funktionellen Komponenten in SeHAS und ihre relative Anordnung in 3D zu verstehen, identifizieren wir daher kurze zusammenhängende Regionen mit evolutionär konservierten Sequenzmerkmalen, die als Substrukturelemente (SSE) bezeichnet werden. Wir verglichen 81 Klasse-I-HAS-Sequenzen, die durch strenge Auswahlkriterien erhalten wurden, die im Abschnitt Methoden ausgearbeitet wurden. Klasse I HAT Enzyme, die sich in der Anzahl der Transmembranhelices unterscheiden. In Ermangelung struktureller Informationen ist die Ausrichtung in dieser Region von schlechter Qualität. Daher ist der Vergleich von Sequenzen auf die cytosolische Region beschränkt, um Stellen mit mehrdeutiger Rest-Rest-Korrespondenz zu vermeiden. Die Ausrichtung von HAS-Klasse-I-Sequenzen ist als ergänzende Fig. S1, erstellt mit Jalview. Für jede Rest-Rest-Entsprechung in Bezug auf die SeHAS-Sequenz wird ein Konservierungswert berechnet. Eine zusammenhängende Strecke mit einer durchschnittlichen Punktzahl > = 70 und mindestens 2 Standorten mit einer Punktzahl > = 80 wird als substrukturelles Element (SSE) definiert. Anhand dieser Kriterien identifizieren wir 9 Teilstrukturelemente mit der Bezeichnung SSE1-SSE9 von potenzieller struktureller / funktionaler Bedeutung in HAS (Abb. 2). Die Sekundärstruktur für die meisten SSEs wird Schleifen zugeordnet, mit Ausnahme von SSE5, SSE8 und SSE9, die in Helices auftreten. Diese Elemente sind ebenfalls in Fig. 1. Tabelle 1 fasst die Sequenzdetails sowie die strukturelle und funktionelle Rolle von SSE zusammen.

Ein Diagramm der Erhaltungsbewertung in Bezug auf SeHAS Sequenznummer. SSE oben angegeben. Die Sekundärstrukturprojektion der Sequenz ist unten angegeben. Die Stränge sind als Pfeile markiert und Helices als Rechtecke dargestellt. Gefüllte Rechtecke entsprechen amphipathischen Helices. Siehe Text für Details.
Unsere Studie berichtet über konservierte SSE: SSE5 und SSE7 spezifisch für HAS. Bisher untersuchte Mutationen, die den Resten Tyr-74, Asp-159, Ser-218, Cys-226 entsprechen. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413 haben gezeigt, dass sie die Aktivität beeinflussen. Mutationen, die den Resten Lys-48, Glu-327, Lys-414, Lys-415 entsprechen, beeinflussen die Reaktionsgeschwindigkeit und/oder das Molekulargewicht des HA-Polymers18,19,20,21,23. Die meisten dieser Mutationsstellen sind SSE1-4, 6, 8 und 9 zugeordnet (Tabelle 1).Andere Websites sind kein erhaltenes Merkmal der Klasse I hat Familie. In: Bi et al. (2015) analysierten verschiedene prozessive Glycosyltransferasen und diskutierten das Vorhandensein von drei unterschiedlich beabstandeten Asp-Resten in der Glycosyltransferase-Domäne, die für die Aktivität entscheidend sind25. Dazu gehören Asp von SSE1 bei der Nukleotidbindung, Asp von SSE2 bei der Bindung an Metall, Asp in SSE8 mit einer wahrscheinlichen Rolle als Base. Darüber hinaus wird eine wahrscheinliche Rolle bei der Polymerbindung für Reste von SSE9 vorgeschlagen. Weigel (2015) schlug acht Asp / Glu-haltige Tripeptide als potenzielle Regionen vor, die an der UDP-Zuckerbindung beteiligt sind12. Um die Rolle von SSE aufzuklären und Regionen zu identifizieren, die an UDP-Zucker binden, führten wir Docking-Simulationen durch.
Es wird erwartet, dass das Enzym mindestens zwei Bindungsstellen aufweist, eine für UDP-Zuckersubstrate und die andere für polymeren Zucker, um eine glykosidische Bindungsbildung12 zu katalysieren. Um die Bindungsstellen in der Enzymstruktur zu identifizieren, führten wir Docking-Studien an UDP-Zuckersubstraten durch: UDP-N-Acetylglucosamin und UDP-Glucuronsäure. Die Bindungsregion für UDP-Substrate wird durch ein Gitter mit seinem Zentrum in der Glycosyltransferase-Domäne, wie in Methoden definiert, bewertet.
Bindungsstellen von UDP-Substraten überlappen sich
Docking-Simulationen werden getrennt für UDP-N-Acetylglucosamin und UDP-Glucuronsäure durchgeführt. Niedrigenergiekonformatoren (besser als 5 kcal / mol) werden ausgewählt. Abbildung 3A zeigt die Häufigkeit von Kontakten verschiedener Standorte mit energetisch günstigen Konformern über verschiedene Simulationsläufe hinweg. Polare Reste mit einer Frequenz von mindestens 10% zu einem der beiden Substrate sind dargestellt. Die bemerkenswerte Beobachtung aus der Abbildung ist, dass sich die Bindungsstellen für die beiden Zuckersubstrate überlappen.

( A) Häufigkeit von Ligandenkontaktresten für energetisch günstige Konformere von UDP-N Acetylglucosamin (UDP-GlcNAc) und UDP- D Glucuronsäure (UDP-GlcA). Die Frequenz wird auf der X-Achse und die Standorte auf der Y-Achse aufgetragen. (B) Rolle von SSE1–4, SSE8 und SSE9 bei der Bindung von UDP-Zuckersubstraten. (C) Rolle von SSE6 bei der Ligandenbindung. (D) Rolle von SSE bei der Polymerbindung. (E) Rolle von SSE7. (i) SSE7-Schleife in Hyaluronansynthase, (ii) Äquivalente Schleife in Cellulosesynthase, (iii) Äquivalente Schleife in nicht-prozessiver Glycosyltransferase. (F) Energieerzeugung hat Struktur zeigt UDP-N-Acetylglucosamin und Disaccharid von Glucuronsäure und N-Acetylglucosamin moeities.
Die Rolle der kontaktierenden Reste wurde durch Untersuchung der Bindung mit dem energetisch günstigsten biologisch relevanten Konformer beurteilt. Die Auswahl des Konformers wird durch die Nähe des Nukleotidrings von UDP zum evolutionär konservierten SSE1 gesteuert, von dem bekannt ist, dass es an der Nukleotidbindung beteiligt ist. Die ausgewählten Conformer in der Bindetasche sind in Fig. 3B. SSE1-SSE4, SSE6, SSE8 und SSE9 sind an der Substratbindung beteiligt (Abb. 3B). SSE1, SSE2 und SSE4 stabilisieren weitgehend den Uridinteil der Substrate, während SSE3, SSE8 und SSE9 mit dem Zuckerring interagieren. Die initiale Bindung des UDP-Rings des Substrats mit Enzym könnte durch (i) Seitenkette von konserviertem Asp-103 von SSE2 erleichtert werden (blau, Abb. 3B) durch Wasserstoffbrückenbindungen mit polaren Nukleotidgruppen und (ii) durch aromatischen Ring von Tyr-74 (grün, Abb. 3B) von SSE1 durch π-π-Wechselwirkungen mit dem Uridinring von UDP. Seitenkette von Glu-76 (grün, Abb. 3B) von SSE1 bildet Wasserstoffbrückenbindungen mit polaren Gruppen von Ribosezucker von UDP. Rückstand Asp-161 von SSE4 stabilisiert die OH-Gruppe des Riboserings, während Asp-159 das Metallion stabilisiert. Gln-295 und Arg-298 (blau) von SSE9 könnten interagieren und die Pyrophosphatgruppe des UDP-Nukleotids stabilisieren. Das NE-Atom von Trp-299 befindet sich im H-Bindungsabstand zum Zuckersubstrat und hilft wahrscheinlich bei der Ausrichtung des Substrats. Asp-260 ist topologisch äquivalent zur katalytischen Base in Cellulosesynthase25. SSE8 hält Asp-260. Sequentiell proximal zu diesem Rest sind Asp-259 und Arg-261, die beide mit den polaren Gruppen des Zuckerrings wechselwirken (grün). Rest Arg-140, neben Lys-139, ist teilweise konserviert und nur mit Lys in SeHAS Homologen ersetzt. Dieser Rückstand befindet sich in unmittelbarer Nähe des N-terminalen Endes der Helix, die SSE8 (grün) hält. Dieses Ende enthält negativ geladene Asp-Reste, die durch Arg-140 neutralisiert werden könnten.
Rückstände aus SSE6 (Abb. 3C) Erstellen Sie ein Gerüst, um Liganden an der Bindungsstelle zu unterstützen. Die Schlaufe ist strategisch platziert und bildet die Basis der Bindetasche. Die Schleife sitzt auch in der Nähe der katalytischen Base (SSE8) und des gebundenen polymeren Zuckers (später diskutiert). Wie oben diskutiert, platzieren Experimente mit N-Ethlymaleimid das konservierte Cys-226 dieses Elements in der Nähe der UDP-Zuckerbindungsstelle19. Dies ist wahrscheinlich an der Aufrechterhaltung der pKa der Mikroumgebung am aktiven Ort beteiligt. Obgleich nicht wesentlich für Tätigkeit, wird Veränderung dieses Rückstandes zu Ala gezeigt, um Tätigkeit in SeHAS19,28 zu beeinflussen. Die Seitenkette von Ser-227 ist wahrscheinlich an der Stabilisierung der Schleifenanpassung durch Wechselwirkungen mit der Hauptkette beteiligt. Gly-228 und Pro-229 sorgen für die notwendige Flexibilität und Steifigkeit der Hauptkettenkonformation (Abb. 3C).
Lys-139 ist in SeHAS entbehrlich und spielt eine Rolle bei der Substratbindung
Docking-Bewertungen deuten auf eine Rolle von Lys-139 bei der Ligandenbindung hin. Frühere Studien haben eine regulatorische Rolle für diesen Rückstand in Säugetierformen von HAS berichtet. Bei Mäusen führt eine Mutation zu Arg zu einem vollständigen Aktivitätsverlust24. In Ermangelung von Mutationsstudien an SeHAS führten wir Mutationsstudien an Lys-139 durch, um seine Rolle weiter aufzuklären. Details zum Versuchsaufbau und Assay sind unter Methoden beschrieben. Experimentelle Ergebnisse und die für die Studie verwendete pMBAD-Vektorkarte sind in Abb. 4A, B bzw. Wir mutierten Lys-139 zu Arg (K139R) mit dem Ziel, die Ladung an dieser Position zu erhalten. Die Mutation führte nicht zu einem vollständigen Aktivitätsverlust, hatte aber Auswirkungen. Nur 34% Aktivität (HA-Produktion) wurden im Vergleich zur Kontrolle beibehalten, was eine signifikante funktionelle Rolle dieses Rückstands bestätigt (Abb. 4A). Um die ladungsbasierte Wechselwirkung zwischen diesem Rückstand und dem Substrat weiter zu untersuchen, mutierten wir positiv geladenes Lys-139 zu negativ geladenem Asp (K139D). Negative Ladung am Standort führt zur Beibehaltung von 82% Aktivität (HA-Produktion) im Vergleich zur Kontrolle. Diese Analyse legt nahe, dass dieser Rest eine Rolle bei der Stabilisierung polarer Gruppen des Substrats spielt. Die Auswahl der Substitutionen verdeutlicht ferner, dass sowohl positiv als auch negativ geladene Gruppen an der Stelle untergebracht sind. Unsere Studien zeigen, dass dieser Rückstand die Synthaseaktivität in SeHAS direkt beeinflusst. Mutationen an dieser Stelle beeinträchtigen die Synthasefunktion erheblich.

Mutationsstudien an SeHAS. (A) Relative Aktivität von SeHAS-Mutanten, die in dieser Studie durchgeführt wurden. Die Experimente wurden in Triplikaten durchgeführt und der Standardfehler für den HA-Titer lag im Bereich von ± 0,01 bis ± 0,05. (B) pMBAD-Vektorkonstrukt. hasA- und hasB-Gene aus Streptococcus equi subsp. zooepidemicus wurden sequentiell kloniert. Für Mutationsstudien wurde der HASA-Wildtyp durch die entsprechende(n) Mutante(n) ersetzt.
SSE5 bindet an Polymer und beeinflusst die HA-Produktion
Der Hohlraum oberhalb der UDP-Substrat-Bindungsregion, der durch amphipathische Helices gebildet wird, wird zur Bindung der Polymereinheit ausgewertet. Die Polymerbindungsstudie beschränkt sich auf das terminale Disaccharid, das an der Bildung einer glykosidischen Bindung beteiligt ist. Docking-Studien wurden mit einer Disaccharideinheit durchgeführt, die aus einem β 1-4-verknüpften N-Acetylglucosamin und D-Glucuronsäure in der Glycosyltransferase-Domäne besteht. Energetisch günstige Konformatoren wurden ausgewählt. Abbildung 3D zeigt eine HA-Disaccharideinheit, die in der Nähe der Bindungstasche angedockt ist. SSE5, SSE8 und SSE9 sind an der Bindung beteiligt (Abb. DREIDIMENSIONAL). Der Rückstand Asp-260 aus SSE8 befindet sich in H-Bindungsabstand zur terminalen OH-Gruppe des Polymers und ist in Fig. 3D. Arg-261 von SSE8 liegt in der Nähe des Polymers und könnte mit den polaren OH-Gruppen des Zuckers interagieren. Rest Trp-299 von SSE9 bildet CH-π Wechselwirkungen mit dem terminalen Zucker.
Nach unserem besten Wissen ist dies der erste Bericht, der die funktionelle Beteiligung von Rückständen aus SSE5 vermutet. Schlüsselreste in SSE5, die an der Bindung an das Polymer beteiligt sind, sind Arg-205, Tyr-206, Phe-210 und Arg-214. Arg-205 befindet sich in unmittelbarer Nähe des angedockten Disaccharids und ist an Wechselwirkungen mit den negativ geladenen polaren Gruppen der Zuckereinheit beteiligt. Tyr-206 oder Phenylalanin in SeHAS-Homologen stabilisiert den Arg-205-Rest durch Kation-π-Wechselwirkungen. Arg-214 oder Lys in homologen Sequenzen befindet sich in unmittelbarer Nähe des Polymers und in der Nähe von teilweise konserviertem Phe-210, mit dem es Kation-π-Wechselwirkungen bildet. Die Folge der Mutation der Reste aus SSE5 ist nicht bekannt. Hier untersuchen wir die Konsequenz der Mutation von Tyr-206 und Arg-214 auf Funktion durch ortsgerichtete Mutagenese. Unsere experimentellen Ergebnisse zeigen, dass die Unterbrechung der Kation-π-Wechselwirkungen durch Mutation des aromatischen Tyrosins zu Alanin (Y206A) zu einem 99% igen Verlust der HAS-Aktivität (HA-Produktion) führt (Abb. 4A). Der Verlust dieser Wechselwirkung könnte indirekt die Polymerbindung durch angrenzendes Arg-205 beeinflusst haben. In ähnlicher Weise führt die Mutation des basischen Argininrestes bei 214 zu Alanin (R214A) zu einem vollständigen Funktionsverlust (Abb. 4A). Interessanterweise führt die Einführung einer negativen Ladung (R214E) zu einem Funktionsverlust von 93% (Abb. 4A). Diese Ergebnisse wiederholen die Notwendigkeit einer positiven Nettoladung an dieser Stelle, um die Polymerbindung und -translokation zu erleichtern. Diese Mutationen weisen auf die Interdependenz von Polymerbindung / -translokation und Glykosyltransferaseaktivitäten hin.
Ferner wurde das mit den beiden Liganden (UDP-Zucker und Disaccharid) komplexierte Enzym unter Verwendung von Bernsteinkraftfeldern energieminimiert. Abbildung 3F zeigt das Enzym, das an UDP-N-Acetylglucosamin und Disaccharid gebunden ist, das durch verknüpfte Glucuronsäure und N-Acetylglucosamin mit Glucuronsäure am polymeren Ende gebildet wird. Die Details zum Minimierungsprotokoll sind unter Methoden beschrieben.
Gln-248 (SSE7) ist kritisch mit einer plausiblen Rolle beim Konformationsübergang
Gln-248 ist ein konservierter Rest in SSE7, eine lange Schleife von der Bindungsstelle entfernt. Die äquivalente Schleife sowohl in prozessiven als auch in nicht-prozessiven Homologen ist sequentiell unterschiedlich und zeigt unterschiedliche Konformationen in substratgebundenen und ungebundenen Enzymformen (Abb. 3E(ii))29,30,31 und Fig. 3E (iii) β 1-4 galactosyltransferase, PDB-Code: 2FYD und 2FY7)32. Die Schleife in SeHAS dürfte die Positionierung von SSE8 für die Katalyse erleichtern. Der Rückstand Gln-248 liegt außerhalb der Bindungstasche; Die genaue Rolle dieses Rückstands konnte aufgrund dieser In-Silico-Studien nicht vorhergesagt werden. Interne Mutationsstudien zeigen, dass dieser Rückstand wichtig ist. Der Ersatz des Rückstands durch Ala führt zu einem nahezu vollständigen Verlust der HA-Produktion (Abb. 4A).Die Rolle dieses Rückstands wird durch grobkörnige dynamische Studien weiter untersucht und in einem späteren Abschnitt erörtert.
SSE zeigen koordinierte Bewegung
Das aktuelle Paradigma ist Struktur-kodiert-Dynamik-kodiert-Funktion33,34,35. Es wurde zunehmend erkannt, dass zufällige Fluktuationen von Atomen in ihrem nativen Zustand koordinierte Bewegungen verbergen, die das Protein für funktionell relevante Strukturänderungen prädisponieren. Diese Bewegungen können durch niederfrequente Modi in der elastischen Netzwerkmodellierung erfasst werden. Diese Moden sind bekanntermaßen unempfindlich gegenüber strukturellen und energetischen Details. Daher haben wir Anisotrope Netzwerkmodellierung (ANM) verwendet, einen ENM-basierten Ansatz, um ein globales Bild der Dynamik zu erfassen, das durch die 3D-Struktur von SeHAS kodiert wird. Wir haben ProDy36 für ANM-Berechnungen verwendet. Weitere Details werden im Abschnitt Methoden erläutert. Koordinierte Bewegung wird als Korrelationskoeffizientenwerte zwischen Knoten des ANM-Netzwerks dargestellt. Die durchschnittlichen Korrelationskoeffizientenwerte wurden basierend auf den ersten 50 Modi berechnet. Abbildung 5A zeigt die Korrelationskarte für SeHAS. Positive Korrelationskoeffizientenwerte zeigen an, dass sich Atome in dieselbe Richtung bewegen. Cluster von räumlich proximalen Resten mit hohem Korrelationskoeffizienten werden als strukturell und funktionell wichtig angesehen. Die Restpaare mit großen positiven Werten entsprechen substrukturellen Elementen. Ferner erstreckt sich die Korrelation zwischen Residuenpaaren auf Regionen über verschiedene SSE hinweg. SSE1-4 bilden eine eng zusammenwirkende Subdomain (schwarzes Rechteck). In ähnlicher Weise bilden SSE5-9 eine koordinierte interagierende Subdomain (graues Rechteck). Die beiden Subdomains sind durch eine schlecht korrelierte Region getrennt. Die intrinsischen globalen Bewegungen veranschaulichen die funktionelle Koordination, die in Bezug auf die Substratbindung an einem Ende durch SSE1-4 und die Polymerbindung am anderen Ende (SSE5-9) erforderlich ist.

Bewertung der globalen Dynamik in SeHAS. (A) Durchschnittliche Korrelationskoeffizientenwerte für SeHAS über Rückstandspaare hinweg. Durchschnittliche Korrelationskoeffizientenwerte für Gln-248 (B) und Thr-283 (C) mit anderen SeHAS-Resten.
Wir untersuchten weiter die Dynamik von SeHAS in Bezug auf Rest Gln-248. Abb. 5B zeigt die Verteilung der Korrelationskoeffizientenwerte in Bezug auf andere Reste in SeHAS. Die Gln-248 zeigen große positive Werte mit SSE8, 9 und SSE3, die katalytische und Substratbindungsreste halten. Eine koordinierte Bewegung mit diesen SSEs, die durch ANM bewertet wird, veranschaulicht weiter seine Rolle in der funktionell relevanten Konformationsdynamik.
Die ANM-Studie wird erweitert, um den Effekt der Mutation auf die Korrelationskoeffizientenwerte zu bewerten. Für jede der Mutanten wird ein Strukturmodell unter Verwendung von RaptorX26 erhalten. Die Mutanten zeigen eine hohe strukturelle Überlappung mit einem durchschnittlichen RMSD von etwa 1 Å über alle Atome in Bezug auf die WT-Proteinstruktur. Für jede Mutantenstruktur werden Korrelationskoeffizientenwerte in Bezug auf den Mutantenrest berechnet und mit dem WT verglichen. Die Diagramme sind in Abb. S2. Mutationen an den Stellen 214, 248 und 283 weisen erhebliche Wertunterschiede in SSE-Regionen auf.
Verringerung der Endpolymerdehnung in SeHAS, ein plausibler dreistufiger Mechanismus
In prototypischen Mitgliedern der Glykosyltransferase-Familie GT-2 wie Cellulosesynthase, Die Polymerbiosynthese erfolgt vom nicht reduzierenden Ende des wachsenden Polymers25,31. In solchen Systemen wirken UDP-Substrate als Donor, der den Zucker auf den polymeren Zucker überträgt, der als Akzeptor fungiert24. Eine β-Verknüpfung zwischen den Zuckern wird aus α-verknüpften Zucker-UDP-Vorläufern durch eine direkte Verdrängungs-SN2-Substitutionsreaktion erzeugt. Bei dieser Reaktion funktionalisiert ein Deprotonierungsschritt durch eine katalytische Base den Akzeptor 24. Der nukleophile Angriff dieser Akzeptor-Zuckergruppe auf den Donor über einen einzelnen Oxocarbenium-Ionen-ähnlichen Übergangszustand führt zu einer Glykosyl-Transferreaktion mit der Freisetzung von UDP aus dem Donorzucker und einer Nettoinversion der Stereochemie bei anomerem Kohlenstoff. Dieser Mechanismus ist in Fig. 6A. SeHAS unterscheidet sich von diesem Prototyp. Es ist bekannt, dass sich HA vom reduzierenden Ende 12 erstreckt. Dies impliziert, dass (i) UDP während der Katalyse vom Polymerende und nicht von den UDP-Substraten freigesetzt wird und (ii) Umkehrung von Donor und Akzeptoren mit HA-UDP als Donor und UDP-Zuckersubstrat als Akzeptor. Basierend auf der Landschaft der Ligandenbindung und dem gewonnenen Wissen über die Architektur des aktiven Zentrums diskutieren wir die Beteiligung von Liganden als Donor und Akzeptor und schlagen einen katalytischen Mechanismus für den Glykosyl-Transfer in SeHAS vor (siehe Abb. 6B).
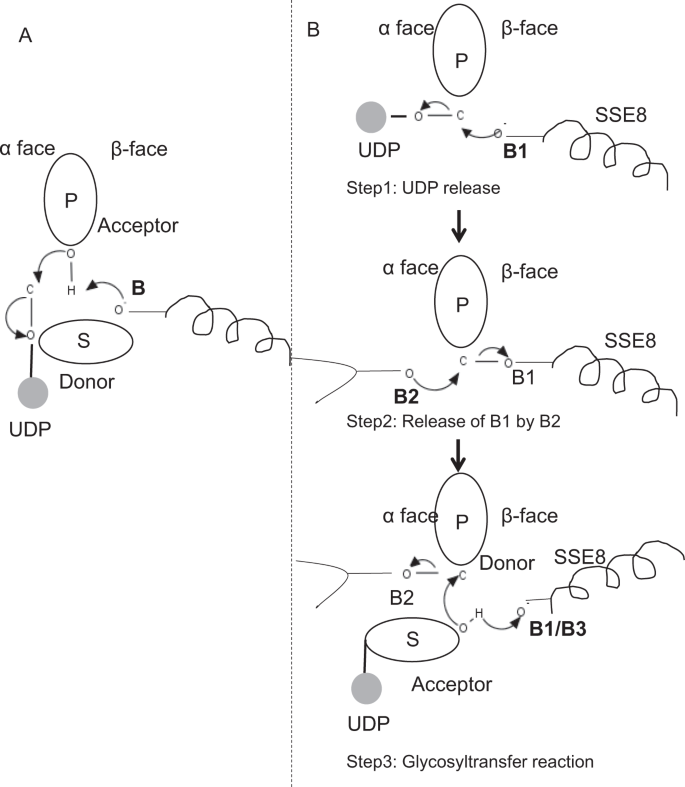
Vorgeschlagene molekulare Mechanismen in SeHAS. (A) Mechanismus in einer prototypischen Glycosyltransferase mit Inversionschemie. (B) Vorgeschlagene Mechanismus in der Klasse I hat. P: Polymerer Zucker, S: Substratzucker.UDP wird als Kreis angezeigt. B1, B2 und B3 sind die am Reaktionsmechanismus beteiligten katalytischen Basen.
Glycosyltransferase-Reaktion tritt wahrscheinlich in mehreren Schritten auf
Als erster Schritt untersuchten wir die Möglichkeit einer einstufigen Glycosyltransferase-Reaktion in Cellulosesynthase-ähnlicher Weise. Wenn die Glycosyltransferase-Reaktion in einem Schritt abläuft, müsste das Enzym zu einem bestimmten Zeitpunkt zwei UDP-Einheiten halten, eine an Polymer und eine an Substrat. Im alternativen mehrstufigen Szenario wird das UDP aus dem Polymer freigesetzt, bevor eine katalytische Reaktion stattfindet. In diesem Fall, um eine Inversion der Stereochemie zu erzeugen, Die Reaktion würde in einer Reihe ungerader Schritte mit dem SN2-Mechanismus erfolgen. Um zu bewerten, welches Szenario wahrscheinlicher ist, führten wir UDP-Bindungsstudien durch Andocken von UDP-Molekülen in der Glykosyltransferase-Domäne durch. Die Bewertung zeigt eine signifikante Überlappung von UDP- und UDP-Substrat-Bindungsstellen.Das Ergebnis wird in diesem Abschnitt vorgestellt. Eine beispielhafte energetisch günstige Konformation von UDP zusammen mit Substrat- und Polymerbindungsbereichen sind in ergänzender Fig. S3. Obwohl die Bewertung auf dem statischen Modell basiert, ist die Platzierung von zwei großen Molekülen ähnlicher chemischer Natur in unmittelbarer Nähe zu Anforderungen ähnlicher physiochemischer Umgebungen für dieses Enzym unwahrscheinlich. Wir spekulieren, dass eine Passage, die mit positiv geladenen Resten von SSE9 und Metallionen ausgekleidet ist, die UDP-Freisetzung vom Polymerende erleichtern könnte. Die Beteiligung von Metallionen an der Glykosyltransferase für die UDP-Freisetzung ist ebenfalls gut dokumentiert24. Da sich die beiden UDP-Standorte nicht gegenseitig ausschließen, erscheint das zweite Szenario einer mehrstufigen Reaktion wahrscheinlicher.
Sobald UDP aus dem Polymer freigesetzt wird, würde ein nukleophiler Angriff von der OH–Gruppe des Substrats-UDP (Akzeptor) eine glykosidische Verknüpfung erzeugen. Um eine Inversion zu erzeugen, müssen die UDP-Freisetzung und der anschließende nukleophile Angriff von zwei gegenüberliegenden Seiten des polymeren Zuckers erfolgen. Wir schlagen die Rolle von drei Basiskatalysatoren im Gesamtreaktionsschema vor, die auf α- und β-Flächen des Donorzuckers am Polymerende liegen. Diese Schritte sind durch Fig. 6B dargestellt und nachfolgend beschrieben.
Vorgeschlagene dreistufige Glykosyltransferase-Reaktion
Schritt 1: UDP-Freisetzung: Asp-260 aus SSE8 könnte als Base (B1) wirken und die Freisetzung des UDP-Moleküls aus Polymer (Donor) aus α-face initiieren. Dieser Schritt würde ein kovalent gebundenes Glykosyl-Enzym-Intermediat erzeugen, das auf der β-Seite mit der Base B1 abgeschirmt ist. Um eine Inversion zu erzeugen, muss diese Seite des Zuckers für den nukleophilen Angriff durch die ankommende Zucker-O-H-Gruppe frei sein. Daher würde ein Zwischenschritt mit dem nukleophilen Angriff von α-Fläche die β-Fläche freigeben, die für den nukleophilen Angriff durch Akzeptorzucker bereit ist.
Schritt 2: Freisetzung von B1 durch B2; Erforschung der Rolle von Thr-283: Base B2 auf der Oberfläche von Donorzucker würde einen nukleophilen Angriff auf den anomeren Kohlenstoff im Reaktionszentrum durchführen und B1 freisetzen. Unsere Strukturstudien zeigen konservierte Gln-295 und Thr-283 auf diesem Gesicht. Die UDP-Freisetzung kann zu Konformationsänderungen führen und einen dieser Reste in die Nähe von Donorzucker für die Katalyse bringen. Die Mutation von Gln-295 führt zu einem Aktivitätsverlust von bis zu 90%, aber die Rolle als Base ist nicht bekannt20. Wir untersuchten die Möglichkeit eines konservierten Thr-283, das sich in einer Schleife befindet, um als zweite Basis zu fungieren. Wir mutierten Thr zu Ser mit einer ähnlichen funktionellen OH-Gruppe und zu Ala mit kleiner aliphatischer Seitenkette. Sowohl T283A- als auch T283S-Mutanten zeigen ~ 95% Verlust der HA-Produktion (Abb. 4A). Dieser Rückstand zeigt eine positive Korrelation mit den Bereichen SSE4 und SSE6 und einem räumlich proximalen Bereich zwischen Rückstand 186 und Rückstand 190 (Fig. 5C). Der Rückstand 188 befindet sich, wenn auch nicht konserviert, in der Nähe des angedockten Substrats (Fig. 3). Thr-283 zeigt keine hohe positive Korrelation mit SSE8, das die katalytische Basis hält. Es ist möglich, dass der Rückstand als Stützbasenrückstand während der katalytischen Reaktion wirkt, wobei seine Bewegung mit der räumlich proximalen Substratbindungsregion unabhängig von der Asp-260-Base in SSE8 koordiniert ist. Weitere Experimente wären erforderlich, um seine Rolle als Basis zu untermauern. Insgesamt hebt die Studie einen weiteren funktionskritischen Rückstand hervor, der bisher nicht bekannt war.
Schritt 3: Glykosyltransferreaktion: Sobald B1 freigesetzt ist, wird die β-Seite des anomeren Kohlenstoffs des polymeren Zuckers für die Reaktion freigegeben. Die Deprotonierung von Substrat-UDP auf derselben Fläche durch eine dritte Base würde eine nukleophile Gruppe erzeugen. Dieser Schritt könnte durch B1 oder eine andere Basis B3 initiiert werden. Asp-259 ist neben B1 ein hochkonservierter Rückstand in der Nähe von Substrat-UDP und könnte als B3 fungieren. B1/B3 ist jedoch näher an dem polymeren Zucker (Donor), wie in Schritt 1 diskutiert. Um die Deprotonierung zu initiieren, muss sich B1 in der Nähe des Akzeptorzuckers befinden. Dies könnte durch Exterieuränderungen bei SSE8 erreicht werden, die von SSE7 unterstützt werden. Die äquivalente Helix in der Cellulosesynthase hält die katalytische Base und unterliegt koordinierten Konformationsübergängen für die Glykosyltransferasereaktion und -translokation. Ein nukleophiler Angriff des Akzeptorzuckers auf den anomeren Kohlenstoff des Donorzuckers würde eine glykosidische Bindung und Freisetzung der Base B2 erzeugen.