- 3-D características Estruturais da SeHAS
- elementos Subestruturais (SSE) na classe I tem
- Lys-139 é dispensável em SeHAS e tem um papel na ligação de substrato
- o SSE5 liga-se ao polímero e influencia a produção de HA
- Gln-248 (SSE7) is critical with a plausible role in conformation transition
- SSEs exhibit coordinated motion
- Redução de final de polímero de alongamento em SeHAS, um plausível mecanismo em três fases
- a reação de Glicosiltransferase provavelmente ocorre em vários passos
- a reação de três etapas da glicosiltransferase proposta
3-D características Estruturais da SeHAS
modelo estrutural da SeHAS sequência foi gerada usando RaptorX webserver26. O modelo foi obtido com modelo de celulose sintase (PDB: 4P00).The template enzyme shares a high functional similarity and a low sequence similarity (~15%) with SeHAS25. Apesar da fraca similaridade de sequência com o modelo, o modelo obtido é de alta qualidade, conforme indicado pelo valor global (P: 10-8) e absoluto (pontuação GDT: 52) medidas de qualidade 26. A avaliação da qualidade estéreo-química do modelo estrutural indica que 98,5% dos resíduos residem na região permitida / parcialmente permitida da parcela de Ramachandran.
a Figura 1 mostra o modelo estrutural da SeHAS. O modelo estrutural da HAS mostra que a cadeia única dobra em três componentes: (i) um domínio funcional da glicosiltransferase, (ii) quatro hélices transmembranares (TM1-TM4) e (iii) três hélices anfipáticas (AP1-AP3). O domínio da glicosiltransferase adota a dobra GT-A formada por uma chapa β mista de 7 cadeias rodeada por hélices α Na arquitetura β/α. As hélices transmembranares (TM1-TM4) formam um feixe de quatro hélices e criam um poro para translocação de polímeros. 11 C-resíduos terminais de SeHAS são previstos para ser desordenados e não mostrados na Fig. 1. A natureza oligomérica do SeHAS ainda está sendo investigada. Até 2018, SeHAS foi caracterizada a funcionar em sua forma monomérica 9. Relatórios recentes indicam que a enzima SeHAS funciona como um homodimer27. O âmbito do presente trabalho está limitado à avaliação das características do protómero.

modelo Estrutural e características da SeHAS. SSE: Subestrutural element, AP: Amphipathic helix, TM: Trans-membrane helix.
O 3-D modelo estrutural da SeHAS é coerente com o anteriormente determinada topologia de TEM em Streptococcus pyogenes obtida através de fusão, de rotulagem e de protease de acessibilidade experiments12,16,19, com uma pequena diferença no número de amphipathic hélices. Propomos a presença de três hélices anfipáticas em vez de dois hélices anfipáticas previamente relatados com base em avaliação comparativa com a estrutura da celulose sintase. Os resíduos de SeHAS correspondentes à hélice anfipática AP2 não foram sondados especificamente para a sua localização celular 16. Como discutido mais tarde neste manuscrito, esta hélice contém resíduos de importância funcional.
o modelo estrutural explica os resultados da inibição da N-etilmaleimida (NEM) no SeHAS19. O NEM reage com grupos tiol e é, portanto, utilizado para sondar o papel dos resíduos de cisteína nas proteínas. A SeHAS tem quatro resíduos de Cys: Cys-226, Cys-262 e Cys-281 e Cys-367. Os três primeiros resíduos de cisteína estão localizados no citosol e são, portanto, acessíveis ao NEM levando à inibição. Cys-367, no entanto, está localizado em helix transmembranar e é inacessível a NEM. Por conseguinte, não foi notificada inibição relativamente a este resíduo. Na presença de substrato, o NEM se liga apenas ao Cys-281. Os nossos estudos estruturais (descritos mais tarde) indicam que o Cys-226 e o Cys-262 estão localizados na proximidade imediata do local de ligação ao substrato UDP, pelo que a presença de substrato bloquearia o acesso do NEM a estes resíduos. O Cys-281 encontra-se afastado do local de ligação à UDP e a presença de substrato não bloqueia este local devido à inibição da NEM.
elementos Subestruturais (SSE) na classe I tem
há pouca informação sobre as máquinas funcionais específicas da classe I. Na ausência de estrutura 3-D, não se conhece um papel funcional dos locais estudados experimentalmente. Assim, para obter um entendimento sobre os componentes funcionais em SeHAS e sua disposição relativa em 3-D, identificamos regiões contíguas curtas com características de seqüência evolutivamente conservadas chamadas elementos sub-estruturais (SSE). Comparámos 81 sequências de classe I obtidas através de rigorosos critérios de selecção elaborados na secção de métodos. A classe I tem enzimas diferentes no número de hélices transmembranas. Na ausência de informação estrutural, o alinhamento nesta região é de má qualidade. Assim, a comparação de sequências é limitada à região citosólica para evitar locais com correspondência ambígua resíduo-resíduo. O alinhamento das sequências de classe I do HAS é fornecido como figo suplementar. S1, criado com Jalview. Calcula-se uma pontuação de conservação para cada correspondência resíduo-resíduo em relação à sequência SeHAS. Um trecho contíguo com pontuação média > = 70 e pelo menos 2 locais com pontuação >=80 é definido como elemento sub-estrutural (SSE). Utilizando estes critérios, identificamos 9 elementos subestruturais, rotulados como SSE1-SSE9, de potencial importância estrutural / funcional em HAS(Fig. 2). Estrutura secundária para a maioria das SSEs mapeia loops exceto SSE5, SSE8 e SSE9 que ocorrem em hélices. Estes elementos também estão marcados na Fig. 1. A tabela 1 resume os detalhes da sequência, bem como o papel estrutural e funcional da ESE.

uma parcela de pontuação de conservação em relação ao número de sequência do SeHAS. SSE indicado no topo. A projecção da estrutura secundária da sequência é indicada na parte inferior. Os fios são marcados como setas e hélices representadas como retângulos. Rectângulos cheios correspondem a hélices anfípticas. Consulte o texto para mais detalhes.
nossos relatórios de estudo conservaram SSS: SSE5 e SSE7 específicos A HAS. Mutações estudadas até à data, correspondendo a resíduos Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, têm mostrado a influência da atividade. As mutações correspondentes aos resíduos Lys-48, Glu-327, Lys-414, Lys-415 influenciam a taxa de reacção e/ou o peso molecular do POLIMERO18,19,20,21,23. A maioria destes locais de mutação mapeiam-se para SSE1-4, 6, 8 e 9 (Tabela 1).Outros sites não são uma característica conservada da classe I tem família. Bi et al. (2015) analisou diversas glicosiltransferases processivas e discutiu a presença de três resíduos de Asp variavelmente espaçados no domínio da glicosiltransferase, que são cruciais para a actividade25. These include, Asp from SSE1 in nucleotide binding, Asp of SSE2 in binding to metal, Asp in SSE8 with a probable role as base. Além disso, um papel provável na ligação de polímeros é sugerido para resíduos de SSE9. Weigel (2015) propôs oito Asp/Glu contendo Tri-péptidos como potenciais regiões envolvidas na adição de açúcar UDP12. A fim de elucidar o papel do SSE e identificar regiões vinculadas ao UDP-Sugar, realizamos simulações de acoplagem.
HAS enzyme is expected to have at least two binding sites, one for UDP-sugar substrates and the other for polymeric sugar to catalise a glycosidic bond formation12. Para identificar os locais de ligação na estrutura enzimática, realizámos estudos de acoplamento de substratos de UDP-açúcar: UDP-N-acetilglucosamina e ácido UDP-glucurónico. A região de ligação dos substratos UDP é avaliada através de uma grelha com o seu centro no domínio da glicosiltransferase, tal como definido nos métodos.As simulações de acoplamento são conduzidas separadamente para a UDP-N-acetilglucosamina e ácido UDP-glucurónico. São selecionados conformadores de baixa energia (melhor que 5 kcal/mol). A figura 3A mostra a frequência de contactos de vários locais com conformadores energeticamente favoráveis em diferentes circuitos de simulação. São apresentados resíduos polares com uma frequência de, pelo menos, 10% para qualquer um dos dois substratos. A observação notável da figura é que os locais de ligação para os dois substratos de açúcar se sobrepõem.

(A) A Frequência de ligante contactar resíduos para energeticamente favorável conformers de UDP-N Acetylglucosamine (UDP-GlcNAc) e UDP – D ácido glucurônico (UDP-GlcA). A frequência é plotada no eixo X e nos locais no eixo Y. B) papel do SSE1–4, SSE8 e SSE9 na ligação do substrato de açúcar UDP. C) papel do SSE6 na ligação ligando. D) papel das EET na ligação aos polímeros. E) papel da SSE7. I) Ciclo SSE7 na hialuronan sintase, II) Ciclo equivalente na celulose sintase, III) ciclo equivalente na glicosiltransferase não processiva. F) A Energia minimizada tem uma estrutura que mostra a UDP-N-acetilglucosamina e o dissacárido do ácido glucurónico e das moeidades de N-acetilglucosamina.
o papel dos resíduos de contacto foi avaliado investigando a ligação com o conformador biologicamente mais favorável. A seleção do conformador é guiada pela proximidade do anel nucleotídeo da UDP à evolução conservada SSE1 conhecida por estar envolvida na ligação nucleotídica. Os conformadores selecionados no bolso de ligação são mostrados na figura. 3B. SSE1-SSE4, SSE6, SSE8 e SSE9 estão envolvidos na ligação do substrato (Fig. 3B). SSE1, SSE2 e SSE4 estabilizam em grande parte a parte uridina dos substratos enquanto SSE3, SSE8 e SSE9 interagem com o anel de açúcar. A ligação inicial do anel UDP do substrato com a enzima pode ser facilitada por (i) cadeia lateral de Asp-103 conservada do SSE2 (azul, Fig. 3B) através de ligações de hidrogênio com grupos polares de nucleótido e (ii) por anel aromático de Tyr-74 (verde, Fig. 3B) a partir de interacções SSE1 a π-π Com o anel uridina da UDP. Corrente lateral do Glu-76 (verde, Fig. 3B) a partir de SSE1 forma ligações de hidrogênio com grupos polares de açúcar ribose de UDP. O resíduo Asp-161 da SSE4 estabiliza o grupo OH do anel ribose, enquanto Asp-159 estabiliza o íon metálico. Gln-295 e Arg-298 (azul) do SSE9 podem interagir e estabilizar o grupo pirofosfato do nucleótido UDP. Ne atom of Trp-299 is in H-bonding distance to the sugar substrate and likely helps in orienting the substrate. Asp-260 é topologicamente equivalente à base catalítica da celulose sintase25. SSE8 detém Asp-260. Sequencialmente próximo a este resíduo estão Asp-259 e Arg-261 que interagem com os grupos polares do anel de açúcar (verde). O resíduo Arg-140, próximo a Lys-139, é parcialmente conservado e substituído apenas por Lys em homólogos de SeHAS. Este resíduo está próximo da extremidade N-terminal da helix holding SSE8 (verde). Esta extremidade contém resíduos de Asp carregados negativamente que podem ser neutralizados por Arg-140.
resíduos de SSE6 (Fig. 3C) criar um andaime para apoiar ligandos no local de ligação. O laço é estrategicamente colocado e forma a base do bolso de ligação. The loop also sits close to catalytic base (SSE8) and the bound polymeric sugar (discussed later). Como discutido acima, experimentos usando N-ethlimaleimida colocam o Cys-226 conservado deste elemento perto UDP-sugar binding site19. Isto está provavelmente envolvido na manutenção do pKa do microambiente no local ativo. Embora não seja essencial para a atividade, a mutação deste resíduo para Ala é mostrado para influenciar a atividade em SeHAS19, 28. A cadeia lateral de Ser-227 está provavelmente envolvida na estabilização da conformação do laço através de interações com a cadeia principal. Gly-228 E Pro-229 fornecem a flexibilidade e rigidez necessárias para a conformação da cadeia principal, respectivamente (Fig. 3C).
Lys-139 é dispensável em SeHAS e tem um papel na ligação de substrato
as avaliações de acoplagem sugerem um papel de Lys-139 na ligação de ligantes. Estudos anteriores relataram um papel regulatório para este resíduo em formas de HA em mamíferos. No rato, uma mutação para Arg resulta em uma atividade completa loss24. Na ausência de quaisquer estudos de mutação no SeHAS, para elucidar ainda mais o seu papel, realizámos estudos de mutação no Lys-139. Os detalhes sobre a configuração experimental e o ensaio são descritos nos métodos. Os resultados experimentais e o mapa vetorial pMBAD utilizado para o estudo são apresentados na Fig. 4A, B, respectivamente. Alterámos o Lys-139 para o Arg (K139R) com o objectivo de conservar a carga nessa posição. A mutação não levou à perda total de actividade, mas teve um impacto. Apenas 34% da actividade (produção de HA) foi mantida em comparação com o controlo, o que reitera um papel funcional significativo deste resíduo (Fig. 4A). Para sondar ainda mais a interação com base na carga entre este resíduo e substrato, nós alteramos positivamente o Lys-139 para o Asp carregado negativamente (K139D). A carga negativa no local conduz à retenção de 82% de actividade (produção de HA) em comparação com o controlo. Esta análise sugere um papel para este resíduo na estabilização dos grupos polares do substrato. A seleção de substituições ilustra ainda que grupos positivos e negativos são acomodados no local. Os nossos estudos mostram que este resíduo influencia directamente a actividade da sintetase em SeHAS. As mutações neste local diminuem a função da sintetase para níveis consideráveis.

estudos de mutação em SeHAS. A) actividade relativa dos mutantes da SeHAS realizada neste estudo. Os experimentos foram realizados em triplicados e o erro padrão para o título de HA foi de ±0,01 a ±0,05. B) construção do vector pMBAD. genes hasA e hasB do Streptococcus equi subsp. zooepidemicus foram clonados sequencialmente. Em estudos de mutação, a hasA wildtype foi substituída por mutantes correspondentes.
o SSE5 liga-se ao polímero e influencia a produção de HA
a cavidade acima da região de ligação do substrato UDP formada por hélices anfipáticas é avaliada para a ligação da unidade de polímero. O estudo de ligação ao polímero limita-se ao dissacárido terminal envolvido na formação de ligações glicosídicas. Foram efectuados estudos de acoplagem com uma unidade dissacarídica HA constituída por uma N-acetilglucosamina β 1-4 ligada e ácido D-glucurónico no domínio da glicosiltransferase. Foram seleccionados conformadores energeticamente favoráveis. A figura 3D mostra uma unidade de dissacarídeo HA acoplada perto do bolso de ligação. SSE5, SSE8 e SSE9 estão envolvidos na ligação (Fig. 3D). O resíduo Asp-260 da SSE8 está na distância de ligação H ao grupo OH terminal do polímero e é indicado por uma linha tracejada na Fig. 3D. Arg-261 da SSE8 fica perto do polímero e pode interagir com os grupos OH polar do açúcar. O resíduo Trp-299 da SSE9 forma interacções CH-π Com o açúcar terminal.Este é o primeiro relatório que, tanto quanto sabemos, sugere o envolvimento funcional dos resíduos da SSE5. Os principais resíduos em SSE5 envolvidos na ligação ao polímero são Arg-205, Tyr-206, Phe-210 e Arg-214. Arg-205 está muito próximo do dissacarídeo acoplado e envolvido em interações com os grupos polares negativamente carregados da metade do açúcar. Tyr-206 ou fenilalanina em homólogos de SeHAS é visto para estabilizar o resíduo Arg-205 através de interações cation-π. Arg-214 ou Lys em sequências homólogas está próximo do polímero e próximo de Phe-210 parcialmente conservado com o qual forma interações cation-π. Desconhece-se a consequência da mutação dos resíduos da SSE5. Aqui, nós sondamos a consequência da mutação Tyr-206 E Arg-214 em função através de mutagénese no local. Os nossos resultados experimentais mostram que a interrupção das interacções cation-π através da mutação da tirosina aromática para a alanina (Y206A) resulta em 99% de perda de actividade de HAS (produção de HA) (Fig. 4A). A perda desta interacção pode ter influenciado indirectamente a ligação do polímero através do adjacente Arg-205. Do mesmo modo, a mutação do resíduo básico da arginina em 214 para a alanina (R214A) leva à perda completa da função (Fig. 4A). Curiosamente, a introdução de carga negativa (R214E) leva a 93% de perda de função (Fig. 4A). Estes resultados interagem a necessidade de uma carga líquida positiva neste local, a fim de facilitar a ligação e translocação de polímeros. Estas mutações indicam a interdependência das actividades de ligação/translocação de polímeros e de glicosiltransferase.Além disso, a enzima complexada com os dois ligantes (UDP-açúcar e dissacarídeo) foi minimizada com a utilização de campos de força âmbar. A figura 3F mostra a enzima ligada à UDP-N-acetilglucosamina e dissacárido formados por ácido glucurónico ligado e N-acetilglucosamina com ácido glucurónico na extremidade polimérica. Os detalhes sobre o protocolo de minimização são descritos em métodos.
Gln-248 (SSE7) is critical with a plausible role in conformation transition
Gln-248 is a conserved residue in SSE7, a long loop away from binding site. O laço equivalente em ambos os homólogos processivos e não processivos é sequencialmente diferente e mostra conformações distintas nas formas enzimáticas ligadas ao substrato e não ligadas (Fig. 3E (ii)) 29,30,31 e Fig. 3E (iii)β 1-4 galactosiltransferase, código PDB: 2FYD e 2FY7)32. O laço em SeHAS é susceptível de facilitar o posicionamento da SSE8 para catálise. O resíduo Gln-248 está longe do bolso de ligação; o papel exato deste resíduo não poderia ser previsto com base nestes estudos in-silico. Estudos internos de mutação mostram que este resíduo é importante. A substituição do resíduo por Ala resulta numa perda quase completa da produção de HA (Fig. 4A).O papel deste resíduo é ainda sondado através de estudos dinâmicos grosseiros e é discutido em uma seção posterior.
SSEs exhibit coordinated motion
The current paradigm is structure-codes-dynamics-codes-function33,34,35. Tem sido cada vez mais reconhecido que flutuações aleatórias de átomos em seu estado nativo ocultam movimento coordenado que predispõe a proteína para mudanças funcionalmente relevantes na estrutura. Estes movimentos podem ser capturados por modos de baixa frequência em modelagem de rede elástica. Estes modos são conhecidos por serem insensíveis aos detalhes estruturais e energéticos. Por isso, usamos a modelagem de rede anisotrópica (ANM), uma abordagem baseada em ENM para capturar a imagem global da dinâmica codificada por estrutura 3-D de SeHAS. Usámos o ProDy36 para cálculos ANM. Na secção “métodos” são elaborados mais pormenores. Movimento coordenado é representado como valores de coeficiente de correlação entre nós da rede ANM. Os valores médios do coeficiente de correlação foram calculados com base nos primeiros 50 modos. A figura 5A mostra o mapa de correlação da SeHAS. Os valores do coeficiente de correlação positivo são indicativos de átomos que se movem na mesma direcção. Aglomerado de resíduos espacialmente proximais com alto coeficiente de correlação são considerados estruturalmente e funcionalmente importantes. Os pares de resíduos com grandes valores positivos correspondem a elementos subestruturais. Além disso, a correlação entre pares de resíduos estende-se a regiões através de diferentes ese. SSE1-4 formam um subdomínio de interação estreita (retângulo preto). Similarmente, o SSE5-9 forma um subdomínio interagindo coordenado (retângulo cinzento). Os dois subdomínios são separados por uma região mal correlacionada. Os movimentos globais intrínsecos ilustram a coordenação funcional necessária em relação à ligação do substrato numa das extremidades, pela SSE1-4 e pela ligação do polímero na outra extremidade (SSE5-9).

Assessment of global dynamics in SeHAS. A) valores médios do coeficiente de correlação para o SeHAS entre pares de resíduos. Valores médios do coeficiente de correlação para Gln-248 (B) e Thr-283 (C) com outros resíduos do SeHAS.
exploramos a dinâmica do SeHAS em relação ao resíduo Gln-248. Figo. 5B mostra a distribuição dos valores do coeficiente de correlação em relação a outros resíduos em SeHAS. O Gln-248 apresenta grandes valores positivos com SSE8, 9 e SSE3 que contêm resíduos de ligação catalítica e substrato. Um movimento coordenado com estas ese avaliadas através da ANM ilustra ainda o seu papel na dinâmica de conformação funcionalmente relevante.
o estudo ANM é alargado para avaliar o efeito da mutação nos valores do coeficiente de correlação. Para cada um dos mutantes, obtém-se um modelo estrutural utilizando o RaptorX26. Os mutantes mostram alta sobreposição estrutural com um RMSD médio de cerca de 1 Å em todos os átomos com respeito à estrutura de proteína WT. Para cada estrutura mutante, calculam-se os valores do coeficiente de correlação relativos aos resíduos mutantes e comparados com o WT. As parcelas são mostradas na Fig. S2. As mutações no local 214, 248 e 283 apresentam uma diferença substancial nos valores nas regiões SSE.
Redução de final de polímero de alongamento em SeHAS, um plausível mecanismo em três fases
Em prototypic membros da glycosyltransferase família GT-2, tais como a celulose sintase, o polímero biossíntese ocorre a partir da não-redução final do crescente polymer25,31. Nesses sistemas, os substratos UDP actuam como dadores transferindo o açúcar para o açúcar polimérico que actua como aceitador24. Uma ligação β entre os açúcares é criada a partir de precursores α-ligados açúcar-UDP através de uma reação de substituição SN2 de deslocamento direto. Nesta reação, um passo de desprotonação por uma base catalítica functionaliza o aceitador24. Ataque nucleofílico por este grupo de açúcar aceitador para o doador através de um único estado de transição tipo ião oxocarbênio resulta em reação de transferência de glicosilo com a libertação de UDP do açúcar doador e inversão líquida de estereoquímica em carbono anomérico. Este mecanismo é ilustrado na Fig. 6A. SeHAS difere deste protótipo. Sabe-se que HA elongates da redução do end12. Isto implica: i) a UDP é libertada da extremidade do polímero e não dos substratos da UDP durante a catálise e ii) A reversão do dador e dos aceitadores com a HA-UDP actuando como substrato doador e UDP-açúcar como aceitador. Com base na paisagem de ligação ligando e obtido conhecimento sobre arquitetura de site ativo, discutimos a participação de ligandos como doador e aceitador e propor um mecanismo catalítico para transferência glicosil em SeHAS (ver Fig. 6B).
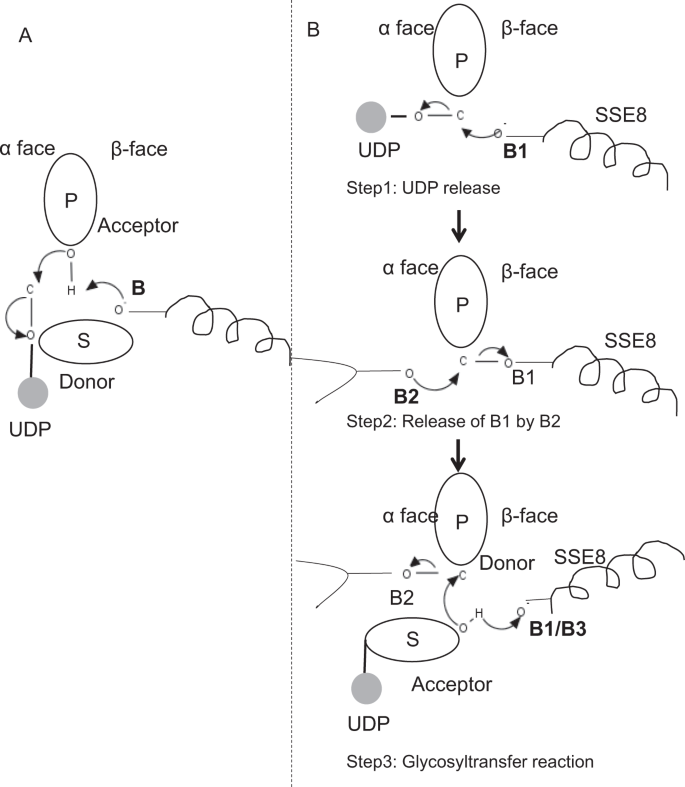
Proposta de mecanismo molecular em SeHAS. A) mecanismo numa glicosiltransferase prototípica com química de inversão. B)o mecanismo proposto na categoria I. P: açúcar polimérico, s: açúcar substrato.UDP é indicado como um círculo. B1, B2 e B3 são as bases catalíticas que participam do mecanismo de reação.
a reação de Glicosiltransferase provavelmente ocorre em vários passos
como o primeiro passo, exploramos a possibilidade de uma reação de glicosiltransferase única em forma semelhante à celulose sintase. Se a reacção da glicosiltransferase ocorrer numa etapa, a enzima em determinado momento necessitaria de manter duas moléculas UDP, uma ligada ao polímero e outra ligada ao substrato que entra. No cenário alternativo multi-etapas, o UDP do polímero é liberado antes da reação catalítica ocorrer. Neste caso, para criar inversão líquida da estereoquímica, a reação ocorreria em uma série de passos ímpares com mecanismo SN2. Para avaliar qual cenário é mais provável, realizamos estudos de ligação UDP através da acoplagem de moléculas UDP no domínio da glicosiltransferase. A avaliação indica uma sobreposição significativa dos locais de ligação UDP e UDP-substrato.O resultado é apresentado na seção suplementar. Um exemplo de conformação energeticamente favorável da UDP, juntamente com as regiões de ligação de substrato e polímero, é mostrado na figura complementar. S3. Embora a avaliação seja baseada no modelo estático, a colocação de duas grandes moléculas de natureza química semelhante em estreita proximidade com necessidades de ambientes fisioquímicos semelhantes é improvável para esta enzima. Especula-se que uma passagem revestida com resíduos positivamente carregados do SSE9 e ião metálico poderia facilitar a libertação UDP do polímero final. O envolvimento do ião metálico na glicosiltransferase para a libertação UDP também é bem documentado24. Uma vez que os dois sites UDP não são mutuamente exclusivos, o segundo cenário de reação multi-etapas parece mais provável.Uma vez que UDP é liberado do polímero, um ataque nucleofílico do grupo OH de substrato–UDP (aceitador) criaria uma ligação glicosídica. Para criar inversão, a libertação UDP e subsequente ataque nucleofílico deve ocorrer a partir de duas faces opostas de açúcar polimérico. Propomos o papel de três catalisadores de base no esquema de reacção global que se encontram nas faces α e β Do Açúcar dador na extremidade do polímero. Estes passos são ilustrados através da Fig. 6B e descrito abaixo.
a reação de três etapas da glicosiltransferase proposta
Step1: libertação UDP: Asp-260 do SSE8 poderia agir como uma base (B1) e iniciar a libertação da molécula UDP do polímero (doador) da face-α. This step would create a covalently bound glycosyl enzyme intermediate shielded on β face with the base B1. Para criar uma inversão esta face do açúcar precisa ser livre para ataque nucleofílico por entrada de açúcar o-H. Assim, um passo intermediário, com o ataque nucleofílico a partir de uma face α liberaria a face β pronta para o ataque nucleofílico por açúcar aceitador.
Step 2: Release of B1 by B2; Exploring the role of Thr-283: Base B2 on α face of door sugar would carry out a nucleophilic attack on the anomeric carbon at the reaction center and release B1. Nossos estudos estruturais mostram o Gln-295 conservado e Thr-283 nesta face. A libertação de UDP pode resultar em alterações de conformação e trazer um destes resíduos na proximidade do açúcar dador para catálise. A mutação do Gln-295 resulta em até 90% de perda de actividade, mas o papel como base não é conhecido. Nós avaliamos a possibilidade de um Thr-283 conservado residindo em um laço para funcionar como a segunda base. Alterámos a Thr para Ser contendo um grupo OH funcional semelhante e para Ala com uma pequena cadeia lateral alifática. Ambos, os mutantes T283A e T283S mostram cerca de 95% de perda de produção de HA (Fig. 4A). Este resíduo apresenta uma correlação positiva com as regiões SSE4 e SSE6 e uma região espacialmente proximal entre o resíduo 186 e o resíduo 190 (Fig. 5C). O resíduo 188, embora não conservado, está na vizinhança de substrato acoplado(Fig. 3). Thr-283 não apresenta elevada correlação positiva com a SSE8 segurando a base catalítica. É possível que o resíduo atue como um resíduo base de suporte durante a reação catalítica com seu movimento coordenado com a região de ligação do substrato espacialmente proximal independente da Base Asp-260 em SSE8. Seriam necessárias novas experiências para fundamentar o seu papel de base. Em geral, o estudo destaca mais um resíduo funcionalmente crítico, não conhecido anteriormente.
Step 3: Glycosyl transfer reaction: Once B1 is released, β face of the anomeric carbon of the polymeric sugar is unblocked for the reaction. A desprotonação do substrato-UDP na mesma face por uma terceira base criaria um grupo nucleofílico. Este passo pode ser iniciado por B1 ou outra base B3. Asp-259, próximo A B1 é um resíduo altamente conservado na proximidade do substrato-UDP e poderia atuar como B3. No entanto, B1 / B3 está mais perto do açúcar polimérico (doador), como discutido na Step1. Para iniciar a desprotonação, A B1 tem de estar perto do açúcar aceite. Ela poderia ser alcançada através de alterações de conformação em SSE8, assistida por SSE7. A hélice equivalente na celulose sintase possui base catalítica, e sofre transições conformacionais Coordenadas para reação de glicosiltransferase e translocação. Um ataque nucleofílico do açúcar aceitador sobre o carbono anomérico do açúcar doador criaria uma ligação glicosídica e libertação da Base B2.