- Caractéristiques structurelles 3D des SeHAS
- Éléments de sous-structure (ESS) de la classe I A
- Les sites de liaison des substrats UDP se chevauchent
- Lys-139 est dispensable dans les SeHAS et joue un rôle dans la liaison au substrat
- SSE5 se lie au polymère et influence la production d’HA
- Gln-248 (SSE7) est critique et joue un rôle plausible dans la transition de conformation
- Les SSE présentent un mouvement coordonné
- Réduction de l’allongement du polymère d’extrémité dans les SEHA, un mécanisme plausible en trois étapes
- La réaction de la glycosyltransférase se produit probablement en plusieurs étapes
- Réaction de glycosyltransférase proposée en trois étapes
Caractéristiques structurelles 3D des SeHAS
Un modèle structurel de la séquence SeHAS a été généré à l’aide de RaptorX webserver26. Le modèle a été obtenu avec un gabarit de cellulose synthase (PDB : 4P00).L’enzyme modèle partage une similitude fonctionnelle élevée et une similitude de séquence faible (~15%) avec SeHAS25. Malgré la faible similitude de séquence avec le modèle, le modèle obtenu est de haute qualité, comme l’indiquent les mesures de qualité globales (valeur P : 10-8) et absolues (score GDT: 52)26. L’évaluation de la qualité stéréochimique du modèle structurel indique que 98,5% des résidus résident dans la région autorisée/partiellement autorisée de la parcelle Ramachandran.
La figure 1 montre le modèle structurel des SeHAS. Le modèle structurel A montre que la chaîne unique se plie en trois composants: (i) un domaine glycosyltransférase fonctionnel, (ii) quatre hélices transmembranaires (TM1-TM4) et (iii) trois hélices amphipathiques (AP1-AP3). Le domaine glycosyltransférase adopte un pli GT-A formé d’une feuille β mixte à 7 brins entourée d’hélices α en architecture β/α. Les hélices transmembranaires (TM1-TM4) forment un faisceau de quatre hélices et créent un pore pour la translocation du polymère. 11 Les résidus C-terminaux des SeHAS sont prédits comme étant désordonnés et non représentés sur la Fig. 1. La nature oligomérique des SeHAS est toujours à l’étude. Jusqu’en 2018, SeHAS était caractérisé pour fonctionner sous sa forme monomérique9. Des rapports récents indiquent que l’enzyme SeHAS fonctionne comme un homodimère 27. La portée du présent travail se limite à l’évaluation des caractéristiques du protomère.

Modèle structurel et caractéristiques des SeHAS. SSE : Élément sous-structural, AP : Hélice amphipathique, TM : Hélice trans-membranaire.
Le modèle structural 3D des SEHAS est cohérent avec la topologie précédemment déterminée des HAS chez Streptococcus pyogenes dérivée à l’aide d’expériences de fusion, de marquage et d’accessibilité aux protéases12,16,19 avec une légère différence dans le nombre d’hélices amphipathiques. Nous proposons la présence de trois hélices amphipathiques au lieu de deux hélices amphipathiques précédemment rapportées sur la base d’une évaluation comparative avec la structure de la cellulose synthase. Les résidus SeHAS correspondant à l’hélice amphipathique AP2 n’ont pas été sondés spécifiquement pour leur localisation cellulaire 16. Comme discuté plus loin dans ce manuscrit, cette hélice contient des résidus d’importance fonctionnelle.
Le modèle structurel explique les résultats de l’inhibition du N-éthylmaléimide (NEM) dans SeHAS19. Le NEM réagit avec les groupes thiols et est donc utilisé pour sonder le rôle des résidus de cystéine dans les protéines. SeHAS a quatre résidus Cys : Cys-226, Cys-262 et Cys-281 et Cys-367. Les trois premiers résidus de cystéine sont situés dans le cytosol et sont donc accessibles au NEM entraînant une inhibition. Cys-367, cependant, est situé dans une hélice transmembranaire et est inaccessible au NEM. Par conséquent, aucune inhibition n’est rapportée pour ce résidu. En présence de substrat, le NEM ne se lie qu’au Cys-281. Nos études structurales (décrites plus loin) indiquent que les Cys-226 et Cys-262 sont situées à proximité du site de liaison du substrat UDP et que la présence de substrat bloquerait ainsi l’accès des NEM à ces résidus. Cys-281 se trouve à l’écart du site de liaison UDP et la présence de substrat ne bloque pas ce site de l’inhibition de la NEM.
Éléments de sous-structure (ESS) de la classe I A
Il existe peu d’informations sur les machines fonctionnelles spécifiques à la classe I A. En l’absence de structure 3D, le rôle fonctionnel des sites étudiés expérimentalement n’est pas connu. Par conséquent, pour mieux comprendre les composants fonctionnels des SEHA et leur disposition relative en 3D, nous identifions de courtes régions contiguës avec des caractéristiques de séquence conservées de manière évolutive appelées éléments sous-structurels (ESS). Nous avons comparé 81 séquences de la classe I obtenues grâce à des critères de sélection rigoureux élaborés dans la section Méthodes. La classe I A des enzymes qui diffèrent par le nombre d’hélices transmembranaires. En l’absence d’informations structurelles, l’alignement dans cette région est de mauvaise qualité. Par conséquent, la comparaison des séquences est limitée à la région cytosolique pour éviter les sites présentant une correspondance résidu-résidu ambiguë. L’alignement des séquences HAS de classe I est fourni en complément Fig. S1, créé avec Jalview. Un score de conservation est calculé pour chaque correspondance résidu-résidu par rapport à la séquence SeHAS. Un tronçon contigu avec un score moyen > = 70 et au moins 2 sites avec un score > = 80 est défini comme un élément sous-structurel (ESS). En utilisant ce critère, nous identifions 9 éléments sous-structurels, étiquetés SSE1-SSE9, d’importance structurelle/fonctionnelle potentielle dans le HAS (Fig. 2). La structure secondaire de la plupart des SSE correspond à des boucles à l’exception de SSE5, SSE8 et SSE9 qui se produisent dans des hélices. Ces éléments sont également marqués à la Fig. 1. Le tableau 1 résume les détails de la séquence ainsi que le rôle structurel et fonctionnel de l’ESS.

Une parcelle de score de conservation par rapport au numéro de séquence SeHAS. SSE indiqué en haut. La projection de structure secondaire de la séquence est indiquée en bas. Les brins sont marqués comme des flèches et des hélices représentées sous forme de rectangles. Les rectangles remplis correspondent à des hélices amphipathiques. Reportez-vous au texte pour plus de détails.
Notre étude rapporte des SSE conservés : SSE5 et SSE7 spécifiques aux A. Mutations étudiées jusqu’à présent, correspondant aux résidus Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, ont montré une influence sur l’activité. Des mutations correspondent aux résidus Lys-48, Glu-327, Lys-414, Lys-415 influencent la vitesse de réaction et/ou le poids moléculaire du polymère ha18, 19, 20, 21, 23. La plupart de ces sites de mutation correspondent à SSE1-4, 6, 8 et 9 (tableau 1).Les autres sites ne sont pas une caractéristique conservée de la classe I A family. Bi et coll. (2015) ont analysé diverses glycosyltransférases processives et discuté de la présence de trois résidus Asp espacés de manière variable dans le domaine des glycosyltransférases, qui sont cruciaux pour l’activité25. Ceux-ci incluent, l’Asp de SSE1 dans la liaison nucléotidique, l’Asp de SSE2 dans la liaison au métal, l’Asp dans SSE8 avec un rôle probable de base. De plus, un rôle probable dans la liaison des polymères est suggéré pour les résidus de SSE9. Weigel (2015) a proposé huit tri-peptides contenant de l’Asp/Glu comme régions potentielles impliquées dans la liaison UDP-sucrier12. Afin d’élucider le rôle de l’ESS et d’identifier les régions se liant aux sucres UDP, nous avons réalisé des simulations d’amarrage.
L’enzyme HAS devrait avoir au moins deux sites de liaison, l’un pour les substrats UDP-sucre et l’autre pour le sucre polymère pour catalyser une formation de liaison glycosidique12. Pour identifier les sites de liaison dans la structure enzymatique, nous avons mené des études d’amarrage de substrats UDP-sucre: UDP-N-acétylglucosamine et acide UDP-glucuronique. La région de liaison des substrats UDP est évaluée à travers une grille dont le centre est dans le domaine de la glycosyltransférase tel que défini dans les Méthodes.
Les sites de liaison des substrats UDP se chevauchent
Des simulations d’amarrage sont effectuées séparément pour l’UDP-N-acétylglucosamine et l’acide UDP-glucuronique. Des conformères à faible énergie (meilleurs que 5 kcal/mol) sont sélectionnés. La figure 3A montre la fréquence des contacts de divers sites avec des conformères énergétiquement favorables à travers différentes séries de simulation. Des résidus polaires avec une fréquence d’au moins 10% sur l’un des deux substrats sont représentés. L’observation notable de la figure est que les sites de liaison des deux substrats de sucre se chevauchent.

( A) Fréquence des résidus de contact avec les ligands pour les conformères énergétiquement favorables de l’Acétylglucosamine UDP-N (UDP-GlcNAc) et de l’acide glucuronique UDP-D (UDP-GlcA). La fréquence est tracée sur l’axe des abscisses et les sites sur l’axe des Ordonnées. (B) Rôle de SSE1-4, SSE8 et SSE9 dans la liaison du substrat UDP-sucre. (C) Rôle de SSE6 dans la liaison des ligands. D) Rôle des SSE dans la liaison des polymères. E) Rôle de l’ESS7. (i) Boucle SSE7 dans la hyaluronane synthase, (ii) Boucle équivalente dans la cellulose synthase, (iii) Boucle équivalente dans la glycosyltransférase non processive. (F) L’énergie minimisée A une structure montrant des moéités d’UDP-N-Acétylglucosamine et de disaccharide d’acide glucuronique et de N-Acétylglucosamine.
Le rôle des résidus en contact a été évalué en étudiant la liaison avec le conformère biologiquement le plus favorable sur le plan énergétique. La sélection du conformère est guidée par la proximité du cycle nucléotidique de l’UDP avec le SSE1 conservé évolutivement connu pour être impliqué dans la liaison nucléotidique. Les conformateurs sélectionnés dans la poche de fixation sont représentés à la Fig. 3B. SSE1-SSE4, SSE6, SSE8 et SSE9 sont impliqués dans la liaison du substrat (Fig. 3B). SSE1, SSE2 et SSE4 stabilisent en grande partie la partie uridine des substrats tandis que SSE3, SSE8 et SSE9 interagissent avec le cycle du sucre. La liaison initiale du cycle UDP du substrat avec l’enzyme pourrait être facilitée par (i) la chaîne latérale de l’Asp-103 conservé de SSE2 (bleu, Fig. 3B) par des liaisons hydrogène avec des groupes polaires de nucléotides et (ii) par le cycle aromatique de Tyr-74 (vert, Fig. 3B) de SSE1 à des interactions π-π avec le cycle uridine de l’UDP. Chaîne latérale de Glu-76 (vert, Fig. 3B) de SSE1 forme des liaisons hydrogène avec des groupes polaires de sucre ribose d’UDP. Le résidu Asp-161 de SSE4 stabilise le groupe OH du cycle ribose, tandis que l’Asp-159 stabilise l’ion métallique. Gln-295 et Arg-298 (bleu) de SSE9 pourraient interagir et stabiliser le groupe pyrophosphate du nucléotide UDP. L’atome NE de Trp-299 est à une distance de liaison en H du substrat de sucre et aide probablement à orienter le substrat. L’Asp-260 est topologiquement équivalente à la base catalytique de la synthèse de cellulosie25. SSE8 contient Asp-260. Séquentiellement proximaux à ce résidu sont Asp-259 et Arg-261 qui interagissent tous deux avec les groupes polaires du cycle de sucre (vert). Le résidu Arg-140, à côté de Lys-139, est partiellement conservé et remplacé uniquement par Lys dans les homologues SeHAS. Ce résidu se trouve à proximité de l’extrémité N-terminale de l’hélice contenant SSE8 (vert). Cette extrémité contient des résidus Asp chargés négativement qui pourraient être neutralisés par Arg-140.
Résidus de SSE6 (Fig. 3C) créer un échafaudage pour soutenir les ligands sur le site de liaison. La boucle est stratégiquement placée et forme la base de la poche de fixation. La boucle est également proche de la base catalytique (SSE8) et du sucre polymère lié (discuté plus loin). Comme indiqué ci-dessus, les expériences utilisant le N-éthlymaléimide placent le Cys-226 conservé de cet élément près du site de liaison UDP-sucre 19. Ceci est probablement impliqué dans le maintien du pKa du microenvironnement au site actif. Bien qu’elle ne soit pas essentielle à l’activité, la mutation de ce résidu en Ala influence l’activité dans SeHAS19,28. La chaîne latérale du Ser-227 est probablement impliquée dans la stabilisation de la conformation de la boucle par des interactions avec la chaîne principale. Gly-228 et Pro-229 fournissent respectivement la flexibilité et la rigidité nécessaires à la conformation de la chaîne principale (Fig. 3C).
Lys-139 est dispensable dans les SeHAS et joue un rôle dans la liaison au substrat
Les évaluations d’amarrage suggèrent un rôle de Lys-139 dans la liaison au ligand. Des études antérieures ont fait état d’un rôle régulateur de ce résidu dans les formes mammaliennes de DA. Chez la souris, une mutation en Arg entraîne une perte complète d’activité24. En l’absence d’études mutationnelles chez SeHAS, afin d’élucider davantage son rôle, nous avons mené des études de mutation de Lys-139. Des détails sur la configuration expérimentale et le test sont décrits dans Méthodes. Les résultats expérimentaux et la carte vectorielle pMBAD utilisée pour l’étude sont présentés à la Fig. 4A, B, respectivement. Nous avons muté Lys-139 en Arg (K139R) dans le but de conserver la charge à cette position. La mutation n’a pas entraîné de perte complète d’activité, mais a eu un impact. Seulement 34% d’activité (production d’HA) ont été retenus par rapport au contrôle qui réitère un rôle fonctionnel important de ce résidu (Fig. 4 BIS). Pour sonder davantage l’interaction basée sur la charge entre ce résidu et le substrat, nous avons muté du Lys-139 chargé positivement en Asp chargé négativement (K139D). Une charge négative sur le site entraîne une rétention d’activité de 82% (production d’HA) par rapport au contrôle. Cette analyse suggère un rôle de ce résidu dans la stabilisation des groupes polaires du substrat. La sélection des substitutions illustre en outre que les groupes chargés de charges positives et négatives sont logés sur le site. Nos études montrent que ce résidu influence directement l’activité de la synthase dans les SEHA. Des mutations à ce site altèrent la fonction de la synthase à des niveaux considérables.

Études de mutation sur les SEHAS. (A) Activité relative des mutants SeHAS menée dans cette étude. Des expériences ont été menées en trois exemplaires et l’erreur type pour le titre HA était comprise entre ±0,01 et ±0,05. B) Construction du vecteur pMBAD. Gènes hasA et hasB de Streptococcus equi subsp. les zooepidemicus ont été clonés séquentiellement. Pour les études mutationnelles, le type sauvage hasA a été remplacé par le ou les mutants correspondants.
SSE5 se lie au polymère et influence la production d’HA
La cavité au-dessus de la région de liaison du substrat UDP formée par des hélices amphipathiques est évaluée pour la liaison de l’unité polymère. L’étude de liaison aux polymères est limitée au disaccharide terminal impliqué dans la formation de liaisons glycosidiques. Des études d’amarrage ont été menées avec une unité disaccharidique HA comprenant une N-acétylglucosamine liée à β 1-4 et de l’acide D-glucuronique dans le domaine de la glycosyltransférase. Des conformères énergétiquement favorables ont été sélectionnées. La figure 3D montre une unité de disaccharide HA amarrée près de la poche de liaison. SSE5, SSE8 et SSE9 sont impliqués dans la liaison (Fig. 3D). Le résidu Asp-260 de SSE8 est en distance de liaison H au groupe OH terminal du polymère et est indiqué par un trait en pointillés sur la Fig. 3D. Arg-261 de SSE8 est proche du polymère et pourrait interagir avec les groupes OH polaires du sucre. Le résidu Trp-299 de SSE9 forme des interactions CH-π avec le sucre terminal.
À notre connaissance, il s’agit du premier rapport faisant l’hypothèse de l’implication fonctionnelle des résidus de SSE5. Les résidus clés de SSE5 impliqués dans la liaison au polymère sont Arg-205, Tyr-206, Phe-210 et Arg-214. Arg-205 est à proximité immédiate du disaccharide amarré et est impliqué dans les interactions avec les groupes polaires chargés négativement de la fraction de sucre. La Tyr-206 ou la phénylalanine dans les homologues SeHAS stabilisent le résidu Arg-205 par des interactions cation-π. Arg-214 ou Lys dans des séquences homologues est à proximité du polymère et proche du Phe-210 partiellement conservé avec lequel il forme des interactions cation-π. La conséquence de la mutation des résidus de SSE5 n’est pas connue. Ici, nous examinons les conséquences de la mutation de Tyr-206 et d’Arg-214 sur la fonction par mutagenèse dirigée sur le site. Nos résultats expérimentaux montrent que la perturbation des interactions cation-π par la mutation de la tyrosine aromatique en alanine (Y206A) entraîne une perte de 99% de l’activité des A (production d’HA) (Fig. 4 BIS). La perte de cette interaction pourrait avoir indirectement influencé la liaison du polymère à travers l’Arg-205 adjacent. De même, la mutation du résidu d’arginine basique en 214 en alanine (R214A) entraîne une perte complète de la fonction (Fig. 4 BIS). Fait intéressant, l’introduction d’une charge négative (R214E) entraîne une perte de fonction de 93% (Fig. 4 BIS). Ces résultats réitèrent la nécessité d’une charge positive nette à ce site afin de faciliter la liaison et la translocation du polymère. Ces mutations indiquent l’interdépendance des activités de liaison/ translocation des polymères et des glycosyltransférases.
De plus, l’enzyme complexée avec les deux ligands (sucre UDP et disaccharide) a été réduite en énergie à l’aide de champs de force AMBRÉS. La figure 3F montre l’enzyme liée à l’UDP-N-acétylglucosamine et au disaccharide formés par l’acide glucuronique lié et la N-acétylglucosamine avec l’acide glucuronique à l’extrémité polymérique. Les détails sur le protocole de minimisation sont décrits dans Méthodes.
Gln-248 (SSE7) est critique et joue un rôle plausible dans la transition de conformation
Gln-248 est un résidu conservé dans SSE7, à une longue boucle du site de liaison. La boucle équivalente chez les homologues processifs et non processifs est séquentiellement différente et montre des conformations distinctes dans les formes enzymatiques liées au substrat et non liées (Fig. 3E(ii)) 29,30,31 et Fig. 3E(iii) β 1-4 galactosyltransférase, code APB: 2FYD et 2FY7) 32. La boucle dans SeHAS est susceptible de faciliter le positionnement de SSE8 pour la catalyse. Le résidu Gln-248 se trouve à l’écart de la poche de liaison; le rôle exact de ce résidu n’a pas pu être prédit sur la base de ces études in silico. Des études de mutation internes montrent que ce résidu est important. Le remplacement du résidu par de l’Ala entraîne une perte quasi totale de la production d’HA (Fig. 4 BIS).Le rôle de ce résidu est examiné plus en détail au moyen d’études dynamiques à grains grossiers et est discuté dans une section ultérieure.
Les SSE présentent un mouvement coordonné
Le paradigme actuel est structure-code – dynamique – code-fonction 33, 34, 35. Il est de plus en plus reconnu que les fluctuations aléatoires des atomes dans leur état natif cachent des mouvements coordonnés qui prédisposent la protéine à des changements de structure pertinents sur le plan fonctionnel. Ces mouvements peuvent être capturés par des modes basse fréquence dans la modélisation de réseau élastique. Ces modes sont connus pour être insensibles aux détails structurels et énergétiques. Par conséquent, nous avons utilisé la modélisation de réseau anisotrope (ANM), une approche basée sur l’ENM pour capturer une image globale de la dynamique codée par la structure 3D des SEHAS. Nous avons utilisé ProDy36 pour les calculs ANM. De plus amples détails sont détaillés dans la section Méthodes. Le mouvement coordonné est représenté par des valeurs de coefficient de corrélation entre les nœuds du réseau ANM. Les valeurs moyennes du coefficient de corrélation ont été calculées sur la base des 50 premiers modes. La figure 5A montre la carte de corrélation pour les SEHAS. Les valeurs de coefficient de corrélation positive indiquent que les atomes se déplacent dans la même direction. Les groupes de résidus spatialement proximaux à coefficient de corrélation élevé sont considérés comme structurellement et fonctionnellement importants. Les paires de résidus à grandes valeurs positives correspondent à des éléments sous-structurels. De plus, la corrélation entre les paires de résidus s’étend à des régions à travers différentes ESS. SSE1-4 forme un sous-domaine en interaction étroite (rectangle noir). De même, SSE5-9 forme un sous-domaine en interaction coordonnée (rectangle gris). Les deux sous-domaines sont séparés par une région mal corrélée. Les mouvements globaux intrinsèques illustrent la coordination fonctionnelle requise par rapport à la liaison du substrat à une extrémité, par SSE1-4 et à la liaison du polymère à l’autre extrémité (SSE5-9).

Évaluation de la dynamique globale dans les SEHAS. A) Valeurs moyennes des coefficients de corrélation pour les SEHA entre paires de résidus. Valeurs moyennes du coefficient de corrélation pour Gln-248(B) et Thr-283(C) avec d’autres résidus SeHAS.
Nous avons exploré plus avant la dynamique des SeHAS par rapport au résidu Gln-248. Figue. 5B montre la distribution des valeurs de coefficient de corrélation par rapport aux autres résidus dans les SEHAS. Le Gln-248 présente de grandes valeurs positives avec SSE8, 9 et SSE3 qui contiennent des résidus catalytiques et de liaison au substrat. Un mouvement coordonné avec ces SSE évalué par ANM illustre davantage son rôle dans la dynamique de conformation fonctionnellement pertinente.
L’étude ANM est étendue pour évaluer l’effet de la mutation sur les valeurs du coefficient de corrélation. Pour chacun des mutants, un modèle structurel est obtenu en utilisant RaptorX26. Les mutants présentent un chevauchement structurel élevé avec un RMSD moyen d’environ 1 Å sur tous les atomes par rapport à la structure de la protéine WT. Pour chaque structure mutante, les valeurs du coefficient de corrélation par rapport au résidu mutant sont calculées et comparées au poids. Les tracés sont représentés à la Fig. S2. Les mutations aux sites 214, 248 et 283 présentent des différences substantielles de valeurs dans les régions de l’ESS.
Réduction de l’allongement du polymère d’extrémité dans les SEHA, un mécanisme plausible en trois étapes
Dans les membres prototypiques de la famille des glycosyltransférases GT-2 tels que la cellulose synthase, la biosynthèse du polymère se produit à partir de l’extrémité non réductrice du polymère en croissance25,31. Dans de tels systèmes, les substrats UDP agissent comme un donneur transférant le sucre au sucre polymère qui agit comme accepteur 24. Une liaison β entre les sucres est créée à partir de précurseurs de sucre-UDP liés à l’α par une réaction de substitution SN2 à déplacement direct. Dans cette réaction, une étape de déprotonation par une base catalytique fonctionnalise l’accepteur 24. L’attaque nucléophile par ce groupe de sucre accepteur sur le donneur via un seul état de transition de type ion oxocarbénium entraîne une réaction de transfert de glycosyle avec libération d’UDP du sucre donneur et inversion nette de la stéréochimie au carbone anomérique. Ce mécanisme est illustré à la Fig. 6A. SeHAS diffère de ce prototype. On sait que HA s’allonge à partir de l’extrémité réductrice 12. Cela implique que (i) l’UDP est libérée de l’extrémité du polymère et non des substrats UDP pendant la catalyse et (ii) l’inversion du donneur et des accepteurs avec l’HA-UDP agissant comme donneur et le substrat UDP-sucre comme accepteur. Sur la base du paysage de la liaison aux ligands et des connaissances acquises sur l’architecture des sites actifs, nous discutons de la participation des ligands en tant que donneurs et accepteurs et proposons un mécanisme catalytique pour le transfert de glycosyle dans les SeHAS (voir Fig. 6B).
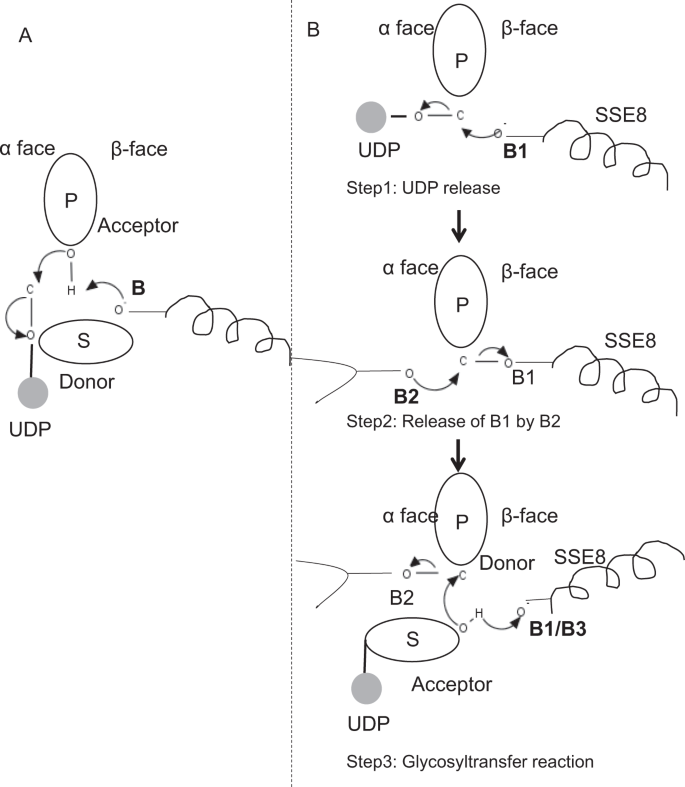
Mécanisme moléculaire proposé dans les SeHAS. (A) Mécanisme dans une glycosyltransférase prototypique avec chimie d’inversion. B) Mécanisme proposé dans la classe I A. P: Sucre polymère, S : Sucre de substrat.UDP est indiqué comme un cercle. B1, B2 et B3 sont les bases catalytiques participant au mécanisme réactionnel.
La réaction de la glycosyltransférase se produit probablement en plusieurs étapes
Dans un premier temps, nous avons exploré la possibilité d’une réaction de la glycosyltransférase en une seule étape de manière similaire à la cellulose synthase. Si la réaction de la glycosyltransférase se produit en une seule étape, l’enzyme à un moment donné devrait contenir deux fractions UDP, l’une attachée au polymère et l’autre attachée au substrat entrant. Dans le scénario alternatif en plusieurs étapes, l’UDP du polymère est libéré avant que la réaction catalytique ne se produise. Dans ce cas, pour créer une inversion nette de la stéréochimie, la réaction se produirait en une série d’étapes impaires avec le mécanisme SN2. Pour évaluer quel scénario est le plus probable, nous avons mené des études de liaison UDP par amarrage de molécules UDP dans le domaine de la glycosyltransférase. L’évaluation indique un chevauchement important des sites de liaison UDP et UDP-substrat.Le résultat est présenté dans la section supplémentaire. Un example de conformation énergétiquement favorable de l’UDP ainsi que des régions de liaison du substrat et du polymère sont représentés sur la Fig. S3. Bien que l’évaluation soit basée sur le modèle statique, le placement de deux grosses molécules de nature chimique similaire à proximité des exigences d’environnements physiochimiques similaires est peu probable pour cette enzyme. Nous supposons qu’un passage recouvert de résidus chargés positivement de SSE9 et d’ions métalliques pourrait faciliter la libération d’UDP à partir de l’extrémité du polymère. L’implication de l’ion métallique dans la glycosyltransférase pour la libération d’UDP est également bien documentée24. Étant donné que les deux sites UDP ne s’excluent pas mutuellement, le deuxième scénario de réaction en plusieurs étapes semble plus probable.
Une fois que l’UDP est libérée du polymère, une attaque nucléophile du groupe OH du substrat-UDP (accepteur) créerait une liaison glycosidique. Pour créer une inversion, la libération d’UDP et l’attaque nucléophile ultérieure doivent se produire à partir de deux faces opposées du sucre polymère. Nous proposons le rôle de trois catalyseurs de base dans le schéma réactionnel global qui se trouvent sur les faces α et β du sucre donneur à l’extrémité du polymère. Ces étapes sont illustrées par la Fig. 6B et décrit ci-dessous.
Réaction de glycosyltransférase proposée en trois étapes
Étape 1: Libération d’UDP: L’Asp-260 de SSE8 pourrait agir comme une base (B1) et initier la libération de la molécule d’UDP à partir du polymère (donneur) de la face α. Cette étape créerait un intermédiaire enzymatique glycosyle lié de manière covalente protégé sur la face β avec la base B1. Pour créer une inversion, cette face du sucre doit être libre pour une attaque nucléophile par le groupe O-H du sucre entrant. D’où une étape intermédiaire, avec l’attaque nucléophile de la face α libérerait la face β prête pour l’attaque nucléophile par le sucre accepteur.
Étape 2: Libération de B1 par B2; Explorer le rôle de Thr-283: La base B2 sur la face α du sucre donneur effectuerait une attaque nucléophile sur le carbone anomérique au centre de réaction et libérerait B1. Nos études structurelles montrent des Gln-295 et Thr-283 conservés sur cette face. La libération d’UDP peut entraîner des changements conformationnels et amener l’un de ces résidus à proximité du sucre donneur pour la catalyse. La mutation du Gln-295 entraîne jusqu’à 90% de perte d’activité, mais le rôle de base n’est pas connu20. Nous avons évalué la possibilité qu’un Thr-283 conservé résidant dans une boucle fonctionne comme deuxième base. Nous avons muté Thr en Ser contenant un groupe OH fonctionnel similaire et en Ala avec une petite chaîne latérale aliphatique. Les deux mutants T283A et T283S montrent une perte de production d’HA d’environ95% (Fig. 4 BIS). Ce résidu présente une corrélation positive avec les régions SSE4 et SSE6 et une région spatialement proximale entre le résidu 186 et le résidu 190 (Fig. 5C). Le résidu 188, bien que non conservé, se trouve au voisinage du substrat ancré (Fig. 3). Le Thr-283 ne montre pas de corrélation positive élevée avec SSE8 détenant la base catalytique. Il est possible que le résidu agisse comme un résidu de base de support pendant la réaction catalytique avec son mouvement coordonné avec la région de liaison du substrat spatialement proximale indépendante de la base Asp-260 dans SSE8. D’autres expériences seraient nécessaires pour étayer son rôle de base. Dans l’ensemble, l’étude met en évidence un autre résidu fonctionnellement critique, inconnu auparavant.
Étape 3 : Réaction de transfert de glycosyle: Une fois B1 libéré, la face β du carbone anomérique du sucre polymère est débloquée pour la réaction. La déprotonation du substrat-UDP sur la même face par une troisième base créerait un groupe nucléophile. Cette étape pourrait être initiée par B1 ou une autre base B3. Asp-259, à côté de B1 est un résidu hautement conservé à proximité du substrat-UDP et pourrait agir comme B3. Cependant, B1 / B3 est plus proche du sucre polymère (donneur) comme discuté à l’étape 1. Pour initier la déprotonation, B1 doit être à proximité du sucre accepteur. Il pourrait être réalisé grâce à des changements de conformation à SSE8 assistés par SSE7. L’hélice équivalente dans la cellulose synthase contient une base catalytique et subit des transitions conformationnelles coordonnées pour la réaction et la translocation de la glycosyltransférase. Une attaque nucléophile du sucre accepteur sur le carbone anomérique du sucre donneur créerait une liaison glycosidique et une libération de la base B2.