- SeHASの3次元構造的特徴
- クラスIの部分構造要素(SSE)には
- UDP-基質の結合部位が重なっている
- Lys-139はSeHASでは不要であり、基質結合に役割を持っています
- SSE5はポリマーに結合し、HA産生に影響を与える
- Gln-248(SSE7)は、コンフォメーション遷移におけるもっともらしい役割を持つ重要です
- SSEsは協調運動を示す
- セルロースシンターゼのようなグリコシルトランスフェラーゼファミリー GT-2のプロトタイプメンバーでは、ポリマー生合成は成長するポリマーの非還元末端から起こる25,31。 このような系では、UDP-基質は糖を受容体として作用する高分子糖に転写するドナーとして作用する24。 糖間のβ結合は、直接変位SN2置換反応を介してα結合糖-UDP前駆体から作成されます。 この反応では、触媒塩基による脱プロトン化工程がアクセプター24を機能化させる。 この受容体糖基による単一のオキソカルベニウムイオン様遷移状態を介したドナーへの求核攻撃は,ドナー糖からのUDPの放出とアノマー炭素における立体化学の正味の反転を伴うグリコシル移動反応をもたらす。 この機構を図1 0に示す。 6A.SeHASはこのプロトタイプとは異なります。 HAは還元末端から伸長することが知られている12。 これは,(i)udpが触媒作用中にudp基質ではなくポリマー末端から放出されることを意味し,(i i)ドナーとして作用するH a-UDPと受容体としてのUDP糖基質を有するドナーとアクセプターの逆転を意味する。 リガンド結合のランドスケープと活性部位アーキテクチャに関する知見に基づいて、我々は、ドナーとアクセプターとしてのリガンドの参加を議論し、SeHASにおけるグリコシル移動のための触媒機構を提案する(図を参照)。 6B)。 フィギュア6 SeHASにおける分子機構を提案した。 (A)反転化学を用いたプロトタイプ糖転移酵素のメカニズム。 (B)クラスIで提案されたメカニズムがあります。 P:ポリマー砂糖、S:基質の砂糖。UDPは円で示されます。 B1、B2およびB3は、反応機構に関与する触媒塩基である。 糖転移酵素反応は複数の工程で起こりやすい
- 提案された三段階の糖転移酵素反応
SeHASの3次元構造的特徴
SeHAS配列の構造モデルをraptorx webserver26を用いて作成した。 モデルは、セルロースシンターゼテンプレート(PDB:4P00)を用いて得た。テンプレート酵素は、Sehas25と高い機能的類似性と低い配列類似性(-15%)を共有しています。 テンプレートとの配列類似性が低いにもかかわらず、得られたモデルは、グローバル(P値:10-8)および絶対(GDTスコア:52)品質測定によって示されるように高品質 構造モデルのステレオ化学的品質評価は、残基の98.5%がRamachandranプロットの許可された/部分的に許可された領域に存在することを示しています。
図1はSeHASの構造モデルを示しています。 HAS構造モデルは、一本鎖が三つの成分に折り畳まれることを示しています: (i)機能的グリコシルトランスフェラーゼドメイン、(i i)4つの膜貫通ヘリックス(TM1−TM4)および(iii)3つの両親媒性ヘリックス(AP1−AP3)。 グリコシルトランスフェラーゼドメインは、β/αアーキテクチャにおけるαヘリックスに囲まれた混合7本鎖βシートによって形成されたGT-aフォールドを採用している。 膜貫通ヘリックス(TM1-TM4)は、四つのヘリックスバンドルを形成し、ポリマー転座のための細孔を作成します。 SehaのC末端残基は無秩序であると予測され、図1 1には示されていない。 1. SeHASのオリゴマーの性質はまだ調査されています。 2018年まで、SeHASはその単量体の形で機能することを特徴としていた9。 最近の報告では、SeHAS酵素がホモ二量体として機能することが示されている27。 本研究の範囲はプロトマー中の特徴の評価に限定される。

SeHASの構造モデルと特徴。 SSE:下部構造要素、AP:両親媒性ヘリックス、TM:トランス膜ヘリックス。
SeHASの3次元構造モデルは、両親媒性ヘリックスの数のわずかな違いと融合、ラベリングとプロテアーゼアクセシビリティexperiments12、16、19を使用して導出された化膿レンサ球菌で持っているの以前に決定されたトポロジーと一致しています。 セルロースシンターゼ構造との比較評価に基づいて,以前に報告された二つの両親媒性ヘリックスの代わりに三つの両親媒性ヘリックスの存在を提案した。 両親媒性ヘリックスAP2に対応するSeHAS残基は、それらの細胞位置について特異的にプローブされていない16。 この原稿で後述するように、このヘリックスは機能的に重要な残基を保持している。
構造モデルは、Sehas19におけるN-エチルマレイミド(NEM)阻害の結果を説明しています。 NEMはチオール基と反応するため、タンパク質中のシステイン残基の役割を調べるために使用されます。 SeHASは4つのCys残基を有する:Cys-226、Cys-262およびCys-281およびCys-367。 最初の3つのシステイン残基はサイトゾルに位置しているため、阻害につながるNEMにアクセス可能です。 しかし、Cys-367は膜貫通ヘリックスに位置し、NEMにはアクセスできない。 従って、この残基についての阻害は報告されない。 基質の存在下では、NEMはCys−2 8 1にのみ結合することが示される。 我々の構造研究(後述)は、Cys-226およびCys-262がUDP-基質結合部位に近接して位置し、基質の存在がこれらの残基へのNEMのアクセスをブロックすることを示している。 Cys−2 8 1はUDP結合部位から離れており、基質の存在はこの部位をNEM阻害から遮断しない。
クラスIの部分構造要素(SSE)には
クラスIに固有の機能機械に関する情報はほとんどありません。 3次元構造が存在しない場合、実験的に研究されたサイトの機能的役割は知られていない。 したがって、SeHASの機能成分と3-Dにおけるそれらの相対的な配置についての理解を得るために、我々はサブ構造要素(SSE)と呼ばれる進化的に保存された 我々は、81クラスIは、方法のセクションで精緻化厳格な選択基準を通じて得られた配列を持って比較しました。 クラスIは、膜貫通ヘリックスの数が異なる酵素を持っています。 構造情報がない場合、この領域のアライメントの品質は低下します。 したがって、配列の比較は、あいまいな残基-残基の対応を有する部位を避けるために、サイトゾル領域に限定される。 HASクラスI配列の整列は、補足図として提供される。 Jalviewで作成されたs1。 保存スコアは、SeHAS配列に関するすべての残基-残基の対応について計算されます。 平均スコア>=70で、少なくとも2つのサイトスコア>=80の連続したストレッチは、サブ構造要素(SSE)として定義されます。 この基準を使用して、本発明者らは、H Aにおいて潜在的な構造/機能的重要性を有する、SSE1−SSE9と標識された9つの副構造要素を同定する(図1 0A)。 2). ほとんどのSseの二次構造は、螺旋状に発生するSSE5、SSE8、およびSSE9を除くループにマップされます。 これらの要素はまた、図にマークされている。 1. 表1は、配列の詳細と、SSEの構造的および機能的役割をまとめたものです。

SeHASシーケンス番号に関する保存スコアのプロット。 SSEは上に示されています。 シーケンスの二次構造投影は、下部に示されています。 鎖は長方形として表される矢および螺旋形として印が付いている。 充填された長方形は両親媒性ヘリックスに対応する。 詳細はテキストを参照してください。
私たちの研究では、保存されたSse:HASに固有のSSE5およびSSE7が報告されています。 これまでに研究された変異は、残基Tyr-74、Asp-159、Ser-218、Cys-226に対応する。 は、cys−2 8 1、Gln−2 9 5、Gln−2 9 6、Asn−2 9 7、Arg−2 9 8、Trp−2 9 9、Arg−4 0 6、Arg−4 1 3が、活性に影響を及ぼすことが示されている。 残基Lys−4 8、Glu−3 2 7、Lys−4 1 4、Lys−4 1 5に対応する突然変異は、H Aポリマー1 8、1 9、2 0、2 1、2 3の反応速度および/または分子量に影響を及ぼす。 これらの変異部位の大部分は、SSE1−4、6、8および9にマッピングされる(表1)。他のサイトは、クラスIが家族を持っているの保存された機能ではありません。 Bi et al. (2015)は、多様なプロセスグリコシルトランスフェラーゼを分析し、活性のために重要であるグリコシルトランスフェラーゼドメインにおける三つの可変間隔Asp残基の存在を議論します25。 これらには、ヌクレオチド結合におけるSSE1からのAsp、金属への結合におけるSSE2のAsp、塩基としての役割が考えられるSSE8におけるAspが含まれる。 さらに、ポリマー結合における可能性のある役割は、SSE9の残基のために示唆されている。 Weigel(2015)は、UDP-糖結合に関与する可能性のある領域としてトリペプチドを含む8つのAsp/Gluを提案した12。 SSEの役割を解明し、UDP-糖に結合する領域を同定するために、我々はドッキングシミュレーションを行った。
HAS酵素は、UDP-糖基質の結合部位と、グリコシド結合形成を触媒する高分子糖の結合部位12を少なくとも二つ有することが期待されている12。 酵素構造における結合部位を同定するために,UDP-n-アセチルグルコサミンとUDP-グルクロン酸のudp-糖基質のドッキング研究を行った。 UDP−基質に対する結合領域は、方法で定義されるように、グリコシルトランスフェラーゼドメイン内にその中心を有するグリッドを介して評価される。
UDP-基質の結合部位が重なっている
ドッキングシミュレーションは、UDP-N-アセチルグルコサミンとUDP-グルクロン酸について別々に行われる。 低エネルギー適合体(5kcal/molよりも優れている)が選択されます。 図3Aは、さまざまなシミュレーション実行でエネルギー的に良好なコンフォーマーを持つさまざまなサイトの接点の頻度を示しています。 二つの基質のいずれかに対して少なくとも10%の周波数を有する極性残基が示されている。 図からの注目すべき観察は、二つの糖基質の結合部位が重複することである。

(A)UDP-Nアセチルグルコサミン(UDP-Glcnac)およびUDP-Dグルクロン酸(UDP-Glca)のエネルギー的に好ましい立体配座のためのリガンド接触残基の頻度。 周波数はX軸にプロットされ、サイトはY軸にプロットされます。 (B)UDP−糖基質結合におけるSSE1−4、SSE8およびSSE9の役割。 (C)リガンド結合におけるSSE6の役割。 (D)ポリマー結合におけるSseの役割。 (E)SSE7の役割。 (i)ヒアルロン酸合成酵素のSSE7ループ、(ii)セルロース合成酵素の等価ループ、(iii)非プロセスグリコシルトランスフェラーゼの等価ループ。 (F)エネルギーはUDP-N-アセチルグルコサミンとグルクロン酸とN-アセチルグルコサミンの二糖類を示す構造を持つ。
接触残基の役割は、エネルギー的に最も有利な生物学的に関連する立体配座との結合を調査することによって評価された。 コンホーマの選択は、ヌクレオチド結合に関与することが知られている進化的に保存されたSSE1にUDPのヌクレオチド環の近接によって導かれる。 結合ポケット内の選択された立体配座を図1に示す。 SSE1−SSE4、SSE6、SSE8およびSSE9は、基質結合に関与している(図3B)。 3B)。 SSE1、SSE2およびSSE4は主にsse3、SSE8およびSSE9が糖環と相互作用しながら、基板のウリジン部分を安定化させる。 基質のUDP−環の酵素との初期結合は、(i)SSE2の保存されたAsp−1 0 3の側鎖によって促進され得る(青色、図2B)。 図3B)ヌクレオチドの極性基との水素結合を介して、(ii)Tyr-74の芳香環によって(緑、図3b)ヌクレオチドの極性基との水素結合を介して、(ii)Tyr-74の芳香環 3B)SSE1からUDPのウリジン環とのπ-π相互作用を介して。 Glu−7 6の側鎖(緑色、図1 4A)。 3B)SSE1からUDPのリボース糖の極性基と水素結合を形成する。 Sse4からの残基Asp-161はリボース環のOH基を安定化させ、Asp-159は金属イオンを安定化させる。 Gln-295とArg-298(青)SSE9から相互作用し、UDPヌクレオチドのピロリン酸基を安定化することができます。 Trp-299のNE原子は砂糖の基質へのH結合の間隔にあり、基質の方向づけで多分助けます。 Asp-260はセルロースシンターゼ25の触媒塩基とトポロジー的に同等である。 SSE8はAsp-260を保持している。 この残基に連続的に近位には、Asp-259およびArg-261があり、これらは両方とも糖環の極性基と相互作用する(緑色)。 Lys−1 3 9の隣の残基Arg−1 4 0は、部分的に保存され、Sehas相同体においてLysのみで置換される。 この残基は、SSE8を保持するらせんのN末端に近接している(緑色)。 この末端には負に帯電したAsp残基が含まれており、Arg-140によって中和される可能性があります。
SSE6からの残基(Fig. 結合部位でリガンドを支持する足場を作製する。 ループは戦略的に置かれ、結合のポケットの基盤を形作る。 ループはまた、触媒塩基(SSE8)と結合した高分子糖(後述)の近くに座っています。 上述したように、N-エスリマレイミドを用いた実験では、この元素の保存されたCys-226がUDP-糖結合部位の近くに配置される19。 これは、活性部位での微小環境のpKaの維持に関与している可能性が高い。 活性には必須ではないが、この残基のAlaへの突然変異はSehas19,28において活性に影響を及ぼすことが示されている。 Ser-227の側鎖は、主鎖との相互作用を介してループ立体配座の安定化に関与している可能性が高い。 Gly−2 2 8およびPro−2 2 9は、それぞれ、主鎖立体配座に必要な柔軟性および剛性を提供する(図1 0A)。 3C)。
Lys-139はSeHASでは不要であり、基質結合に役割を持っています
ドッキング評価は、リガンド結合におけるLys-139の役割を示唆しています。 これまでの研究では、哺乳動物の形態のHASにおけるこの残基の調節的役割が報告されている。 マウスでは、Argへの突然変異は完全な活動の損失で起因します24。 SeHASにおける変異研究がない場合、その役割をさらに解明するために、Lys-139の変異研究を行った。 実験のセットアップおよびアッセイの詳細は、方法に記載されている。 実験結果と研究に用いたpmbadベクトルマップを図に示す。 図4A、B、それぞれ。 我々は、その位置での電荷を保存することを目的として、Lys−1 3 9をArg(K1 3 9R)に変異させた。 突然変異は活性の完全な喪失にはつながらなかったが、影響を与えた。 この残基の有意な機能的役割を繰り返している対照と比較して、わずか3 4%の活性(H A産生)のみが保持された(図1 0A)。 4A)。 さらに、この残基と基質との間の電荷ベースの相互作用をプローブするために、我々は負に帯電したAsp(K139D)に正に帯電したLys-139を変異させた。 サイトでの負電荷は、コントロールと比較して82%の活性(HA産生)の保持につながります。 この分析は,基質の極性基の安定化におけるこの残基の役割を示唆している。 置換の選択は、正および負に荷電した基の両方がその部位に収容されることをさらに説明する。 我々の研究は、この残基が直接SeHASのシンターゼ活性に影響を与えることを示しています。 この部位での突然変異は、合成酵素機能をかなりのレベルまで損なう。

SeHASの突然変異の研究。 (A)本研究で実施したSehas変異体の相対活性。 実験は三重で実施され、HA力価の標準誤差は±0.01〜±0.05の範囲であった。 (B)PMBADベクター構築物。 Streptococcus equi subspからのhasAおよびhasB遺伝子。 zooepidemicusは順次クローン化された。 変異研究のために、HASA野生型を対応する変異体(複数可)に置換した。
SSE5はポリマーに結合し、HA産生に影響を与える
両親媒性ヘリックスによって形成されたUDP-基質結合領域の上の空洞は、ポリマー単位の結合について評価 高分子結合の研究は、グリコシド結合形成に関与する末端二糖に限定される。 ドッキング研究は、β1-4結合N-アセチルグルコサミンとd-グルクロン酸グリコシルトランスフェラーゼドメインで構成されるHA二糖単位で行われた。 エネルギー的に有利なコンホーマが選択された。 図3Dは、結合ポケットの近くにドッキングされたHA二糖ユニットを示しています。 SSE5、SSE8およびSSE9は結合に関与している(図1 0B)。 3D)。 SSE8からの残基Asp−2 6 0は、重合体の末端O H基までのH結合距離にあり、図1 0中の破線で示される。 3D.Sse8からのArg-261はポリマーの近くにあり、砂糖の極性OH基と相互作用することができます。 SSE9からの残基Trp−2 9 9は、末端糖とC H−γ相互作用を形成する。
我々の知る限りでは、これはSSE5からの残基の機能的関与を仮定した最初の報告である。 ポリマーへの結合に関与するSSE5中の主要な残基は、Arg−2 0 5、Tyr−2 0 6、Phe−2 1 0およびArg−2 1 4である。 Arg-205はドッキングされた二糖に近接しており、糖部分の負に荷電した極性基との相互作用に関与している。 Sehas相同体におけるTyr-206またはフェニルアラニンは、陽イオン-γ相互作用を介してArg-205残基を安定化させることが見られている。 相同配列中のarg−2 1 4またはLysは、ポリマーに近接しており、部分的に保存されたPhe−2 1 0に近接しており、これにより陽イオン−γ相互作用が形成される。 SSE5からの残基の突然変異の結果は知られていない。 ここでは、部位特異的変異誘発を介して機能にTyr-206とArg-214を変異させた結果をプローブします。 我々の実験結果は、芳香族チロシンをアラニン(Y206A)に変異させることによる陽イオン-γ相互作用の破壊が、HAS活性(HA産生)の99%の損失をもたらすことを示 4A)。 この相互作用の損失は、間接的に隣接Arg-205を介してポリマー結合に影響を与えている可能性があります。 同様に、2 1 4での塩基性アルギニン残基のアラニン(R2 1 4A)への突然変異は、機能の完全な喪失をもたらす(図1 0A)。 4A)。 興味深いことに、負電荷(R214E)の導入は93%の機能損失をもたらす(図。 4A)。 これらの結果は、ポリマーの結合および転座を容易にするために、この部位で正味の正電荷の必要性を反復する。 これらの変異は、ポリマー結合/転座およびグリコシルトランスフェラーゼ活性の相互依存性を示している。
さらに、二つの配位子(UDP-糖および二糖)と複合体化した酵素は、琥珀色の力場を用いてエネルギーを最小限に抑えた。 図3Fは、UDP-N-アセチルグルコサミンと結合した酵素と、グルクロン酸とN-アセチルグルコサミンを高分子末端に結合させた二糖を示している。 最小化プロトコルの詳細は、メソッドで説明されています。
Gln-248(SSE7)は、コンフォメーション遷移におけるもっともらしい役割を持つ重要です
Gln-248は、SSE7の保存された残基であり、結合部位から長いループ離れています。 Processiveおよびnon-processive同族体の同等のループは順次異なっており、基質結合型および非結合型の酵素形態において明確な立体配座を示している(Fig. および図3e(i i))2 9、3 0、3 1および図3E(i i)。 3E(iii)β1-4ガラクトシルトランスフェラーゼ、PDBコード:2FYDおよび2FY7)32。 SeHASのループは触媒作用のためのSSE8の位置を促進するために本当らしいです。 残基Gln−2 4 8は結合ポケットから離れて存在する;この残基の正確な役割は、これらのインシリコ研究に基づいて予測することができなかった。 社内突然変異の調査は重要であるためにこの残余を示します。 残渣をAlaで置換すると、H A産生のほぼ完全な喪失が生じる(図1 0A)。 4A)。この残留物の役割は、粗い粒度の動的研究によってさらに精査され、後のセクションで議論される。
SSEsは協調運動を示す
現在のパラダイムはstructure-encodes-dynamics-encodes-function33,34,35である。 これは、ますますそれらのネイティブ状態での原子のランダムな変動は、構造の機能的に関連する変化のためのタンパク質を素因協調運動を隠すことが認識されています。 これらの動きは,弾性ネットワークモデリングにおける低周波モードによって捕捉できる。 これらのモードは構造および精力的な細部に無感覚であると知られている。 したがって、我々は異方性ネットワークモデリング(ANM)、SeHASの3次元構造によって符号化されたダイナミクスのグローバル画像をキャプチャするためにENMベース ANM計算にはPrody36を使用しました。 詳細については、メソッドのセクションを参照してください。 協調運動は,ANMネットワークのノード間の相関係数値として表される。 平均相関係数値は、最初の50のモードに基づいて計算されました。 図5Aは、SeHASの相関マップを示しています。 正の相関係数の値は、原子が同じ方向に移動することを示しています。 相関係数の高い空間的近位残基のクラスターは構造的および機能的に重要であると考えられた。 大きな正の値を有する残基対は、副構造要素に対応する。 さらに、残基対間の相関は、異なるSSEを横切る領域にまで及ぶ。 SSE1-4は密接に相互作用するサブドメイン(黒い長方形)を形成する。 同様に、SSE5-9は、協調相互作用するサブドメイン(灰色の長方形)を形成する。 二つのサブドメインは相関の低い領域によって分離されている。 固有のグローバルな動きは、SSE1-4ともう一方の端(SSE5-9)でポリマー結合によって、一方の端に基板結合に関して必要な機能的配位を示しています。

SeHASにおけるグローバルダイナミクスの評価。 (A)残基対間のSehaの平均相関係数値。 他のSehas残基とのGln−2 4 8(B)およびThr−2 8 3(C)の平均相関係数値。
我々はさらに残基Gln-248に関するSeHASのダイナミクスを検討しました。 図1.1.1. 図5Bは、Seha中の他の残基に対する相関係数値の分布を示す。 Gln-248は、触媒および基質結合残基を保持するSSE8、9およびSSE3と大きな正の値を示す。 ANMを介して評価されたこれらのSseとの協調運動は,機能的に関連する立体配座ダイナミクスにおけるその役割をさらに示している。
ANM研究は、相関係数値に対する突然変異の影響を評価するために拡張されています。 変異体の各々について、構造モデルは、Raptorx2 6を用いて得られる。 変異体は、WTタンパク質構造に関して、全ての原子にわたって約1Åの平均RMSDと高い構造的重複を示す。 すべての変異体構造について、変異体残基に関する相関係数値が計算され、WTと比較される。 プロットは図に示されています。 S2… サイト214、248および283における変異は、SSE領域における値に実質的な差を示す。
セルロースシンターゼのようなグリコシルトランスフェラーゼファミリー GT-2のプロトタイプメンバーでは、ポリマー生合成は成長するポリマーの非還元末端から起こる25,31。 このような系では、UDP-基質は糖を受容体として作用する高分子糖に転写するドナーとして作用する24。 糖間のβ結合は、直接変位SN2置換反応を介してα結合糖-UDP前駆体から作成されます。 この反応では、触媒塩基による脱プロトン化工程がアクセプター24を機能化させる。 この受容体糖基による単一のオキソカルベニウムイオン様遷移状態を介したドナーへの求核攻撃は,ドナー糖からのUDPの放出とアノマー炭素における立体化学の正味の反転を伴うグリコシル移動反応をもたらす。 この機構を図1 0に示す。 6A.SeHASはこのプロトタイプとは異なります。 HAは還元末端から伸長することが知られている12。 これは,(i)udpが触媒作用中にudp基質ではなくポリマー末端から放出されることを意味し,(i i)ドナーとして作用するH a-UDPと受容体としてのUDP糖基質を有するドナーとアクセプターの逆転を意味する。 リガンド結合のランドスケープと活性部位アーキテクチャに関する知見に基づいて、我々は、ドナーとアクセプターとしてのリガンドの参加を議論し、SeHASにおけるグリコシル移動のための触媒機構を提案する(図を参照)。 6B)。
フィギュア6
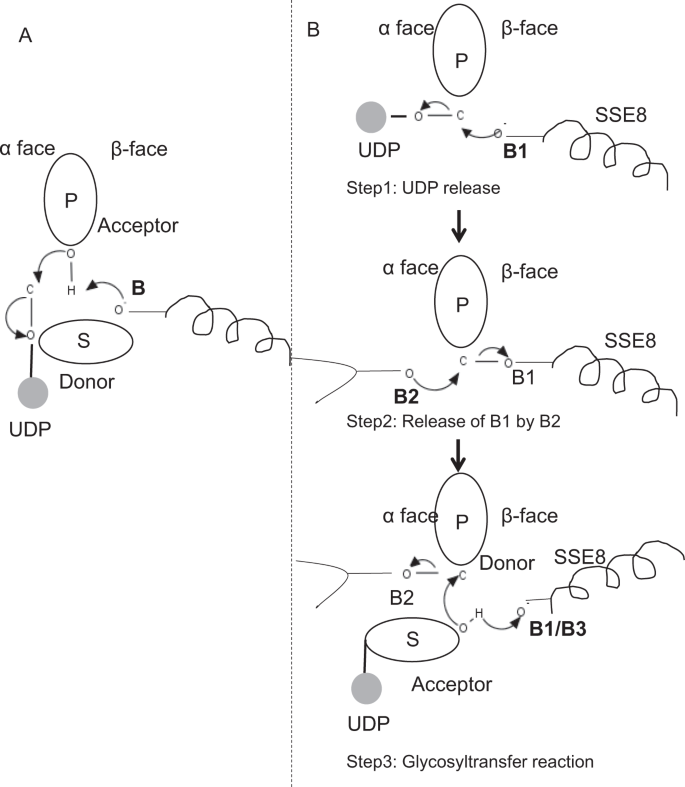
SeHASにおける分子機構を提案した。 (A)反転化学を用いたプロトタイプ糖転移酵素のメカニズム。 (B)クラスIで提案されたメカニズムがあります。 P:ポリマー砂糖、S:基質の砂糖。UDPは円で示されます。 B1、B2およびB3は、反応機構に関与する触媒塩基である。
糖転移酵素反応は複数の工程で起こりやすい

SeHASにおける分子機構を提案した。 (A)反転化学を用いたプロトタイプ糖転移酵素のメカニズム。 (B)クラスIで提案されたメカニズムがあります。 P:ポリマー砂糖、S:基質の砂糖。UDPは円で示されます。 B1、B2およびB3は、反応機構に関与する触媒塩基である。
最初の工程として、セルロース合成酵素様の単一工程糖転移酵素反応の可能性を検討しました。 グリコシルトランスフェラーゼ反応が一段階で起こる場合、所与の時点での酵素は、二つのUDP部分、一つはポリマーに結合し、もう一つは入ってくる基質に結合した二つのUDP部分を保持する必要がある。 別のマルチステップシナリオでは、ポリマーからのUDPは触媒反応が起こる前に放出される。 この場合、立体化学の正味の反転を作成するために、反応はSN2機構を有する一連の奇数のステップで起こるであろう。 どのシナリオがより可能性が高いかを評価するために、我々は糖転移酵素ドメイン内のUDP分子のドッキングを介してUDP結合研究を行った。 この評価は、UDPおよびUDP−基質結合部位の有意な重複を示す。結果は補足セクションで提示されます。 基質およびポリマー結合領域と共にUDPのエネルギー的に有利な1つの例示的な立体配座が、補足図1に示されている。 S3… 評価は静的モデルに基づいているが,同様の化学的性質の二つの大きな分子を同様の物理化学的環境の要件と近接して配置することは,この酵素にとってはそうではない。 我々は、SSE9と金属イオンからの正に帯電した残基が並ぶ通路は、ポリマー端からのUDP放出を容易にすることができると推測している。 UDP放出のためのグリコシルトランスフェラーゼにおける金属イオンの関与もよく文書化されている24。 二つのUDPサイトは相互に排他的ではないので、マルチステップ反応の第二のシナリオは、より可能性が高く表示されます。
UDPがポリマーから放出されると、基質–UDP(アクセプター)のOH基からの求核攻撃がグリコシド結合を作成します。 反転を作成するには、UDPのリリースとその後の求核攻撃は、高分子糖の二つの反対の面から発生しなければなりません。 ポリマー末端のドナー糖のα面とβ面にある反応スキーム全体における三つの塩基触媒の役割を提案した。 これらのステップは、図1 3aを介して図示される。 図6Bおよび以下に説明する。
提案された三段階の糖転移酵素反応
Step1:UDP放出:Sse8からのAsp-260は、塩基(B1)として作用し、α-faceからのポリマー(ドナー)からのUDP分子の放出を開始することができる。 このステップは、塩基B1とβ面上に遮蔽された共有結合結合グリコシル酵素中間体を作成するであろう。 反転を作成するには、砂糖のこの顔は、入ってくる砂糖O-Hグループによる求核攻撃のために自由である必要があります。 したがって、α面からの求核攻撃を伴う中間段階は、受容体糖による求核攻撃の準備ができているβ面を解放するであろう。
ステップ2:b2によるB1の放出;ドナー糖のα面におけるThr-283:塩基B2の役割を探ることは、反応中心のアノマー炭素に求核攻撃を行い、B1を放出する。 我々の構造研究は、この顔に保存されたGln-295とThr-283を示しています。 UDP放出は立体配座の変化をもたらし、触媒作用のためにこれらの残基の一つをドナー糖に近接させる可能性がある。 Gln−2 9 5の変異は、最大9 0%の活性喪失をもたらすが、塩基としての役割は知られていない2 0。 我々は、第二のベースとして機能するためにループ内に存在する保存されたThr-283の可能性を評価した。 同様の機能性O h基を含むSerと小さな脂肪族側鎖を持つAlaにThrを変異させた。 両方とも、T2 8 3AおよびT2 8 3S変異体は、H A産生の約9 5%の損失を示す(図1 0B)。 4A)。 この残基は、領域SSE4およびSSE6、ならびに残基1 8 6と残基1 9 0との間の空間的に近位の領域と正の相関を示す(図1)。 5C)。 残渣1 8 8は、保存されていないが、ドッキングされた基質の近傍にある(図1 0A)。 3). Thr-283は、触媒塩基を保持するSSE8と高い正の相関を示さない。 この残基は、Sse8におけるAsp-260塩基とは独立した空間的に近位の基質結合領域と協調したその運動を伴う触媒反応中に支持塩基残基として作用す 基地としての役割を実証するためには、さらなる実験が必要であろう。 全体として、この研究は、以前には知られていなかった、さらに別の機能的に重要な残留物を強調している。
ステップ3:グリコシル転移反応:B1が放出されると、高分子糖のアノマー炭素のβ面が反応のためにブロックされなくなる。 第三塩基による同じ面上の基質-UDPの脱プロトン化は、求核基を生成するであろう。 このステップは、B1または別の塩基B3によって開始され得る。 B1の隣にあるasp−2 5 9は、基質−UDPに近接した高度に保存された残基であり、B3として作用し得る。 しかし、B1/B3は、ステップ1で議論されるように、ポリマー糖(ドナー)により近い。 脱プロトン化を開始するためには、B1は受容体糖に近接していなければならない。 それはSSE7によって助けられるSSE8の立体配座の変更によって達成できます。 セルロースシンターゼの等価ヘリックスは触媒塩基を保持し,グリコシルトランスフェラーゼ反応と転座のための配位配座遷移を受ける。 ドナー糖のアノマー炭素上のアクセプター糖の求核攻撃は、グリコシド結合と塩基B2のリリースを作成します。