- 3-D Strukturelle trekk Ved SeHAS
- Substructural elements (SSE) I Klasse I HAR
- Bindingssteder FOR UDP-substrater overlapper
- Lys-139 er dispensable I SeHAS og har en rolle i substrat binding
- SSE5 bindes til polymer og påvirker HA-produksjon
- Gln-248 (SSE7) er kritisk med en plausibel rolle i konformasjonsovergang
- SSEs viser koordinert bevegelse
- Reduserende endepolymerforlengelse I SeHAS, en plausibel tre-trinns mekanisme
- Glykosyltransferasereaksjon forekommer sannsynligvis i flere trinn
- Foreslått tre-trinns glykosyltransferasereaksjon
3-D Strukturelle trekk Ved SeHAS
en strukturell modell Av SeHAS sekvens ble generert Ved Hjelp Av RaptorX webserver26. Modellen ble oppnådd med cellulose syntase mal (PDB: 4P00).Malenzymet deler en høy funksjonell likhet og en lav sekvenslikhet (~15%) Med SeHAS25. Til tross for den dårlige sekvenslikheten til malen, er den oppnådde modellen av høy kvalitet som angitt av global (P-verdi: 10-8) og absolutt (GDT score: 52) kvalitetsmålinger26. Stereo-kjemisk kvalitetsvurdering av strukturmodellen indikerer at 98,5% av rester ligger i tillatt / delvis tillatt region Av Ramachandran-plottet.
Figur 1 viser den strukturelle modellen Av SeHAS. DEN har strukturelle modellen viser at enkeltkjeden brettes i tre komponenter: (i) et funksjonelt glykosyltransferase-domene, (ii) fire transmembrane helikser (TM1-TM4) og (iii) tre amfipatiske helikser (AP1-AP3). Glykosyltransferase-domenet vedtar GT – en fold dannet av blandet 7-strandet hryvnias ark omgitt av hryvnias helices i β / α arkitektur. Transmembrane helices (TM1-TM4) danner en fire helix bunt og lage en pore for polymer translokasjon. 11 C-terminale rester Av SeHAS er spådd å være uordnet og ikke vist I Fig. 1. Den oligomere naturen Til SeHAS blir fortsatt undersøkt. Frem til 2018 ble SeHAS karakterisert for å fungere i sin monomere form9. Nylige rapporter indikerer SeHAS enzymfunksjoner som en homodimer27. Omfanget av dagens arbeid er begrenset til vurdering av egenskaper i protomeren.

Strukturell modell og egenskaper Av SeHAS. SSE: Understruktur element, AP: Amphipathic helix, TM: Trans-membran helix.
3-D strukturell modell Av SeHAS er i samsvar med tidligere bestemt topologi AV HAR I Streptococcus pyogenes avledet ved hjelp av fusjon, merking og protease tilgjengelighet experiments12, 16, 19 med en liten forskjell i antall amfipatiske helikser. Vi foreslår tilstedeværelse av tre amphipathic helices i stedet for to amphipathic helices tidligere rapportert basert på komparativ vurdering med cellulose syntase struktur. SeHAS rester tilsvarende amphipathic helix AP2 har ikke blitt undersøkt spesielt for deres cellelokasjon16. Som diskutert senere i dette manuskriptet, inneholder denne helix rester av funksjonell betydning.
den strukturelle modellen forklarer resultatene Av n-etylmaleimid (NEM) hemming I SeHAS19. NEM reagerer med tiolgrupper og brukes derfor til å undersøke rollen av cysteinrester i proteiner. SeHAS har fire Cys-rester: Cys-226, Cys-262 Og Cys-281 Og Cys-367. De tre første cysteinrester er lokalisert i cytosol og er derfor tilgjengelige for NEM som fører til inhibering. Cys-367 ligger imidlertid i transmembrane helix og er utilgjengelig for NEM. Det er derfor ikke rapportert om hemming for denne residuet. I nærvær av substrat, er NEM vist å binde bare Til Cys-281. Våre strukturelle studier (beskrevet senere) indikerer At Cys-226 Og Cys-262 befinner seg i nærheten AV UDP-substratbindingssted, og tilstedeværelsen av substrat vil dermed blokkere tilgangen TIL NEM til disse rester. Cys – 281 ligger borte FRA UDP-bindingsstedet, og tilstedeværelsen av substrat blokkerer ikke dette stedet for nem-hemming.
Substructural elements (SSE) I Klasse I HAR
det er lite informasjon om funksjonell maskineri som er spesifikk For Klasse I HAR. I fravær av 3-D-struktur er en funksjonell rolle av eksperimentelt studerte steder ikke kjent. Derfor, for å få en forståelse av de funksjonelle komponentene I SeHAS og deres relative disposisjon i 3-D, identifiserer vi korte sammenhengende regioner med evolusjonært konserverte sekvensfunksjoner kalt substrukturelle elementer (SSE). Vi sammenlignet 81 Klasse I har sekvenser oppnadd gjennom strenge utvalgskriterier utarbeidet I Metodeseksjonen. Klasse I har enzymer forskjellig i antall transmembrane helices. I mangel av strukturell informasjon er justeringen i denne regionen av dårlig kvalitet. Derfor er sammenligningen av sekvenser begrenset til den cytosoliske regionen for å unngå steder med tvetydig rest-restkorrespondanse. Justeringen AV HAS Klasse I-sekvenser er gitt Som Supplerende Fig. S1, opprettet med Jalview. En bevaring score beregnes for hver rester-rester korrespondanse med hensyn Til SeHAS sekvens. En sammenhengende strekk med gjennomsnittlig score > =70 og minst 2 steder som scorer > =80 er definert som substrukturelt element (SSE). Ved hjelp av disse kriteriene identifiserer vi 9 understrukturelle elementer, MERKET SSE1-SSE9, av potensiell strukturell / funksjonell betydning I HAS (Fig. 2). Sekundær struktur for de fleste SSEs kart til looper unntatt SSE5, SSE8 OG SSE9 som forekommer i helikser. Disse elementene er også merket I Fig. 1. Tabell 1 oppsummerer sekvensdetaljene samt den strukturelle og funksjonelle rollen TIL SSE.

et plott av bevaringspoeng med hensyn Til SeHAS sekvensnummer. SSE angitt på toppen. Den sekundære strukturprojeksjonen av sekvensen er angitt nederst. Strengene er merket som piler og helikser representert som rektangler. Fylte rektangler tilsvarer amfipatiske helikser. Se tekst for detaljer.
våre studierapporter konserverte SSEs: SSE5 og SSE7 spesifikke FOR HAR. Mutasjoner studert så langt, tilsvarende rester Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, har vist seg å påvirke aktivitet. Mutasjoner som svarer Til rester Lys-48, Glu-327, Lys-414,Lys-415 påvirker reaksjonshastigheten og/eller molekylvekten TIL HA-polymeren18,19,20,21, 23. De fleste av disse mutasjonsstedene kartlegges TIL SSE1-4, 6, 8 og 9 (Tabell 1).Andre nettsteder er ikke en bevart funksjon Av Klasse JEG har familie. Bi et al. (2015) analyserte ulike prosessive glykosyltransferaser og diskuterte tilstedeværelsen av tre variabelt fordelte asp-rester i glykosyltransferasedomene, som er avgjørende for aktiviteten25. Disse inkluderer Asp FRA SSE1 i nukleotidbinding, Asp AV SSE2 i binding til metall, Asp I SSE8 med en sannsynlig rolle som base. I tillegg foreslås en sannsynlig rolle i polymerbinding for rester AV SSE9. Weigel (2015) foreslo åtte Asp / Glu som inneholder tri-peptider som potensielle regioner involvert I UDP-sukkerbinding12. For å belyse SSE-rollen og identifisere regioner som er bindende FOR UDP-sukkerarter, gjennomførte vi dokkingsimuleringer.
HAS enzym forventes å ha minst to bindingssteder, en FOR UDP-sukker substrater og den andre for polymer sukker for å katalysere en glykosidbindingsformasjon12. For å identifisere bindingsstedene i enzymstrukturen gjennomførte vi docking studier AV UDP-sukker substrater: UDP-n-acetylglukosamin og UDP-glukuronsyre. Bindingsområdet for UDP-substrater vurderes gjennom et rutenett med sentrum i glykosyltransferase-domenet som definert I Metoder.
Bindingssteder FOR UDP-substrater overlapper
Dokkingsimuleringer utføres separat FOR UDP-n-acetylglukosamin og UDP-glukuronsyre. Lav energi konformatorer (bedre enn 5 kcal/mol) er valgt. Figur 3A viser frekvensen av kontakter på ulike steder med energisk gunstige konformatorer på tvers av ulike simuleringskjøringer. Polare rester med minst 10% frekvens til noen av de to substratene vises. Den bemerkelsesverdige observasjonen fra figuren er at bindingsstedene for de to sukkersubstratene overlapper.

(A) Frekvens av ligandkontaktrester for energisk gunstige konformatorer AV UDP – N Acetylglukosamin (UDP-GlcNAc) og UDP – D Glukuronsyre (UDP-GlcA). Frekvens er plottet På X-aksen og Steder På Y-aksen. (B) ROLLE SSE1-4, SSE8 OG SSE9 I UDP – sukker substrat binding. (C) ROLLE SSE6 i ligandbinding. (D) Rolle SSEs i polymerbinding. (E) ROLLE SSE7. (I) SSE7 sløyfe i hyaluronansyntase, (ii) Ekvivalent sløyfe i cellulosesyntase, (iii) Ekvivalent sløyfe i ikke-prosessiv glykosyltransferase. (F) Energi minimert har struktur som viser UDP-N-Acetylglukosamin og disakkarid av glukuronsyre og N-Acetylglukosamin moeities.
rollen av kontaktrester ble vurdert ved å undersøke bindingen med energisk mest gunstig biologisk relevant konformator. Valget av konformatoren styres av nærhet av nukleotidring AV UDP til den evolusjonære konserverte SSE1 kjent for å være involvert i nukleotidbinding. De valgte konformatorene i bindelommen er vist På Fig. 3B. SSE1-SSE4, SSE6, SSE8 og SSE9 er involvert i substratbinding (Fig. 3B). SSE1, SSE2 og SSE4 stabiliserer i stor grad uridindelen av substratene mens SSE3, SSE8 og SSE9 interagerer med sukkerringen. Initial binding AV udp-ringen av substratet med enzym kan lettes ved (i)sidekjede av konservert Asp-103 AV SSE2 (blå, Fig. 3B) gjennom hydrogenbindinger med polare grupper av nukleotid og (ii) ved aromatisk ring Av Tyr-74 (grønn, Fig. 3B) fra SSE1 til π-π interaksjoner med UDP ‘ s uridine ring. Sidekjede Av Glu-76 (grønn, Fig. 3B) FRA SSE1 danner hydrogenbindinger med polare grupper av ribosesukker AV UDP. Residue Asp-161 FRA SSE4 stabiliserer OH-gruppen av ribosering, Mens Asp-159 stabiliserer metallionen. Gln-295 Og Arg – 298 (blå) FRA SSE9 kunne interagere og stabilisere pyrofosfatgruppen AV UDP-nukleotid. Ne atom Av Trp-299 er I H-bindingsavstand til sukkersubstratet og bidrar sannsynligvis til å orientere substratet. Asp-260 er topologisk ekvivalent med katalytisk base i cellulose synthase25. SSE8 holder Asp-260. Sekvensielt proksimal til denne resten Er Asp-259 Og Arg-261 som begge samhandler med de polare gruppene av sukkerringen (grønn). Residue Arg-140, ved Siden Av Lys-139, er delvis konservert og erstattet bare Med Lys I SeHAS homologer. Denne resten er i n rheten Av den n-terminale enden av helix holding SSE8 (gronn). Denne enden inneholder negativt ladede asp-rester som kan nøytraliseres Av Arg-140.
Rester FRA SSE6 (Fig. 3C) lag et stillas for å støtte ligander på bindingsstedet. Sløyfen er strategisk plassert og danner base av bindende lomme. Sløyfen sitter også nær katalytisk base (SSE8) og bundet polymer sukker (diskutert senere). Som diskutert ovenfor plasserer eksperimenter ved Bruk Av N-etlymaleimid den konserverte Cys-226 av dette elementet nær UDP-sukkerbindende site19. Dette er sannsynligvis involvert i å opprettholde pka av mikromiljøet på det aktive stedet. Selv om det ikke er nødvendig for aktivitet, er mutasjon av denne rest Til Ala vist å påvirke aktiviteten I SeHAS19, 28. Sidekjede Av Ser-227 er sannsynligvis involvert i å stabilisere sløyfekonformasjonen gjennom interaksjoner med hovedkjeden. Gly-228 Og Pro-229 gir den nødvendige fleksibiliteten og stivheten til henholdsvis hovedkjedekonformasjonen (Fig. 3C).
Lys-139 er dispensable I SeHAS og har en rolle i substrat binding
Docking vurderinger foreslå en rolle Lys-139 i ligand binding. Tidligere studier har rapportert en regulerende rolle for denne rest i pattedyr former FOR HAR. Hos mus resulterer en mutasjon til Arg i fullstendig aktivitetstap24. I fravær av mutasjonsstudier I SeHAS, for å ytterligere belyse sin rolle, gjennomførte vi mutasjonsstudier Av Lys-139. Detaljer om eksperimentell oppsett og analyse er beskrevet I Metoder. Eksperimentelle resultater og pmbad vektorkart som brukes til studien er vist I Fig. 4a, b, henholdsvis. Vi muterte Lys-139 Til Arg (K139R) med sikte på å bevare ladningen på den posisjonen. Mutasjon førte ikke til fullstendig tap av aktivitet, men hadde en innvirkning. Bare 34% aktivitet (HA produksjon) ble beholdt i sammenligning med kontroll som gjentar en betydelig funksjonell rolle av denne rest (Fig. 4A). For ytterligere å undersøke det ladningsbaserte samspillet mellom denne rest og substrat, muterte vi positivt ladet Lys – 139 til negativt ladet Asp (K139D). Negativ ladning på stedet fører til oppbevaring av 82% aktivitet (HA-produksjon) i forhold til kontroll. Denne analysen antyder en rolle for denne rest i å stabilisere polare grupper av substratet. Utvalget av substitusjoner illustrerer videre at både positive og negativt ladede grupper er innkvartert på stedet. Våre studier viser at denne rest direkte påvirker syntaseaktiviteten I SeHAS. Mutasjoner på dette stedet svekker syntasefunksjonen til betydelige nivåer.

Mutasjonsstudier På SeHAS. (A) Relativ aktivitet Av SeHAS mutanter utført i denne studien. Eksperimenter ble utført i triplikater, og standardfeilen for HA-titer var i området fra ±0,01 til ±0,05. (B) pMBAD vektor konstruere. hasa og hasB gener Fra Streptococcus equi subsp. zooepidemicus ble sekvensielt klonet. For mutasjonsstudier ble hasa wildtype erstattet med tilsvarende mutant (er).
SSE5 bindes til polymer og påvirker HA-produksjon
hulrommet over UDP-substratbindingsområdet dannet av amfipatiske helikser evalueres for binding av polymerenhet. Polymerbindingsstudien er begrenset til det terminale disakkaridet som er involvert i dannelsen av glykosidbindinger. Dokkingstasjonsstudier ble utført MED HA disakkaridenhet bestående av et β 1-4 koblet n-acetylglukosamin og D-Glukuronsyre i glykosyltransferasedomene. Energisk gunstige konformatorer ble valgt. Figur 3D viser EN HA disakkarid enhet forankret nær bindingslommen. SSE5, SSE8 OG SSE9 er involvert i binding (Fig. 3D). Residue Asp-260 FRA SSE8 er I H-bindingsavstand til terminal OH-gruppen av polymeren og er angitt med en stiplede linje I Fig. 3D. Arg – 261 FRA SSE8 ligger nær polymeren og kan samhandle med de polare OH-gruppene av sukkeret. Rest Trp-299 fra SSE9 danner CH-π interaksjoner med terminalsukker.
så vidt vi vet, er dette den første rapporten som hypoteser om funksjonell involvering av rester FRA SSE5. Nøkkelrester I SSE5 involvert i binding til polymeren Er Arg-205, Tyr-206, Phe-210 Og Arg-214. Arg-205 er i nærheten av det forankrede disakkaridet og involvert i interaksjoner med de negativt ladede polargruppene av sukkerdelen. Tyr-206 eller fenylalanin i SeHAS-homologer ser ut til å stabilisere arg-205-residuet gjennom kation-π interaksjoner. Arg-214 Eller Lys i homologe sekvenser er i nærheten av polymeren og nær delvis konservert Phe-210 som det danner kation-π interaksjoner med. Konsekvensen av mutasjon av rester FRA SSE5 er ikke kjent. Her undersøker vi konsekvensen av å mutere Tyr-206 og Arg-214 på funksjon gjennom stedsrettet mutagenese. Våre eksperimentelle resultater viser at forstyrrelse av kation-π interaksjoner ved mutering av aromatisk tyrosin til alanin (Y206A) resulterer i 99% tap AV HAS-aktivitet (HA-produksjon) (Fig . 4A). Tap av denne interaksjonen kunne indirekte ha påvirket polymerbindingen gjennom tilstøtende Arg-205. Tilsvarende fører mutasjon av basisk argininrest ved 214 til alanin (R214A) til fullstendig tap av funksjon (Fig. 4A). Interessant, innføring av negativ ladning (R214E) fører til 93% funksjonstap(Fig. 4A). Disse resultatene gjentar behovet for en netto positiv ladning på dette stedet for å lette polymerbinding og translokasjon. Disse mutasjonene indikerer gjensidig avhengighet av polymerbinding/translokasjon og glykosyltransferaseaktiviteter.
videre ble enzymet kompleksert med de to ligandene (UDP-sukker og disakkarid) energi minimert ved HJELP AV GULE kraftfelt. Figur 3f viser enzymet bundet TIL UDP-n-acetylglukosamin og disakkarid dannet av bundet glukuronsyre og N-acetylglukosamin med glukuronsyre ved polymerenden. Detaljer om minimeringsprotokollen er beskrevet i Metoder.
Gln-248 (SSE7) er kritisk med en plausibel rolle i konformasjonsovergang
Gln-248 Er en konservert rest I SSE7, en lang sløyfe unna bindingsstedet. Den ekvivalente sløyfen i både processive og ikke-processive homologer er sekvensielt forskjellig og viser distinkte konformasjoner i substratbundne og ubundne enzymformer (Fig. 3E (ii)) 29,30,31 Og Fig. 3E (iii) β 1-4 galaktosyltransferase, PDB-kode: 2FYD og 2FY7) 32. Sløyfen I SeHAS vil sannsynligvis lette posisjonering AV SSE8 for katalyse. Residue Gln-248 ligger borte fra bindingslommen; den nøyaktige rollen til denne residuet kunne ikke forutsies basert på disse in-silico-studiene. In-house mutasjon studier viser denne rest å være viktig. Erstatning av resten med Ala resulterer i nær fullstendig tap AV HA-produksjon (Fig. 4A).Rollen av denne rest er videre undersøkt gjennom grovkornet dynamiske studier og er omtalt i et senere avsnitt.
SSEs viser koordinert bevegelse
det nåværende paradigmet er struktur-koder-dynamikk-koder-funksjon33,34,35. Det har i økende grad blitt anerkjent at tilfeldige svingninger av atomer i deres opprinnelige tilstand skjuler koordinert bevegelse som predisponerer proteinet for funksjonelt relevante endringer i struktur. Disse bevegelsene kan fanges av lavfrekvensmoduser i elastisk nettverksmodellering. Disse modusene er kjent for å være ufølsomme for strukturelle og energiske detaljer. Derfor brukte Vi Anisotropisk Nettverksmodellering (ANM), EN ENM-basert tilnærming for å fange globalt bilde av dynamikk kodet av 3-D-strukturen Til SeHAS. Vi brukte ProDy36 FOR ANM beregninger. Ytterligere detaljer er utarbeidet I Metodeseksjonen. Koordinert bevegelse er representert som korrelasjonskoeffisientverdier mellom noder AV ANM-nettverket. De gjennomsnittlige korrelasjonskoeffisientverdiene ble beregnet basert på de første 50 modusene. Figur 5A viser korrelasjonskartet for SeHAS. Positive korrelasjonskoeffisientverdier er indikative for atomer som beveger seg i samme retning. Cluster av romlig proksimale rester med høy korrelasjonskoeffisient anses å være strukturelt og funksjonelt viktig. Restparene med store positive verdier tilsvarer understrukturelle elementer. Videre strekker korrelasjonen mellom restpar til regioner på tvers av forskjellige SSE. SSE1-4 danner et tett interagerende underdomene (svart rektangel). PÅ SAMME måte DANNER SSE5-9 et koordinert interaksjonsdomene (grått rektangel). De to underdomenene er adskilt av en dårlig korrelert region. De iboende globale bevegelsene illustrerer funksjonell koordinering som kreves med hensyn til substratbinding i den ene enden, VED SSE1-4 og polymerbinding i den andre enden (SSE5-9).

Vurdering av global dynamikk I SeHAS. (A) Gjennomsnittlig korrelasjonskoeffisientverdier for SeHAS over restpar. Gjennomsnittlig Korrelasjonskoeffisientverdier For Gln-248 (B) og Thr-283 (C) med andre SeHAS-rester.
Vi utforsket videre dynamikken I SeHAS med hensyn til rester Gln-248. Fig. 5B viser fordelingen av korrelasjonskoeffisientverdier med hensyn til andre rester i SeHAS. Gln-248 viser store positive verdier MED SSE8, 9 og SSE3 som holder katalytiske og substratbindende rester. En koordinert bevegelse med Disse SSEs vurdert GJENNOM ANM illustrerer videre sin rolle i funksjonelt relevant konformasjonsdynamikk.
anm-studien er utvidet for å vurdere effekten av mutasjon på korrelasjonskoeffisientverdiene. For hver av mutantene oppnås en strukturell modell ved Bruk Av RaptorX26. Mutantene viser høy strukturell overlapping med en gjennomsnittlig RMSD på omtrent 1 Å over alle atomer med hensyn TIL wt-proteinstrukturen. For hver mutantstruktur beregnes korrelasjonskoeffisientverdier med hensyn til mutantrester og sammenlignes med WT. Tomtene er vist I Fig. S2. Mutasjoner på sted 214, 248 og 283 viser betydelig forskjell i verdier I SSE-regioner.
Reduserende endepolymerforlengelse I SeHAS, en plausibel tre-trinns mekanisme
i prototypiske medlemmer av glykosyltransferasefamilien GT-2 som cellulosesyntase, oppstår polymerbiosyntesen fra den ikke-reduserende enden av voksende polymer25, 31. I SLIKE systemer fungerer UDP-substrater som en donor som overfører sukkeret til det polymere sukker som fungerer som en akseptor24. En β-kobling mellom sukker er opprettet fra α-koblet sukker-UDP forløpere gjennom EN DIREKTE forskyvning SN2 substitusjonsreaksjon. I denne reaksjonen fungerer et deprotonasjonstrinn ved en katalytisk base akseptoren24. Nukleofil angrep av denne akseptor sukker gruppe på donor via en enkelt oxocarbenium ion-lignende overgang tilstand resulterer i glykosyl overføring reaksjon med utgivelsen AV UDP fra donor sukker og netto inversjon av stereokjemi ved anomere karbon. Denne mekanismen er illustrert I Fig. 6A. SeHAS er forskjellig fra denne prototypen. DET er kjent AT HA forlenges fra den reduserende enden12. DETTE innebærer at (i) UDP frigjøres fra polymerenden og IKKE UDP-substrater under katalyse og (ii) Reversering av donor og akseptorer med HA-UDP som donor og UDP-sukkersubstrat som akseptor. Basert på landskapet av ligandbindende og oppnådd kunnskap om aktiv nettstedsarkitektur, diskuterer vi deltakelse av ligander som donor og akseptor og foreslår en katalytisk mekanisme for glykosyloverføring I SeHAS (Se Fig. 6B).
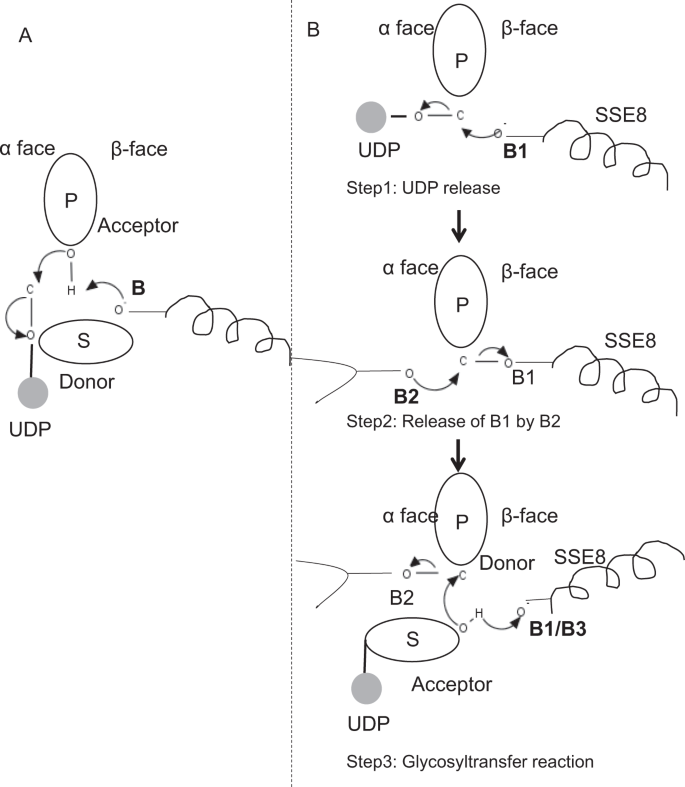
Foreslått molekylær mekanisme I SeHAS. (A) Mekanisme i en prototypisk glykosyltransferase med inversjon kjemi. (B) Foreslatt mekanisme I Klasse I HAR. P: Polymer sukker, S: Substrat sukker.UDP er angitt som en sirkel. B1, B2 Og B3 er de katalytiske basene som deltar i reaksjonsmekanismen.
Glykosyltransferasereaksjon forekommer sannsynligvis i flere trinn
som det første trinnet utforsket vi muligheten for en enkelttrinns glykosyltransferasereaksjon på cellulose syntase-lignende måte. Hvis glykosyltransferasereaksjonen skjer i ett trinn, vil enzymet på et gitt tidspunkt måtte holde to UDP-deler, en festet til polymer og andre festet til innkommende substrat. I det alternative flertrinnsscenariet frigjøres UDP fra polymer før katalytisk reaksjon oppstår. I dette tilfellet, for å skape netto inversjon av stereokjemi, ville reaksjonen oppstå i en rekke ulike antall trinn MED SN2 mekanisme. For å evaluere hvilket scenario som er mer sannsynlig, gjennomførte VI UDP-bindende studier gjennom docking AV UDP-molekyler i glykosyltransferase-domenet. Vurderingen indikerer en signifikant overlapping AV UDP – og UDP-substratbindingssteder.Resultatet er presentert I Supplerende Avsnitt. En eksemplarisk energisk gunstig konformasjon AV UDP sammen med substrat og polymer bindende regioner er vist I Supplerende Fig. S3. Selv om vurderingen er basert på den statiske modellen, plassering av to store molekyler av lignende kjemisk natur i umiddelbar nærhet med krav til lignende fysiokjemiske miljøer er usannsynlig for dette enzymet. Vi spekulerer på at en passasje foret med positivt ladede rester FRA SSE9 og metallion kan lette UDP-frigjøring fra polymerenden. Involvering av metallion i glykosyltransferase FOR UDP-frigjøring er også godt dokumentert24. Siden DE TO UDP-nettstedene ikke er gjensidig utelukkende, virker det andre scenariet for multi-trinns reaksjon mer sannsynlig.
Når UDP er frigjort fra polymer, vil et nukleofilt angrep fra OH–gruppen av substrat-UDP (akseptor) skape en glykosidisk kobling. FOR å skape inversjon MÅ UDP-frigjøring og påfølgende nukleofil angrep forekomme fra to motsatte ansikter av polymer sukker. Vi foreslår rollen som tre basiskatalysatorer i det samlede reaksjonsskjemaet som ligger på α og β av donorsukker ved polymerenden. Disse trinnene er illustrert Gjennom Fig. 6B og beskrevet nedenfor.
Foreslått tre-trinns glykosyltransferasereaksjon
Trinn1: UDP-frigivelse: Asp-260 FRA SSE8 kan fungere som en base (B1) og initiere frigivelsen AV UDP-molekyl fra polymer (donor) fra α-ansikt. Dette trinnet vil skape et kovalent bundet glykosylenzym mellomliggende skjermet på β ansikt med basen B1. For å skape en inversjon må dette ansiktet av sukkeret være fri for nukleofil angrep av innkommende sukker O – h-gruppe. Derfor vil et mellomliggende trinn, med nukleofilt angrep fra α ansikt, frigjøre det β ansiktet klar for nukleofilt angrep av akseptorsukker.
Trinn 2: Frigivelse Av B1 ved B2; Utforsking av Rollen Til Thr-283: Base B2 på α ansikt av donorsukker ville utføre et nukleofilt angrep på det anomere karbonet i reaksjonssenteret og frigjøring B1. Våre strukturelle studier viser konserverte Gln-295 og Thr-283 på dette ansiktet. UDP-frigjøring kan føre til konformasjonsendringer og bringe en av disse rester i nærheten av donorsukker for katalyse. Mutasjon Av Gln-295 resulterer i opptil 90% tap av aktivitet, men rollen som base er ikke kjent20. Vi vurderte muligheten For en konservert Thr-283 bosatt i en løkke for å fungere som den andre basen. Vi muterte Thr Til Ser som inneholder en lignende funksjonell OH-gruppe og Til Ala med liten alifatisk sidekjede. Begge, T283A og T283S mutanter viser ~95% tap AV HA-produksjon (Fig. 4A). Denne rest viser positiv korrelasjon med regioner SSE4 OG SSE6 og et romlig proksimalt område mellom rest 186 og rest 190 (Fig. 5C). Rest 188, men ikke konservert, er i nærheten av dokket substrat (Fig. 3). Thr-283 viser ikke høy positiv korrelasjon med SSE8 som holder katalytisk base. Det er mulig at residuet fungerer som en bærebaserest under katalytisk reaksjon med sin bevegelse koordinert med romlig proksimal substratbindingsregion uavhengig Av Asp – 260 base I SSE8. Ytterligere eksperimenter vil være nødvendig for å underbygge sin rolle som base. Samlet sett fremhever studien enda en funksjonelt kritisk rest, ikke kjent tidligere.
Trinn 3: Glykosyloverføringsreaksjon: når B1 er frigitt, blokkeres det anomere karbonet i det polymere sukker for reaksjonen. Deprotonasjonen av substrat-UDP på samme ansikt med en tredje base ville skape en nukleofil gruppe. Dette trinnet kan initieres Av B1 eller en annen base B3. Asp-259, ved Siden Av B1 er en svært konservert rest i nærheten av substrat-UDP og kan fungere Som B3. Imidlertid er B1/B3 nærmere det polymere sukker (donor) som diskutert I Trinn 1. For å starte deprotonering må B1 være i nærheten av akseptorsukker. Det kan oppnås gjennom konformasjonsendringer PÅ SSE8 assistert AV SSE7. Den ekvivalente helixen i cellulosesyntase holder katalytisk base, og gjennomgår koordinerte konformasjonsoverganger for glykosyltransferasereaksjon og translokasjon. Et nukleofilt angrep av akseptorsukker på det anomere karbon av donorsukker ville skape en glykosidisk kobling og frigjøring av base B2.