- 3-D strukturella egenskaper hos SeHAS
- Substrukturella element (SSE) i klass I har
- bindningsställen för UDP-substrat överlappar
- Lys-139 är dispenserbar i SeHAS och har en roll i substratbindning
- SSE5 binder till polymer och påverkar HA-produktion
- Gln-248 (SSE7) är kritisk med en trolig roll i konformationsövergången
- SSEs uppvisar samordnad rörelse
- reducerande ändpolymerförlängning i SeHAS, en trolig trestegsmekanism
- Glykosyltransferasreaktion uppträder sannolikt i flera steg
- föreslagen trestegs glykosyltransferasreaktion
3-D strukturella egenskaper hos SeHAS
en strukturell modell av SeHAS sekvens genererades med användning av RaptorX webserver26. Modellen erhölls med cellulosasyntasmall (PDB: 4P00).Mallenzymet delar en hög funktionell likhet och en låg sekvenslikhet (~15%) med SeHAS25. Trots den dåliga sekvenslikheten med mallen är den erhållna modellen av hög kvalitet som indikeras av det globala (P-värdet: 10-8) och absoluta (GDT-poäng: 52) kvalitetsmått26. Stereokemisk kvalitetsbedömning av strukturmodellen indikerar att 98,5% av rester finns i tillåten/delvis tillåten region i Ramachandran-tomten.
Figur 1 visar den strukturella modellen för SeHAS. Has-strukturmodellen visar att den enda kedjan viks i tre komponenter: (i) en funktionell glykosyltransferasdomän, (ii) fyra transmembranhelices (TM1-TM4) och (iii) tre amfipatiska helices (AP1-AP3). Glykosyltransferasdomänen antar GT – en vikning bildad av Blandat 7-strängat sackariosark omgivet av halsbandsslipor i arkitekturen för 2-stjärt. Transmembranhelices (TM1-TM4) bildar en fyra helixbunt och skapar en pore för polymertranslokation. 11 C-terminala rester av SeHAS förutses vara störda och visas inte i Fig. 1. Den oligomera naturen hos SeHAS undersöks fortfarande. Fram till 2018 kännetecknades SeHAS för att fungera i sin monomerform9. Nya rapporter visar sehas enzym fungerar som en homodimer27. Omfattningen av detta arbete är begränsat till bedömningen av funktioner i protomeren.

strukturell modell och funktioner i SeHAS. SSE: Substrukturellt element, AP: Amphipathic helix, TM: Trans-membran helix.
3-D-strukturmodellen av SeHAS överensstämmer med tidigare bestämd topologi av HAS I Streptococcus pyogenes härledda med användning av fusion,märkning och proteastillgänglighetsexperiment12,16,19 med en liten skillnad i antalet amfipatiska spiraler. Vi föreslår närvaron av tre amfipatiska spiraler istället för två amfipatiska spiraler som tidigare rapporterats baserat på jämförande bedömning med cellulosasyntasstruktur. SeHAS-rester motsvarande amphipathic helix AP2 har inte undersökts specifikt för deras cellulära lokalisering16. Som diskuteras senare i detta manuskript har denna helix rester av funktionell betydelse.
den strukturella modellen förklarar resultaten av n-etylmaleimid (NEM) hämning i SeHAS19. NEM reagerar med tiolgrupper och används därför för att undersöka rollen av cysteinrester i proteiner. SeHAS har fyra Cys-rester: Cys-226, Cys-262 och Cys-281 och Cys-367. De tre första cysteinresterna finns i cytosol och är därför tillgängliga för NEM som leder till hämning. Cys-367 ligger emellertid i transmembran helix och är otillgänglig för NEM. Därför rapporteras ingen hämning för denna Rest. I närvaro av substrat visas NEM att binda endast till Cys-281. Våra strukturstudier (beskrivs senare) indikerar att Cys-226 och Cys-262 är belägna i närheten av UDP-substratbindningsstället och närvaron av substrat skulle således blockera nem: s tillgång till dessa rester. Cys-281 ligger borta från UDP-bindningsstället och närvaron av substrat blockerar inte denna plats från NEM-hämning.
Substrukturella element (SSE) i klass I har
det finns lite information om de funktionella maskiner som är specifika för klass I har. I frånvaro av 3D-struktur är en funktionell roll av experimentellt studerade platser inte känd. För att få en förståelse för de funktionella komponenterna i SeHAS och deras relativa disposition i 3D identifierar vi därför korta sammanhängande regioner med evolutionärt bevarade sekvensfunktioner som kallas substrukturella element (SSE). Vi jämförde 81 klass I har sekvenser erhållna genom stränga urvalskriterier som utarbetats i avsnittet metoder. Klass I har enzymer skiljer sig åt i antalet transmembranhelices. I avsaknad av strukturell information är anpassningen i denna region av dålig kvalitet. Därför är jämförelsen av sekvenser begränsad till den cytosoliska regionen för att undvika platser med tvetydig Rest-restkorrespondens. Inriktningen av HAS klass i-sekvenser tillhandahålls som kompletterande Fig. S1, skapad med Jalview. En bevarandepoäng beräknas för varje restrestkorrespondens med avseende på SeHAS-sekvensen. En sammanhängande sträcka med Medelpoäng >=70 och minst 2 platser poäng >=80 definieras som sub-structural element (SSE). Med hjälp av dessa kriterier identifierar vi 9 substrukturella element, märkta SSE1-SSE9, av potentiell strukturell/funktionell betydelse i har (Fig. 2). Sekundär struktur för de flesta sses-kartor till loopar utom SSE5, SSE8 och SSE9 som förekommer i spiraler. Dessa element är också markerade i Fig. 1. Tabell 1 sammanfattar sekvensdetaljerna samt SSE: s strukturella och funktionella roll.

en plot av bevarande poäng med avseende på SeHAS sekvensnummer. SSE anges på toppen. Den sekundära strukturprojektionen av sekvensen indikeras längst ner. Strängarna är markerade som pilar och spiraler representerade som rektanglar. Fyllda rektanglar motsvarar amfipatiska spiraler. Se text för detaljer.
våra studierapporter bevarade SSEs: SSE5 och SSE7 specifika för HAS. Mutationer studerade hittills, motsvarande rester Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, har visat sig påverka aktiviteten. Mutationer motsvarande rester Lys-48, Glu-327, Lys-414,Lys-415 påverkar reaktionshastigheten och/eller molekylvikten för ha-polymeren18,19,20,21, 23. De flesta av dessa mutationsställen kartläggs till SSE1-4, 6, 8 och 9 (Tabell 1).Andra webbplatser är inte en bevarad funktion i klass I har familj. Bi et al. (2015) analyserade olika processiva glykosyltransferaser och diskutera närvaron av tre varierande asp-rester i glykosyltransferasdomän, som är avgörande för aktivitet25. Dessa inkluderar Asp från SSE1 i nukleotidbindning, Asp av SSE2 i bindning till metall, Asp i SSE8 med en sannolik roll som bas. Dessutom föreslås en sannolik roll i polymerbindning för rester av SSE9. Weigel (2015) föreslog åtta asp/Glu innehållande tri-peptider som potentiella regioner involverade i UDP-sockerbindning12. För att belysa SSE: s roll och identifiera regioner som är bindande för UDP-socker genomförde vi dockningssimuleringar.
has enzym förväntas ha minst två bindningsställen, en för UDP-sockersubstrat och den andra för polymert socker för att katalysera en glykosidbindningsbildning12. För att identifiera bindningsställena i enzymstrukturen genomförde vi dockningsstudier av UDP-sockersubstrat: UDP-N-acetylglukosamin och UDP-glukuronsyra. Bindningsområdet för UDP-substrat bedöms genom ett rutnät med dess centrum i glykosyltransferasdomänen enligt definitionen i metoder.
bindningsställen för UDP-substrat överlappar
Dockningssimuleringar utförs separat för UDP-N-acetylglukosamin och UDP-glukuronsyra. Lågenergikonformatorer (bättre än 5 kcal/mol) väljs. Figur 3A visar frekvensen av kontakter på olika platser med energiskt gynnsamma konformatorer över olika simuleringskörningar. Polära rester med minst 10% frekvens till något av de två substraten visas. Den anmärkningsvärda observationen från figuren är att bindningsställena för de två sockersubstraten överlappar varandra.

(a) frekvensen av ligandkontaktrester för energiskt gynnsamma konformatorer av UDP-N acetylglukosamin (UDP-GlcNAc) och UDP – D glukuronsyra (UDP-GlcA). Frekvensen plottas på X-axeln och platser på Y-axeln. (B) Roll SSE1–4, SSE8 och SSE9 i UDP-sockersubstrat bindning. (C) Sse6: s roll i ligandbindning. (D) Roll SSEs i polymerbindning. E) SSE7: s roll. i) sse7-slinga i hyaluronansyntas, ii) ekvivalent slinga i cellulosasyntas, iii) ekvivalent slinga i icke-processivt glykosyltransferas. (F) energi minimerad har struktur som visar UDP-N-acetylglukosamin och disackarid av glukuronsyra och N-acetylglukosamin moeities.
de kontaktande resthalternas Roll bedömdes genom att undersöka bindningen med energiskt mest gynnsamma biologiskt relevanta konformer. Valet av konformer styrs av närheten av nukleotidring av UDP till den evolutionära konserverade SSE1 som är känd för att vara involverad i nukleotidbindning. De valda konformerna i bindningsfickan visas i Fig. 3B. SSE1-SSE4, SSE6, SSE8 och SSE9 är involverade i substratbindning (Fig. 3B). SSE1, SSE2 och SSE4 stabiliserar till stor del uridindelen av substraten medan SSE3, SSE8 och SSE9 interagerar med sockerringen. Initial bindning av substratets UDP-ring med enzym kan underlättas av (i) sidokedja av konserverad Asp-103 av SSE2 (blå, Fig. 3B) genom vätebindningar med polära grupper av nukleotid och (ii) genom aromatisk ring av Tyr-74 (grön, Fig. 3B)från SSE1 till och med växelverkan mellan uridin och UDP. Sidokedja av Glu-76 (grön, Fig. 3B) från SSE1 bildar vätebindningar med polära grupper av ribossocker av UDP. Rest asp-161 från SSE4 stabiliserar OH-gruppen av ribosring, medan asp-159 stabiliserar metalljonen. Gln-295 och Arg-298 (blå) från SSE9 kan interagera och stabilisera pyrofosfatgruppen i UDP-nukleotiden. Ne atom av Trp – 299 är i h-bindningsavstånd till sockersubstratet och hjälper sannolikt att orientera substratet. Asp – 260 är topologiskt ekvivalent med den katalytiska basen i cellulosasyntas25. SSE8 håller Asp-260. Sekventiellt proximalt till denna Rest är Asp-259 och Arg-261 som båda interagerar med de polära grupperna i sockerringen (grön). Rest Arg-140, bredvid Lys-139, är delvis bevarad och ersätts endast med Lys i SeHAS homologer. Denna Rest är i närheten av N-terminal änden av helix holding SSE8 (grön). Detta ändamål innehåller negativt laddade asp-rester som kan neutraliseras av Arg-140.
rester från SSE6 (Fig. 3C) skapa en byggnadsställning för att stödja ligander på bindningsplatsen. Slingan är strategiskt placerad och bildar basen av bindande ficka. Slingan sitter också nära katalytisk bas (SSE8) och det bundna polymersockret (diskuteras senare). Som diskuterats ovan placerar experiment med användning av N-etlymaleimid den konserverade Cys-226 av detta element nära UDP-sockerbindningsplats19. Detta är sannolikt involverat i att upprätthålla PKA för mikromiljön på den aktiva platsen. Även om det inte är nödvändigt för aktivitet, har mutation av denna rest till Ala visat sig påverka aktiviteten i SeHAS19,28. Sidokedjan av Ser – 227 är sannolikt involverad i att stabilisera slingkonformationen genom interaktioner med huvudkedjan. Gly – 228 och Pro-229 ger den nödvändiga flexibiliteten och styvheten till huvudkedjans konformation (Fig. 3C).
Lys-139 är dispenserbar i SeHAS och har en roll i substratbindning
Dockningsbedömningar föreslår en roll av Lys-139 i ligandbindning. Tidigare studier har rapporterat en reglerande roll för denna rest i däggdjursformer av HAS. I mus resulterar en mutation till Arg i fullständig aktivitetsförlust24. I avsaknad av några mutationsstudier i SeHAS, för att ytterligare belysa dess roll, genomförde vi mutationsstudier av Lys-139. Detaljer om experimentell inställning och analys beskrivs i metoder. Experimentella resultat och pmbad vektorkarta som används för studien visas i Fig. 4A, B, respektive. Vi muterade Lys-139 till Arg (K139R) i syfte att bevara laddningen vid den positionen. Mutation ledde inte till fullständig förlust av aktivitet, men hade en inverkan. Endast 34% aktivitet (HA-produktion) behölls i jämförelse med kontroll som upprepar en signifikant funktionell roll för denna Rest (Fig. 4A). För att ytterligare undersöka den laddningsbaserade interaktionen mellan denna rest och substrat muterade vi positivt laddade Lys-139 till negativt laddad Asp (K139D). Negativ laddning på platsen leder till bibehållande av 82% aktivitet (HA-produktion) i jämförelse med kontroll. Denna analys föreslår en roll för denna rest i stabiliserande polära grupper av substratet. Valet av substitutioner illustrerar vidare att både positiva och negativt laddade grupper ryms på platsen. Våra studier visar att denna Rest direkt påverkar syntasaktiviteten i SeHAS. Mutationer på denna plats försämrar syntasfunktionen till betydande nivåer.

Mutationsstudier på SeHAS. (A) relativ aktivitet av sehas-mutanter utförda i denna studie. Experiment utfördes i triplikat och standardfelet för HA-titer var i intervallet 0,01 till 0,05. (B) pmbad vektor konstruera. hasA-och hasB-gener från Streptococcus equi subsp. zooepidemicus klonades sekventiellt. För mutationsstudier ersattes hasA wildtype med motsvarande mutant(er).
SSE5 binder till polymer och påverkar HA-produktion
kaviteten ovanför UDP-substratbindningsområdet bildat av amfipatiska spiraler utvärderas för bindning av polymerenhet. Polymerbindningsstudien är begränsad till den terminala disackariden som är involverad i glykosidbindningsbildning. Dockningsstudier genomfördes med ha-disackaridenhet bestående av en 1-4-kopplad N-acetylglukosamin och d-glukuronsyra i glykosyltransferasdomänen. Energiskt gynnsamma konformatorer valdes. Figur 3D visar en ha-disackaridenhet dockad nära bindningsfickan. SSE5, SSE8 och SSE9 är involverade i bindning (Fig. 3D). Rest asp – 260 från SSE8 är i h-bindningsavstånd till terminal OH-grupp av polymeren och indikeras av en streckad linje i Fig. 3D. Arg – 261 från SSE8 ligger nära polymeren och kan interagera med de polära OH-grupperna i sockret. Återstoden Trp – 299 från SSE9 bildar interaktioner mellan Ch och Brasilien med terminalsockret.
så vitt vi vet är detta den första rapporten som antar det funktionella engagemanget av rester från SSE5. Viktiga rester i SSE5 som är involverade i bindning till polymeren är Arg-205, Tyr-206, Phe-210 och Arg-214. Arg – 205 ligger i närheten av den dockade disackariden och är involverad i interaktioner med de negativt laddade polära grupperna av sockerdel. Tyr-206 eller fenylalanin i sehas-homologer ses för att stabilisera Arg-205-återstoden genom katjon-Kazakiska interaktioner. Arg – 214 eller Lys i homologa sekvenser ligger i närheten av polymeren och nära delvis bevarad Phe-210 med vilken den bildar katjon-kambodjanska interaktioner. Konsekvensen av mutation av rester från SSE5 är inte känd. Här undersöker vi konsekvensen av att mutera Tyr-206 och Arg-214 på funktion genom platsstyrd mutagenes. Våra experimentella resultat visar att störning av interaktioner mellan katjon och sacki genom att mutera det aromatiska tyrosinet till alanin (Y206A) resulterar i 99% förlust av HAS-aktivitet (HA-produktion) (Fig. 4A). Förlust av denna interaktion kunde ha indirekt påverkat polymerbindning genom intilliggande Arg-205. På liknande sätt leder mutation av basisk argininrest vid 214 till alanin (R214A) till fullständig funktionsförlust (Fig. 4A). Intressant nog leder införandet av negativ laddning (R214E) till 93% funktionsförlust (Fig. 4A). Dessa resultat upprepar behovet av en nettopositiv laddning på denna plats för att underlätta polymerbindning och translokation. Dessa mutationer indikerar det ömsesidiga beroendet av polymerbindning / translokation och glykosyltransferasaktiviteter.
vidare minimerades enzymet med de två liganderna (UDP-socker och disackarid) energi med användning av BÄRNSTENSKRAFTFÄLT. Figur 3F visar enzymet bundet till UDP-N-acetylglukosamin och disackarid bildat av länkad glukuronsyra och N-acetylglukosamin med glukuronsyra i den polymera änden. Detaljerna om minimeringsprotokollet beskrivs i metoder.
Gln-248 (SSE7) är kritisk med en trolig roll i konformationsövergången
Gln-248 är en konserverad rest i SSE7, en lång slinga bort från bindningsstället. Den ekvivalenta slingan i både processiva och icke-processiva homologer är sekventiellt olika och visar distinkta konformationer i substratbundna och obundna enzymformer (Fig. 3E (ii)) 29,30,31 och Fig. 3e (iii) 1-4 galaktosyltransferas, PDB-kod: 2fyd och 2fy7)32. Slingan i SeHAS kommer sannolikt att underlätta positionering av SSE8 för katalys. Rest Gln – 248 ligger borta från bindningsfickan; den exakta rollen för denna Rest kunde inte förutsägas baserat på dessa In-silico-studier. In-house mutationsstudier visar att denna Rest är viktig. Ersättning av återstoden med Ala resulterar i nästan fullständig förlust av HA-produktion (Fig. 4A).Rollen för denna Rest undersöks ytterligare genom grovkorniga dynamiska studier och diskuteras i ett senare avsnitt.
SSEs uppvisar samordnad rörelse
det nuvarande paradigmet är struktur-kodar-dynamik-kodar-funktion33,34,35. Det har alltmer erkänts att slumpmässiga fluktuationer av atomer i deras ursprungliga tillstånd döljer samordnad rörelse som predisponerar proteinet för funktionellt relevanta förändringar i strukturen. Dessa rörelser kan fångas av lågfrekvenslägen i elastisk nätverksmodellering. Dessa lägen är kända för att vara okänsliga för strukturella och energiska detaljer. Därför använde vi anisotropisk Nätverksmodellering (ANM), ett ENM-baserat tillvägagångssätt för att fånga global bild av dynamik kodad av 3D-struktur av SeHAS. Vi använde ProDy36 för anm-beräkningar. Ytterligare detaljer utarbetas i avsnittet metoder. Koordinerad rörelse representeras som korrelationskoefficientvärden mellan noder i ANM-nätverket. De genomsnittliga korrelationskoefficientvärdena beräknades baserat på de första 50 lägena. Figur 5A visar korrelationskartan för SeHAS. Positiva korrelationskoefficientvärden indikerar atomer som rör sig i samma riktning. Kluster av rumsligt proximala rester med hög korrelationskoefficient anses vara strukturellt och funktionellt viktiga. Restparen med stora positiva värden motsvarar substrukturella element. Vidare sträcker sig korrelationen mellan restpar till regioner över olika SSE. SSE1 – 4 bildar en nära samverkande underdomän (svart rektangel). På samma sätt bildar SSE5-9 en samordnad interagerande underdomän (grå rektangel). De två underdomänerna separeras av en dåligt korrelerad region. De inneboende globala rörelserna illustrerar funktionell samordning som krävs med avseende på substratbindning i ena änden, genom SSE1-4 och polymerbindning i den andra änden (SSE5-9).

bedömning av global dynamik i SeHAS. (A) genomsnittliga korrelationskoefficientvärden för SeHAS över restpar. Genomsnittliga Korrelationskoefficientvärden för Gln-248 (B) och Thr-283 (C) med andra sehas-rester.
vi undersökte vidare dynamiken i SeHAS med avseende på Rest Gln-248. Fig. 5B visar fördelningen av korrelationskoefficientvärden med avseende på andra rester i SeHAS. Gln – 248 visar stora positiva värden med SSE8, 9 och SSE3 som håller katalytiska och substratbindande rester. En samordnad rörelse med dessa SSEs bedömda genom ANM illustrerar vidare sin roll i funktionellt relevant konformationsdynamik.
anm-studien utvidgas för att bedöma effekten av mutation på korrelationskoefficientvärdena. För var och en av mutanten erhålls en strukturell modell med användning av RaptorX26. Mutanterna visar hög strukturell överlappning med en genomsnittlig RMSD på cirka 1 kcal över alla atomer med avseende på WT-proteinstrukturen. För varje mutantstruktur beräknas korrelationskoefficientvärden med avseende på mutantrester och jämförs med WT. Tomterna visas i Fig. S2. Mutationer på plats 214, 248 och 283 uppvisar väsentlig skillnad i värden i SSE-regioner.
reducerande ändpolymerförlängning i SeHAS, en trolig trestegsmekanism
i prototypiska medlemmar av glykosyltransferasfamilj GT-2, såsom cellulosasyntas,sker polymerbiosyntesen från den icke-reducerande änden av växande polymer25, 31. I sådana system fungerar UDP-substrat som en givare som överför sockret till det polymera sockret som fungerar som en acceptor24. En koppling mellan sockerarterna skapas från sockerbundna socker-UDP-prekursorer genom en SN2-substitutionsreaktion med direkt förskjutning. I denna reaktion funktionaliserar ett deprotonationssteg med en katalytisk bas acceptorn24. Nukleofil attack av denna acceptorsockergrupp på givaren via ett enda oxokarbeniumjonliknande övergångstillstånd resulterar i glykosylöverföringsreaktion med frisättning av UDP från givarsockret och nettoinversion av stereokemi vid anomeriskt kol. Denna mekanism illustreras i Fig. 6A. SeHAS skiljer sig från denna prototyp. Det är känt att HA förlänger från den reducerande änden12. Detta innebär (i) UDP frigörs från polymeränden och inte UDP-substrat under katalys och (ii) reversering av givare och acceptorer med HA-UDP som fungerar som givare och UDP-sockersubstrat som acceptor. Baserat på landskapet av ligandbindande och erhållen kunskap om aktiv platsarkitektur diskuterar vi deltagande av ligander som givare och acceptor och föreslår en katalytisk mekanism för glykosylöverföring i SeHAS (se Fig. 6B).
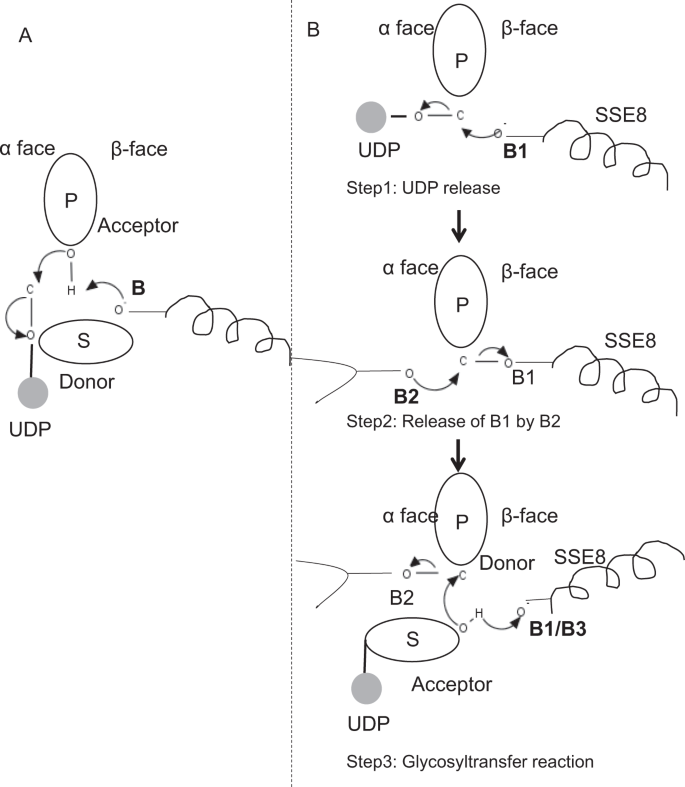
föreslagen molekylär mekanism i SeHAS. (A) mekanism i ett prototypiskt glykosyltransferas med inversion Kemi. (B) föreslagna mekanismen i klass I har. P: Polymersocker, S: Substratsocker.UDP anges som en cirkel. B1, B2 och B3 är de katalytiska baserna som deltar i reaktionsmekanismen.
Glykosyltransferasreaktion uppträder sannolikt i flera steg
som det första steget undersökte vi möjligheten till ett enda steg glykosyltransferasreaktion på cellulosasyntasliknande sätt. Om glykosyltransferasreaktionen sker i ett steg, skulle enzymet vid en given tidpunkt behöva hålla två UDP-delar, en fäst vid polymer och andra fäst vid inkommande substrat. I det alternativa flerstegscenariot frigörs UDP från polymer innan katalytisk reaktion inträffar. I detta fall, för att skapa nettoinversion av stereokemi, skulle reaktion ske i en serie udda antal steg med SN2-mekanism. För att utvärdera vilket scenario som är mer troligt genomförde vi UDP-bindningsstudier genom dockning av UDP-molekyler i glykosyltransferasdomänen. Bedömningen indikerar en signifikant överlappning av UDP-och UDP-substratbindningsställen.Resultatet presenteras i kompletterande avsnitt. En exemplifierande energiskt gynnsam konformation av UDP tillsammans med substrat-och polymerbindningsregioner visas i kompletterande Fig. S3. Även om bedömningen är baserad på den statiska modellen, placering av två stora molekyler av liknande kemisk natur i närheten med krav på liknande fysiokemiska miljöer är osannolikt för detta enzym. Vi spekulerar i att en passage fodrad med positivt laddade rester från SSE9 och metalljon kan underlätta UDP-frisättning från polymeränden. Involvering av metalljon i glykosyltransferas för UDP-frisättning är också väl dokumenterad24. Eftersom de två UDP-platserna inte utesluter varandra, verkar det andra scenariot med flerstegsreaktion mer troligt.
när UDP frigörs från polymer, skulle en nukleofil attack från OH–gruppen av substrat-UDP (acceptor) skapa en glykosidbindning. För att skapa inversion måste UDP-frisättning och efterföljande nukleofil attack ske från två motsatta ytor av polymersocker. Vi föreslår rollen för tre baskatalysatorer i det övergripande reaktionsschemat som ligger på donatorsockrets och askorbins ansikten vid polymeränden. Dessa steg illustreras genom Fig. 6B och beskrivs nedan.
föreslagen trestegs glykosyltransferasreaktion
Steg1: UDP-frisättning: Asp-260 från SSE8 kan fungera som en bas (B1) och initiera frisättningen av UDP-molekyl från polymer (donator) från Bisexuell-ansikte. Detta steg skulle skapa ett kovalent bundet glykosylenzym mellanliggande avskärmad på Bisexuell ansikte med basen B1. För att skapa en inversion måste detta ansikte av sockret vara fritt för nukleofil attack av inkommande socker O-H-grupp. Därför skulle ett mellansteg, med den nukleofila attacken från bisexumens ansikte, frigöra den färdiga för nukleofila attacken av acceptorsocker.
steg 2: frisättning av B1 av B2; utforska rollen av Thr-283: bas B2 på givarsockrets ansikte på gaiboris ansikte skulle utföra en nukleofil attack på det anomera kolet vid reaktionscentret och släppa B1. Våra strukturstudier visar konserverade Gln-295 och Thr-283 på detta ansikte. UDP-frisättning kan resultera i konformationsförändringar och ta med en av dessa rester i närheten av givarsocker för katalys. Mutation av Gln – 295 resulterar i upp till 90% förlust av aktivitet men rollen som bas är inte känd20. Vi bedömde möjligheten att en konserverad Thr-283 bosatt i en slinga för att fungera som den andra basen. Vi muterade Thr till Ser innehållande en liknande funktionell OH-grupp och till Ala med liten alifatisk sidokedja. Båda, t283a och t283s mutanter visar ~95% förlust av HA produktion (Fig. 4A). Denna Rest uppvisar positiv korrelation med regionerna SSE4 och SSE6 och en rumsligt proximal region mellan Rest 186 och rest 190 (Fig. 5C). Rest 188, även om den inte är bevarad, finns i närheten av dockat substrat (Fig. 3). Thr-283 visar inte hög positiv korrelation med SSE8 som håller den katalytiska basen. Det är möjligt att återstoden fungerar som en stödjande basrest under katalytisk reaktion med dess rörelse samordnad med rumsligt proximalt substratbindningsområde oberoende av asp-260-bas i SSE8. Ytterligare experiment skulle krävas för att underbygga sin roll som bas. Sammantaget belyser studien ännu en funktionellt kritisk Rest, inte känd tidigare.
steg 3: Glykosylöverföringsreaktion: när B1 har släppts, blockeras det anomera kolet i det polymera sockret för reaktionen. Deprotonationen av substrat-UDP på samma ansikte med en tredje bas skulle skapa en nukleofil grupp. Detta steg kan initieras av B1 eller en annan bas B3. Asp-259, bredvid B1 är en mycket konserverad rest i närheten av substrat-UDP och kan fungera som B3. B1 / B3 är emellertid närmare det polymera sockret (donatorn) som diskuteras i steg 1. För att initiera deprotonation måste B1 vara i närheten av acceptorsocker. Det kan uppnås genom konformationsförändringar vid SSE8 med hjälp av SSE7. Den ekvivalenta spiralen i cellulosasyntas håller katalytisk bas och genomgår samordnade konformationsövergångar för glykosyltransferasreaktion och translokation. En nukleofil attack av acceptorsockret på givarsockrets anomera kol skulle skapa en glykosidbindning och frisättning av bas B2.