- 3-D Strukturální rysy SeHAS
- Substrukturální prvky (SSE) ve třídě I mají
- vazebná místa UDP-substrátů se překrývají
- Lys-139 je zbytečný v SeHAS a má roli v substrátu vazba
- SSE5 váže na polymer a vlivy HA produkce
- Gln-248 (SSE7) je kritická s věrohodné roli v konformaci přechod
- SSEs vykazují koordinovaného pohybu
- Snížení polymer prodloužení v SeHAS, věrohodné třístupňový mechanismus
- Glycosyltransferase reakce pravděpodobně probíhá v několika krocích
- Navrhovaných tří kroků glycosyltransferase reakce
3-D Strukturální rysy SeHAS
strukturální model SeHAS sekvence byla generována pomocí RaptorX webserver26. Model byl získán se šablonou celulózové syntázy (PDB: 4P00).Templátový enzym sdílí vysokou funkční podobnost a nízkou sekvenční podobnost (~15%) se SeHAS25. I přes špatnou sekvenční podobnost se šablonou je získaný model vysoce kvalitní, jak ukazuje globální (hodnota P: 10-8)a absolutní (skóre GDT: 52) měření kvality26. Stereo-chemické hodnocení kvality strukturální model naznačuje, že 98,5% zbytky jsou umístěny v povolených/částečně povoleno oblasti Ramachandran plot.
Obrázek 1 ukazuje strukturální model SeHAS. Strukturální model HAS ukazuje, že jeden řetězec se skládá do tří složek: (i) funkční glycosyltransferase domény, (ii) čtyři transmembránové šroubovice (TM1-TM4) a (iii) tři amphipathic šroubovice (AP1-AP3). Na glycosyltransferase domény přijímá GT-fold tvořen smíšené 7-pletl β list obklopené α šroubovice na β/α architektury. Transmembránové šroubovice (TM1-TM4) tvoří čtyřšroubovicový svazek a vytvářejí póry pro translokaci polymeru. 11 předpokládá se, že C-koncová rezidua Seha jsou neuspořádaná a nejsou znázorněna na obr. 1. Oligomerní povaha SeHAS je stále zkoumána. Až do roku 2018 byl SeHAS charakterizován tak, že fungoval ve své monomerní formě9. Nedávné zprávy naznačují, že funkce enzymu SeHAS jako homodimer27. Rozsah této práce je omezen na posouzení vlastností v protomeru.

Strukturální model a vlastnosti SeHAS. SSE: Substrukturální prvek, AP: Amfipatická šroubovice, TM: Trans-membránová šroubovice.
3-D strukturální model SeHAS je v souladu s předem stanovenou topologii MÁ v Streptococcus pyogenes odvozeny pomocí fusion, označování a proteázy dostupnost experiments12,16,19 s mírný rozdíl v počtu amphipathic šroubovice. Navrhujeme přítomnost tří amfipatických helixů místo dvou amfipatických helixů dříve hlášených na základě srovnávacího hodnocení se strukturou celulózové syntázy. Zbytky SeHAS odpovídající amfipatické šroubovice AP2 nebyly zkoumány specificky pro jejich buněčnou lokalizaci16. Jak je popsáno později v tomto rukopisu, tato šroubovice má zbytky funkčního významu.
strukturální model vysvětluje výsledky inhibice N-ethylmaleimidu (NEM) v SeHAS19. NEM reaguje s thiolovými skupinami, a proto se používá ke zkoumání úlohy cysteinových zbytků v proteinech. SeHAS má čtyři zbytky Cys: Cys-226, Cys-262 A Cys-281 a CYS-367. První tři cysteinové zbytky jsou umístěny v cytosolu, a proto jsou přístupné NEM, což vede k inhibici. Cys-367 je však umístěn v transmembránové spirále a je nepřístupný pro NEM. Proto není u tohoto rezidua hlášena žádná inhibice. V přítomnosti substrátu je prokázáno, že NEM se váže pouze na Cys-281. Naše strukturální studie (popsané později) naznačují, že Cys-226 a Cys-262 se nachází v těsné blízkosti UDP-substrát vazebné místo a přítomnosti substrátu by tak zablokovat přístup NEM těchto zbytků. Cys-281 leží daleko od místa vazby UDP a přítomnost substrátu neblokuje Toto místo před inhibicí NEM.
Substrukturální prvky (SSE) ve třídě I mají
o funkčním stroji specifickém pro třídu I je málo informací. Při absenci 3-D struktury není známa funkční role experimentálně studovaných míst. Proto, získat pochopení na funkční komponenty v SeHAS a jejich relativní dispozice v 3-D, jsme se identifikovat krátké sousedících regionech s evolučně konzervované sekvence funkce nazývá sub-strukturální prvky (SSE). Porovnali jsme 81 třída I má sekvence získané přísnými výběrovými kritérii rozpracovanými v sekci metody. Třída I má enzymy se liší v počtu transmembránových šroubovice. Při absenci strukturálních informací je zarovnání v této oblasti nekvalitní. Porovnání sekvencí je tedy omezeno na cytosolickou oblast, aby se zabránilo místům s nejednoznačnou korespondencí reziduí a reziduí. Zarovnání sekvencí HAS třídy I je poskytnuto jako doplňkový obr. S1, vytvořeno pomocí Jalview. Skóre konzervace se vypočítá pro každou korespondenci reziduí a reziduí s ohledem na sekvenci SeHAS. Souvislý úsek s průměrným skóre >=70 a alespoň 2 stránky bodování >=80 je definován jako dílčí konstrukční prvek (SSE). Pomocí těchto kritérií identifikujeme 9 dílčích strukturních prvků, označených SSE1-SSE9, potenciálního strukturálního / funkčního významu v HAS (obr. 2). Sekundární struktura pro většinu SSEs mapuje smyčky s výjimkou SSE5, SSE8 a SSE9, které se vyskytují v šroubovice. Tyto prvky jsou také označeny na obr. 1. Tabulka 1 shrnuje detaily sekvence, jakož i strukturální a funkční roli SSE.

pozemek o zachování skóre s ohledem na SeHAS pořadové číslo. SSE je uvedeno nahoře. Projekce sekvence sekundární struktury je uvedena ve spodní části. Prameny jsou označeny jako šipky a šroubovice reprezentované jako obdélníky. Vyplněné obdélníky odpovídají amfipatickým šroubovice. Viz text pro podrobnosti.
naše studijní zprávy konzervované SSEs: SSE5 a sse7 specifické pro HAS. Dosud studované mutace, odpovídající reziduím Tyr-74, Asp-159, Ser-218, Cys-226. Leu-230, Tyr-233, Arg-234, Asp-259, Asp-260, Arg-261, Leu-263, Cys-281, Gln-295, Gln-296, Asn-297, Arg-298, Trp-299, Arg-406, Arg-413, ukázaly na vliv činnosti. Mutace odpovídající rezidua Lys-48, Glu-327, Lys-414, Lys-415 ovlivnit rychlost reakce a/nebo molekulární hmotnost HA polymer18,19,20,21,23. Většina těchto mutačních míst mapuje na SSE1-4, 6, 8 a 9 (Tabulka 1).Jiné weby nejsou konzervovanou vlastností rodiny třídy I. Bi et al. (2015) analyzoval různé procesivní glykosyltransferázy a diskutoval o přítomnosti tří variabilně rozložených zbytků Asp v doméně glykosyltransferázy, které jsou rozhodující pro aktivitu25. Patří sem Asp ze sse1 ve vazbě na nukleotidy, Asp SSE2 ve vazbě na kov, Asp v SSE8 s pravděpodobnou rolí báze. Kromě toho je pro rezidua SSE9 navržena pravděpodobná role ve vazbě polymeru. Weigel (2015) navrhl osm Asp / Glu obsahujících tri-peptidy jako potenciální oblasti zapojené do vázání UDP-cukru12. Abychom objasnili roli SSE a identifikovali oblasti vázající se na UDP-cukry, provedli jsme dokovací simulace.
MÁ enzym se očekává, že mají alespoň dvě vazebná místa, jedno pro UDP-cukr substráty a jiné pro polymerní cukru katalyzovat glykosidická vazba formation12. K identifikaci vazebných míst v enzymové struktuře jsme provedli dokovací studie UDP-cukrových substrátů: UDP-N-acetylglukosamin a kyselina UDP-glukuronová. Vazebná oblast pro UDP substráty se hodnotí pomocí mřížky s jejím středem v doméně glykosyltransferázy, jak je definováno v metodách.
vazebná místa UDP-substrátů se překrývají
dokovací simulace se provádějí odděleně pro UDP-N-acetylglukosamin a kyselinu UDP-glukuronovou. Jsou vybrány nízkoenergetické konformery (lepší než 5 kcal / mol). Obrázek 3A ukazuje frekvenci kontaktů různých míst s energeticky příznivými konformery v různých simulačních bězích. Jsou znázorněna polární rezidua s frekvencí alespoň 10% na kterémkoli ze dvou substrátů. Pozoruhodné pozorování z obrázku je, že vazebná místa pro dva cukrové substráty se překrývají.

(A) Četnost ligand kontaktování zbytků pro energeticky příznivé conformers UDP-N-Acetylglukosamin (UDP-GlcNAc) a UDP – D-Glukuronová kyselina (UDP-GlcA). Frekvence je vynesena na ose X a místa na ose Y. B) úloha SSE1-4, SSE8 a SSE9 ve vazbě UDP-cukrového substrátu. C) úloha SSE6 při vazbě ligandu. D) úloha SSEs ve vazbě polymerů. E) úloha SSE7. (i) SSE7 smyčky v hyaluronan syntázy, (ii) Ekvivalentní smyčky v celulosa syntázy, (iii) Ekvivalentní smyčky v non-processive glycosyltransferase. F) minimalizovaná energie má strukturu UDP-N-acetylglukosaminu a disacharidu kyseliny glukuronové a n-acetylglukosaminu.
úloha kontaktních reziduí byla hodnocena zkoumáním vazby s energeticky nejpříznivějším biologicky relevantním konformerem. Výběr conformer je veden v blízkosti nukleotidu prsten z UDP na evoluční zachovaných SSE1 známo, že se podílí nukleotidů závazné. Vybrané konformery ve vazebné kapse jsou znázorněny na obr. 3B. SSE1-SSE4, SSE6, SSE8 a SSE9 se podílejí na vazbě substrátu (obr. 3B). SSE1, SSE2 a SSE4 do značné míry stabilizovat uridin část substráty, zatímco SSE3, SSE8 a SSE9 komunikovat s cukrem prsten. Počáteční vazba UDP-kroužku substrátu s enzymem by mohla být usnadněna (i) postranním řetězcem konzervovaného Asp-103 SSE2 (modrá, obr. 3B) vodíkovými vazbami s polárními skupinami nukleotidů a (ii) aromatickým kruhem Tyr-74 (zelená, obr. 3B) od SSE1 přes π-π interakce s uridinovým kruhem UDP. Boční řetězec Glu-76 (zelená, obr. 3B) z SSE1 tvoří vodíkové vazby s polárními skupinami ribózového cukru UDP. Zbytek Asp-161 ze SSE4 stabilizuje OH skupinu ribózového kruhu, zatímco Asp-159 stabilizuje kovový iont. Gln-295 a Arg-298 (modrá) ze SSE9 by mohly interagovat a stabilizovat pyrofosfátovou skupinu nukleotidu UDP. NE atom Trp-299 je v H-vazebné vzdálenosti k cukrovému substrátu a pravděpodobně pomáhá při orientaci substrátu. Asp-260 je topologicky ekvivalentní katalytické bázi v celulózové syntáze 25. SSE8 drží Asp-260. Sekvenčně proximálně k tomuto zbytku jsou Asp-259 a Arg-261, které interagují s polárními skupinami cukrového kruhu (zelené). Zbytek Arg-140, vedle Lys-139, je částečně konzervován a nahrazen pouze Lys v SeHAS homologues. Tento zbytek je v těsné blízkosti n-koncového konce helix holding SSE8 (zelená). Tento konec obsahuje záporně nabité zbytky Asp, které by mohly být neutralizovány ARG-140.
zbytky z SSE6 (obr. 3C) vytvořte lešení pro podporu ligandů v místě vazby. Smyčka je strategicky umístěna a tvoří základnu vázací kapsy. Smyčka také sedí v blízkosti katalytické báze (SSE8)a vázaného polymerního cukru (diskutováno později). Jak bylo uvedeno výše, experimenty používající N-ethlymaleimid umístí konzervovanou Cys-226 tohoto prvku do blízkosti vazebného místa UDP-cukru19. To se pravděpodobně podílí na udržování pKa mikroprostředí v aktivním místě. I když to není nezbytné pro aktivitu, ukázalo se, že mutace tohoto zbytku na Ala ovlivňuje aktivitu v SeHAS19, 28. Boční řetězec Ser-227 se pravděpodobně podílí na stabilizaci konformace smyčky interakcemi s hlavním řetězcem. Gly-228 a Pro-229 poskytují potřebnou pružnost a tuhost konformaci hlavního řetězce (obr. 3C).
Lys-139 je zbytečný v SeHAS a má roli v substrátu vazba
Dokovací hodnocení naznačují roli Lys-139 v ligand vazba. Předchozí studie uváděly regulační úlohu pro tento zbytek v savčích formách HAS. U myší vede mutace na Arg k úplné ztrátě aktivity24. Při absenci jakýchkoli mutačních studií v SeHAS, abychom dále objasnili jeho roli, jsme provedli mutační studie Lys-139. Podrobnosti o experimentálním nastavení a testu jsou popsány v metodách. Experimentální výsledky a vektorová mapa pMBAD použitá pro studii jsou uvedeny na obr. 4a, respektive B. Zmutovali jsme Lys-139 na Arg (K139R) s cílem zachovat náboj na této pozici. Mutace nevedla k úplné ztrátě aktivity, ale měla dopad. Pouze 34% aktivita (produkce HA) byla zachována ve srovnání s kontrolou, která opakuje významnou funkční úlohu tohoto zbytku (obr. 4A). Dále sonda poplatek-založené na interakci mezi tento zbytek a substrátu, máme zmutované kladně nabitých Lys-139 záporně nabitý Asp (K139D). Záporný náboj v místě vede k udržení 82% aktivity (produkce HA) ve srovnání s kontrolou. Tato analýza naznačuje roli tohoto zbytku při stabilizaci polárních skupin substrátu. Výběr substitucí dále ilustruje, že na místě jsou ubytovány kladné i záporně nabité skupiny. Naše studie ukazují, že tento zbytek přímo ovlivňuje aktivitu syntázy v SeHAS. Mutace v tomto místě narušují funkci syntázy na značné úrovně.

mutační studie na SeHAS. (A) relativní aktivita mutantů SeHAS provedená v této studii. Pokusy byly prováděny ve trojnásobcích a standardní chyba pro titr HA byla v rozmezí ±0,01 až ±0,05. B) vektorový konstrukt pMBAD. hasA a hasB geny od Streptococcus equi subsp. zooepidemicus byly postupně klonovány. Pro mutační studie byl Hasa wildtype nahrazen odpovídajícími mutanty.
SSE5 váže na polymer a vlivy HA produkce
dutiny nad UDP-substrát závazné regionu tvoří amphipathic šroubovice je hodnocena pro vazbu polymeru jednotky. Studie vazby polymeru je omezena na terminální disacharid, který se podílí na tvorbě glykosidické vazby. Dokovací byly provedeny studie s HA disacharidové jednotky obsahující β 1-4 spojeny N-acetylglukosamin a D-Glukuronové kyseliny v glycosyltransferase domény. Byly vybrány energeticky příznivé konformery. Obrázek 3D ukazuje ha disacharidovou jednotku zakotvenou poblíž vázací kapsy. SSE5, SSE8 a SSE9 se podílejí na vazbě (obr. 3D). Zbytek Asp-260 z SSE8 je v H-vazebné vzdálenosti ke koncové OH skupině polymeru a je označen čárkovanou čarou na obr. 3D. Arg-261 od SSE8 leží v blízkosti polymeru a může interagovat s polárními OH skupinami cukru. Zbytek Trp-299 ze SSE9 tvoří ch-π interakce s koncovým cukrem.
to nejlepší z našich znalostí, toto je první zpráva vychází z hypotéz, funkční zapojení zbytky z SSE5. Klíčové zbytky v SSE5 podílející se na vazbě na polymer jsou Arg-205, Tyr-206, Phe-210 a Arg-214. Arg-205 je v těsné blízkosti zakotvila disacharid a podílí se interakcí s negativně nabitých polárních skupin cukru skupinu. Tyr-206 nebo fenylalanin v SeHAS homologues je vidět stabilizovat zbytek Arg-205 prostřednictvím kationtů-π interakcí. Arg-214 nebo Lys v homologních sekvencích je v těsné blízkosti polymeru a blízko částečně konzervovaného Phe-210, s nímž vytváří interakce kation-π. Důsledek mutace reziduí ze SSE5 není znám. Zde zkoumáme důsledky mutace Tyr-206 a Arg-214 na funkci prostřednictvím mutageneze zaměřené na místo. Naše experimentální výsledky ukazují, že narušení interakcí kationtů-π mutací aromatického tyrosinu na alanin (Y206A) vede k 99% ztrátě aktivity HAS (produkce HA) (obr. 4A). Ztráta této interakce mohla nepřímo ovlivnit vazbu polymeru přes sousední Arg-205. Podobně mutace základní arginin reziduí na 214 alanin (R214A) vede k úplné ztrátě funkce (Obr. 4A). Zajímavé je, že zavedení záporného náboje (R214E) vede k 93% ztrátě funkce (obr. 4A). Tyto výsledky opakují potřebu čistého kladného náboje v tomto místě, aby se usnadnila vazba a translokace polymerů. Tyto mutace naznačují vzájemnou závislost polymerové vazby / translokace a aktivit glykosyltransferázy.
dále byl enzym komplexovaný s dvěma ligandy (UDP-cukr a disacharid) minimalizován energií pomocí jantarových silových polí. Obrázek 3F ukazuje enzym vázán na UDP-N-acetylglukosamin a disacharid tvořený spojené glukuronová a N-acetylglukosamin s kyselinou glukuronovou na polymerní konce. Podrobnosti o minimalizačním protokolu jsou popsány v metodách.
Gln-248 (SSE7) je kritická s věrohodné roli v konformaci přechod
Gln-248 je zachovaných zbytků v SSE7, dlouhé smyčky, daleko od vazebné místo. Ekvivalentní smyčka v procesivních i neprocesivních homologech je postupně odlišná a vykazuje odlišné konformace ve formách enzymů vázaných na substrát a nevázaných (obr. 3E(ii)) 29,30,31 a obr. 3e (iii) β 1-4 galaktosyltransferáza, PDB kód: 2FYD a 2FY7) 32. Smyčka v SeHAS pravděpodobně usnadní umístění SSE8 pro katalýzu. Reziduum Gln-248 leží daleko od vazebné kapsy; na základě těchto studií in-silico nebylo možné předpovědět přesnou úlohu tohoto rezidua. Interní mutační studie ukazují, že tento zbytek je důležitý. Nahrazení zbytku Ala má za následek téměř úplnou ztrátu produkce HA (obr. 4A).Úloha tohoto zbytku je dále zkoumána pomocí hrubozrnných dynamických studií a je diskutována v pozdější části.
SSEs vykazují koordinovaného pohybu
aktuální paradigma je struktura-kóduje-dynamika-kóduje-function33,34,35. Stále více se uznává, že náhodné fluktuace atomů v jejich přirozeném stavu skrývají koordinovaný pohyb, který predisponuje protein k funkčně relevantním změnám ve struktuře. Tyto pohyby mohou být zachyceny nízkofrekvenčními režimy v modelování elastické sítě. Je známo, že tyto režimy jsou necitlivé na strukturální a energetické detaily. Proto jsme použili anizotropní modelování sítí (ANM), přístup založený na ENM k zachycení globálního obrazu dynamiky kódovaného 3-D strukturou SeHAS. Použili jsme ProDy36 pro výpočty ANM. Další podrobnosti jsou rozpracovány v sekci metody. Koordinovaný pohyb je reprezentován jako hodnoty korelačního koeficientu mezi uzly sítě ANM. Průměrné hodnoty korelačního koeficientu byly vypočteny na základě prvních 50 režimů. Obrázek 5A ukazuje korelační mapu pro SeHAS. Pozitivní hodnoty korelačního koeficientu svědčí o atomech pohybujících se stejným směrem. Shluk prostorově proximálních zbytků s vysokým korelačním koeficientem je považován za strukturálně a funkčně důležitý. Páry reziduí s velkými kladnými hodnotami odpovídají dílčím konstrukčním prvkům. Dále, korelace mezi páry reziduí se rozšiřuje na oblasti napříč různými SSE. SSE1-4 tvoří úzce interagující subdoménu (černý obdélník). Podobně sse5-9 tvoří koordinovanou interagující subdoménu (šedý obdélník). Obě subdomény jsou odděleny špatně korelovanou oblastí. Vnitřní globální pohyby ilustrují funkční koordinace nutná s ohledem na substrát, vazba na jednom konci, SSE1-4 a polymeru, vazba na druhém konci (SSE5-9).

Hodnocení global dynamics v SeHAS. A) průměrné hodnoty korelačního koeficientu pro Seha napříč páry reziduí. Průměrné hodnoty korelačního koeficientu pro Gln-248 (B) a Thr-283 (C) s ostatními zbytky SeHAS.
dále jsme zkoumali dynamiku SeHAS s ohledem na zbytek Gln-248. Obr. 5B ukazuje rozdělení hodnot korelačního koeficientu s ohledem na ostatní rezidua v SeHAS. Gln-248 vykazují velké kladné hodnoty s SSE8, 9 a SSE3, které drží katalytické a substrátové vazebné zbytky. Koordinovaný pohyb s těmito SSEs hodnocenými prostřednictvím ANM dále ilustruje jeho roli ve funkčně relevantní konformační dynamice.
studie ANM je rozšířena o posouzení vlivu mutace na hodnoty korelačního koeficientu. Pro každý z mutantů se získá strukturální model pomocí RaptorX26. Mutanti vykazují vysoké strukturální překrývání s průměrným RMSD asi 1 Å napříč všemi atomy s ohledem na strukturu proteinu WT. Pro každou strukturu mutantů jsou vypočteny a porovnány hodnoty korelačního koeficientu vzhledem k mutantnímu zbytku s WT. Grafy jsou znázorněny na obr. S2. Mutace v místě 214, 248 a 283 vykazují podstatný rozdíl v hodnotách v oblastech SSE.
Snížení polymer prodloužení v SeHAS, věrohodné třístupňový mechanismus
V prototypem členové glycosyltransferase rodiny GT-2, jako jsou celulosa syntázy, polymer biosyntéze dochází z neredukující konec rostoucí polymer25,31. V takových systémech UDP substráty působí jako dárce, který přenáší cukr na polymerní cukr, který působí jako akceptor24. Β-vazba mezi cukry je vytvořena z prekurzorů cukru a UDP vázaných na α přímou substituční reakcí SN2. Při této reakci deprotonační krok katalytickou bází funkcionalizuje akceptor24. Nucleophilic útok tímto dodavatelem cukru skupiny na dárce prostřednictvím jediného oxocarbenium ion-jako přechodový stav výsledků v glykosyl převod reakce s vydáním UDP od dárce cukru a čistého inverze stereochemie na anomerní uhlík. Tento mechanismus je znázorněn na obr. 6A. SeHAS se liší od tohoto prototypu. Je známo, že HA se prodlužuje od redukčního konce12. To znamená, že (i) UDP se uvolňuje z polymerního konce a ne UDP substrátů během katalýzy a (ii) obrácení dárce a akceptorů s HA-UDP působícím jako donor a UDP-cukrový substrát jako akceptor. Na základě krajiny vazby ligandu a získaných znalostí o architektuře aktivního místa diskutujeme účast ligand jako dárce a akceptoru a navrhujeme katalytický mechanismus přenosu glykosylu v SeHAS (viz obr. 6B).
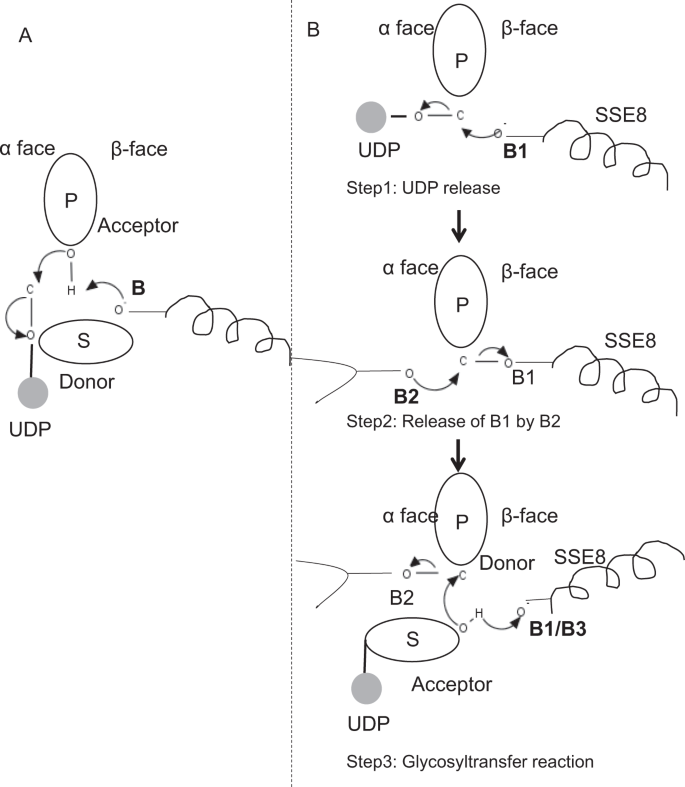
Navržené molekulární mechanismus v SeHAS. A) mechanismus v prototypové glykosyltransferáze s inverzní chemií. B) navrhovaný mechanismus ve třídě I má. P: polymerní cukr, S: substrátový cukr.UDP je označen jako kruh. B1, B2 A B3 jsou katalytické báze účastnící se reakčního mechanismu.
Glycosyltransferase reakce pravděpodobně probíhá v několika krocích
Jako první krok, jsme zkoumali možnost jediném kroku glycosyltransferase reakce v celulosa syntázy-jako způsob. Pokud dojde k glykosyltransferázové reakci v jednom kroku, enzym by v daném čase musel držet dvě skupiny UDP, jednu připojenou k polymeru a druhou připojenou k příchozímu substrátu. V alternativním vícestupňovém scénáři se UDP z polymeru uvolní před katalytickou reakcí. V tomto případě by k vytvoření čisté inverze stereochemie došlo k reakci v řadě lichého počtu kroků s mechanismem SN2. Abychom vyhodnotili, který scénář je pravděpodobnější, provedli jsme studie vazby UDP pomocí dokování molekul UDP v doméně glykosyltransferázy. Hodnocení naznačuje významné překrývání vazebných míst UDP a UDP-substrát.Výsledek je uveden v doplňkové části. Jedna příkladná energeticky příznivá konformace UDP spolu s vazebnými oblastmi substrátu a polymeru je znázorněna na doplňkovém obr. Galaxie. Ačkoli je hodnocení založeno na statickém modelu, umístění dvou velkých molekul podobné chemické povahy v těsné blízkosti s požadavky podobných fyziochemických prostředí je pro tento enzym nepravděpodobné. Spekulujeme, že průchod lemovaný kladně nabitými zbytky z SSE9 a kovového iontu by mohl usnadnit uvolňování UDP z polymerního konce. Zapojení kovových iontů do glykosyltransferázy pro uvolňování UDP je také dobře zdokumentováno24. Vzhledem k tomu, že se dvě stránky UDP vzájemně nevylučují, je pravděpodobnější druhý scénář vícestupňové reakce.
jakmile se UDP uvolní z polymeru, nukleofilní útok ze skupiny OH substrátu–UDP (akceptor) by vytvořil glykosidickou vazbu. K vytvoření inverze musí dojít k uvolnění UDP a následnému nukleofilnímu útoku ze dvou protilehlých stran polymerního cukru. Navrhujeme roli tři základní katalyzátory v celkové reakční schéma, které leží na α a β tváře dárce cukru v polymeru konce. Tyto kroky jsou znázorněny na obr. 6B a je popsáno níže.
Krok 1: UDP vydání: Asp-260 z SSE8 může působit jako základní (B1) a iniciovat vydání UDP molekuly z polymeru (dárce) z α-face. Tento krok by vytvořil kovalentně vázaný glykosylový enzym meziprodukt stíněný na β ploše bází báze B1. Chcete-li vytvořit inverzi, musí být tato tvář cukru volná pro nukleofilní útok příchozí skupinou cukru O-H. Přechodný krok s nukleofilním útokem z α obličeje by tedy uvolnil β tvář připravenou k nukleofilnímu útoku akceptorovým cukrem.
Krok 2: Uvolněte z B1 do B2; Zkoumání role Thr-283: Základní B2 na α tvář dárce cukru by provést nucleophilic útok na anomerní uhlík na reakční centrum a uvolnění B1. Naše strukturální studie ukazují zachovalé Gln-295 a Thr-283 na této tváři. Uvolnění UDP může mít za následek konformační změny a přivést jeden z těchto zbytků do blízkosti dárcovského cukru pro katalýzu. Mutace Gln-295 vede až k 90% ztrátě aktivity, ale role báze není známa20. Posuzovali jsme možnost, že by konzervovaný Thr-283 zůstal ve smyčce, aby fungoval jako druhá základna. Mutovali jsme Thr na Ser obsahující podobnou funkční OH skupinu a na Ala s malým alifatickým postranním řetězcem. Oba mutanti T283A a T283S vykazují ~95% ztrátu produkce HA (obr. 4A). Tento zbytek vykazuje pozitivní korelaci s oblastmi SSE4 a SSE6 a prostorově proximální oblastí mezi reziduem 186 a reziduem 190 (obr. 5C). Zbytek 188, i když není konzervován, je v blízkosti zakotveného substrátu (obr. 3). Thr-283 nevykazuje vysokou pozitivní korelaci s SSE8 držící katalytickou bázi. Je možné, že zbytek působí jako podpůrné základny reziduí během katalytické reakce s jeho pohybu koordinována s prostorově proximální substrátu závazné regionu nezávislé Asp-260 základny v SSE8. Další experimenty by byly nutné k doložení jeho role jako základny. Celkově studie zdůrazňuje další funkčně kritický zbytek, který nebyl dříve znám.
Krok 3: Glykosyl převod reakce: Jakmile B1 je propuštěn, β tvář anomerní uhlík z polymerních cukr je odblokován pro reakci. Deprotonace substrátu-UDP na stejné ploše třetí bází by vytvořila nukleofilní skupinu. Tento krok by mohl být iniciován B1 nebo jinou základnou B3. Asp-259, vedle B1 je vysoce konzervovaný zbytek v blízkosti substrátu-UDP a mohl by působit jako B3. B1 / B3 je však blíže polymernímu cukru (dárci), jak je popsáno v kroku 1. Pro zahájení deprotonace musí být B1 v blízkosti akceptorového cukru. Toho lze dosáhnout pomocí konformačních změn na SSE8 za pomoci SSE7. Ekvivalent helix v celulosa syntázy má katalytické základny a prochází koordinované konformační přechody pro glycosyltransferase reakce a translokace. Nukleofilní útok akceptorového cukru na anomerní uhlík dárcovského cukru by vytvořil glykosidickou vazbu a uvolnění báze B2.